














所属成套资源:2025年高考化学大一轮复习讲义【配套PPT+教师版+学生版+同步练习】
2025年高考化学大一轮大单元三 第八章 第33讲 化学键(课件+讲义+练习)
展开
这是一份2025年高考化学大一轮大单元三 第八章 第33讲 化学键(课件+讲义+练习),文件包含大单元三第八章第33讲化学键pptx、大单元三第八章第33讲化学键教师版docx、大单元三第八章第33讲化学键学生版docx、第八章第33练化学键同步练习docx等4份课件配套教学资源,其中PPT共60页, 欢迎下载使用。
1、全面、系统复习回顾基本知识。了解知识规律的来龙去脉,透彻理解概念的内涵外延,让学生经历教材由薄变厚的过程。要正确理解基础,不是会做几个简单题就叫基础扎实。对于一轮复习,基础就是像盖房子一样,需要着力做好两件大事:一是夯实地基,二是打好框架。2、扎实训练学科基本技能、理解感悟学科基本方法。一轮复习,要以教材为本,全面细致的回顾课本知识,让学生树立“教材是最好的复习资料”的观点,先引导学生对教材中所涉及的每个知识点进行重新梳理,对教材中的概念、定理、定律进一步强化理解。3、培养学生积极的学习态度、良好的复习习惯和运用科学思维方法、分析解决问题的能力。落实解题的三重境界:一是“解”,解决问题。二是“思”,总结解题经验和方法。三是“归”,回归到高考能力要求上去。解题上强化学生落实三个字:慢(审题),快(书写),全(要点全面,答题步骤规范)。 4、有计划、有步骤、有措施地指导学生补齐短板。高三复习要突出重点,切忌主次不分,无的放矢。要在“精讲”上下足功夫。抓住学情,讲难点、重点、易混点、薄弱点;讲思路、技巧、规范;讲到关键处,讲到点子上,讲到学生心里去。
2025年高考化学大一轮复习
1.掌握化学键的定义及离子键、共价键的形成。2.会书写电子式。3.了解共价键的类型及键参数。
考点一 化学键与化合物类型 电子式
考点二 共价键及其参数
化学键与化合物类型 电子式
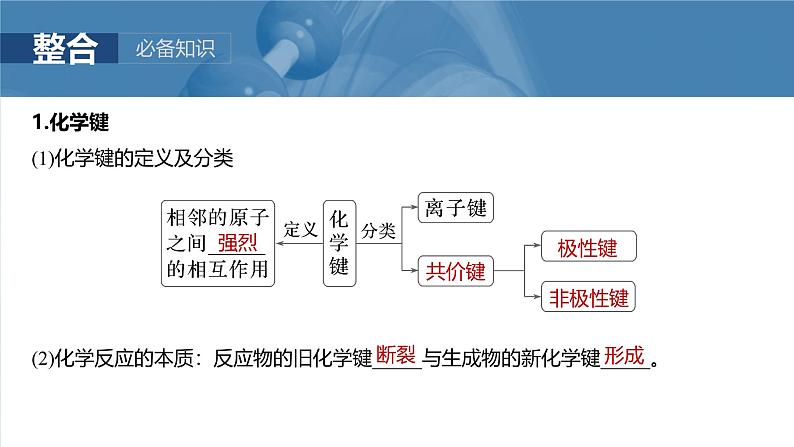
1.化学键(1)化学键的定义及分类
(2)化学反应的本质:反应物的旧化学键_____与生成物的新化学键_____。
2.离子键和共价键的比较
3.离子化合物和共价化合物
4.电子式(1)概念:在元素符号周围用“·”或“×”来表示原子的___________的式子。(2)常见物质电子式的书写①原子:Na_____,Cl_____。②简单离子:Na+____,F-_________。③复杂离子: __________,OH-___________。
④离子化合物:MgCl2____________________,Na2O________________,Na2O2__________________。
⑤非金属单质及共价化合物:N2 _________ ,H2O__________,H2O2 ___________ 。(3)用电子式表示化合物的形成过程①离子化合物如NaCl: _____________________ 。②共价化合物如HCl: _____________________ 。
H×+ ―→
一、化学键与离子化合物、共价化合物的判断1.下列各组物质中化学键的类型和化合物的类型都相同的是A.CaCl2 Na2O HIB.H2O NaNO3 NH3C.MgCl2 NaOH NH4ClD.H2SO4 H2S CO2
CaCl2、Na2O都是离子化合物,且都含有离子键,HI是共价化合物,只含有共价键,故A项错误;H2O、NH3都是共价化合物,都只含有共价键,NaNO3是离子化合物,含有离子键和共价键,故B项错误;MgCl2、NaOH、NH4Cl都是离子化合物,但MgCl2中只含有离子键,NaOH、NH4Cl中除了离子键还含有共价键,故C项错误;H2SO4、H2S、CO2都是共价化合物,都只含有共价键,故D项正确。
2.有以下8种物质:①Ne ②HCl ③P4 ④H2O2 ⑤Na2S ⑥NaOH ⑦Na2O2 ⑧NH4Cl请用上述物质的序号填空:(1)不存在化学键的是____。(2)只存在极性共价键的是____。(3)只存在非极性共价键的是____。(4)既存在非极性共价键又存在极性共价键的是____。(5)只存在离子键的是____。(6)既存在离子键又存在共价键的是________。(7)属于离子化合物的是__________。
化学键与物质类别之间的关系
二、电子式的规范书写3.判断下列电子式书写是否正确,并将错误的改正过来。(1)氮气, ______________;氨气, _____________。(2)氯化钠, __________________;HF, ____________。
(3)过氧化氢, ______;次氯酸, ________________。(4)CaBr2, _______;CaC2, __________________________。
4.写出下列微粒的电子式。(1)—OH________,H3O+__________。(2)H2S___________,N2H4_____________。
(3)NaH______________,NaBH4_______________。
三、“10e-”“18e-”微粒的应用5.A+、B+、C-、D、E五种粒子(分子或离子)中,每个粒子均有10个电子,已知:①A++C-===D+E↑;②B++C-===2D。回答下列问题:(1)C-的电子式是_____________。(2)分别写出A+和D反应、B+和E反应的离子方程式:_________________________、_________________________。
(3)除D、E外,请再写出两种含10个电子的分子的分子式:______________________。(4)除A+、B+外,请再写出两种含10个电子的阳离子:________________________________。
CH4、HF(答案合理即可)
Na+、Mg2+、Al3+(答任意两
(1)“10电子”微粒:
(2)“18电子”微粒:
1.共价键的本质及特征共价键是原子间通过______________所形成的相互作用,其特征是具有_________和_______。
2.共价键的分类(1)根据成键原子轨道重叠方式可分为σ键和π键。
(2)σ键与π键的比较
(3)根据共价键的极性与否可分为 (简称极性键)和 (简称非极性键)。极性键产生的原因是成键的两个原子电负性不同,共用电子对向电负性大的元素偏移,造成共价键正、负电中心不重合。非极性键成键的元素相同。(4)根据成键原子形成共用电子对的数目可分为共价单键、共价双键和共价三键。
(2)键参数对分子性质的影响①键能越____,键长越____,分子越稳定。②
1.共价键的成键原子只能是非金属原子( )2.在任何情况下,都是σ键比π键强度大( )3.σ键能单独形成,而π键不能单独形成( )4.σ键可以绕键轴旋转,π键不能绕键轴旋转( )5.碳碳三键和碳碳双键的键能分别是碳碳单键键能的3倍和2倍( )6.分子的稳定性与分子间作用力的大小无关( )
一、共价键的类型及数目判断1.下列关于σ键和π键的理解不正确的是A.含有π键的分子在进行化学反应时,分子中的π键比σ键活泼B.在有些分子中,共价键可能只含有π键而没有σ键C.有些原子在与其他原子形成分子时只能形成σ键,不能形成π键D.当原子形成分子时,首先形成σ键,可能形成π键
同一分子中的π键不如σ键牢固,反应时比较容易断裂,A项正确;在共价单键中只含有σ键,而含有π键的分子中一定含有σ键,B项错误、D项正确;氢原子、氯原子等跟其他原子形成分子时只能形成σ键,C项正确。
2.含碳元素的物质是化学世界中最庞大的家族,请填写下列空格。(1)已知CN-与N2结构相似,推算HCN分子中σ键与π键数目之比为_____。(2)利用CO可以合成化工原料COCl2,COCl2分子的结构式为 ,每个COCl2分子内含有__个σ键,___个π键。
二、键能、键长与物质稳定性3.Ge与C是同族元素,C原子之间可以形成双键、三键,但Ge原子之间难以形成双键或三键。从原子结构角度分析,原因是________________________________________________________________________________________________________________。
Ge原子半径大,原子间形成的σ单键较长,p-p轨道肩并肩重叠程度很小或几乎不能重叠,难以形成π键,不易形成双键或三键
4.硅是重要的半导体材料,构成了现代电子工业的基础。碳和硅的有关化学键键能如表所示,简要分析和解释下列有关事实:
(1)硅与碳同族,也有系列氢化物,但硅烷在种类和数量上都远不如烷烃多,原因是_______________________________________________________________________________________________________。
C—C和C—H的键能较大,所形成的烷烃稳定。而硅烷中Si—Si和Si—H的键能较小,易断裂,导致长链硅烷难以生成
(2)SiH4的稳定性小于CH4,更易生成氧化物,原因是_________________________________________________________________________________________________________________。
C—H的键能大于C—O,C—H比C—O稳定。而Si—H的键能却小于Si—O,所以Si—H不稳定而倾向于形成稳定性更强的Si—O
1.正误判断,正确的打“√”,错误的打“×”。(1)钠与N、O、Cl分别形成的化合物中只含有离子键(2018·全国卷Ⅱ,10B改编)( )(2)1 ml乙烷和1 ml乙烯中,化学键数相同(2018·全国卷Ⅲ,8D)( )(3)Na2O2与ClO2均含有非极性共价键(2018·全国卷Ⅲ,13C改编)( )(4)氢元素与其他元素可形成共价化合物或离子化合物(2017·天津,5B)( )(5)甲基的电子式: (2020·浙江7月选考,5D)( )
(6)B3N3H6(无机苯)的结构与苯类似,也有大π键。B3N3H6的熔点主要取决于所含化学键的键能 (2020·山东,7A)( )(7)键能C—C>Si—Si、C—H>Si—H,因此C2H6稳定性大于Si2H6(2020·山东,4A)( )
2. (2022·北京,9)由键能数据大小,不能解释下列事实的是
A.稳定性:CH4>SiH4B.键长:C==O7。
(5)元素D的单质在一定条件下能与A单质化合生成一种化合物DA,灼烧该化合物时,火焰呈____色, DA能与水反应放出氢气,若将1 ml DA和1 ml E单质混合加入足量的水,充分反应后生成的气体在标准状况下的体积是____L。
D为Na,A为H,化合物DA是NaH,含钠元素的化合物灼烧时,火焰呈黄色,NaH和水反应的化学方程式为NaH+H2O===NaOH+H2↑,则该反应中消耗1 ml NaH生成1 ml NaOH和1 ml H2,若将1 ml NaH和1 ml Al混合加入足量的水,另外还发生反应:2Al+2NaOH+2H2O===2NaAlO2+3H2↑,则又生成1.5 ml H2,故充分反应后总共生成2.5 ml H2,生成的气体在标准状况下的体积是22.4 L·ml-1×2.5 ml=56 L。
13.(1)1 ml化合物A( )中含有的σ键数目为______。(2)1 ml碳酸二乙酯(DEC, )中含有σ键的数目为______。(3)1 ml [Ni(NH3)6]SO4中σ键的数目为______。
14.下表是元素周期表的一部分,针对表中的①~⑨九种元素,填写下列空白:
(1)在最高价氧化物对应的水化物中,酸性最强的化合物的化学式是_______,碱性最强的化合物的电子式是______________。
同周期元素从左到右,金属性逐渐减弱,非金属性逐渐增强,同主族元素从上到下,金属性逐渐增强,非金属性逐渐减弱,则Cl元素的非金属性最强,K元素的金属性最强,非金属性越强,其最高价氧化物对应水化物的酸性越强,金属性越强,其最高价氧化物对应水化物的碱性越强,则在最高价氧化物对应的水化物中,酸性最强的化合物的化学式是HClO4,碱性最强的化合物为KOH,其电子式是 。
(2)用电子式表示元素④与⑥形成的化合物的过程:___________________________,该化合物属于______(填“共价”或“离子”)化合物。
Na与S形成化合物时,钠失去电子,硫得到电子,用电子式表示该过程为 ,钠离子与硫离子之间形成离子键,则Na2S属于离子化合物。
(3)①与⑦形成的化合物的电子式:___________。
C与Cl形成的化合物为CCl4,为共价化合物,其电子式为 。
(4)判断④⑤⑥原子半径的大小顺序:____________(用元素符号或化学式表示,下同),比较③和⑥的简单氢化物的稳定性:__________。
相关课件
这是一份2025年高考化学大一轮大单元三 第九章 第37讲 晶胞结构分析与计算(课件+讲义+练习),文件包含大单元三第九章第37讲晶胞结构分析与计算pptx、大单元三第九章第37讲晶胞结构分析与计算教师版docx、大单元三第九章第37讲晶胞结构分析与计算学生版docx、第九章第37练晶胞结构分析与计算同步练习docx等4份课件配套教学资源,其中PPT共60页, 欢迎下载使用。
这是一份2025年高考化学大一轮大单元三 第九章 第36讲 物质的聚集状态 常见晶体类型(课件+讲义+练习),文件包含大单元三第九章第36讲物质的聚集状态常见晶体类型pptx、大单元三第九章第36讲物质的聚集状态常见晶体类型教师版docx、大单元三第九章第36讲物质的聚集状态常见晶体类型学生版docx、第九章第36练物质的聚集状态常见晶体类型同步练习docx等4份课件配套教学资源,其中PPT共60页, 欢迎下载使用。
这是一份2025年高考化学大一轮大单元三 第八章 第35讲 分子的性质 配合物与超分子(课件+讲义+练习),文件包含大单元三第八章第35讲分子的性质配合物与超分子pptx、大单元三第八章第35讲分子的性质配合物与超分子教师版docx、大单元三第八章第35讲分子的性质配合物与超分子学生版docx、第八章第35练分子的性质配合物与超分子同步练习docx等4份课件配套教学资源,其中PPT共60页, 欢迎下载使用。









