















所属成套资源:2025年高考化学大一轮复习讲义【配套PPT+教师版+学生版+同步练习】
- 2025年高考化学大一轮大单元二 第五章 热点强化8 富集方法的应用-海水资源提取溴、碘(课件+讲义+练习) 课件 0 次下载
- 2025年高考化学大一轮大单元二 第六章 第二十八讲 常见气体的实验室制备、净化和收集(课件+讲义+练习) 课件 0 次下载
- 2025年高考化学大一轮大单元二 第四章 第十三讲 铁盐、亚铁盐 铁及其化合物的转化(课件+讲义+练习) 课件 0 次下载
- 2025年高考化学大一轮大单元二 第四章 第十讲 碱金属 钠及其氧化物(课件+讲义+练习) 课件 0 次下载
- 2025年高考化学大一轮大单元二 第四章 第十一讲 碳酸钠和碳酸氢钠 钠及其化合物的相互转化(课件+讲义+练习) 课件 1 次下载
2025年高考化学大一轮大单元二 第六章 第三十讲 陌生过渡金属及其化合物的制备流程分析(课件+讲义+练习)
展开
这是一份2025年高考化学大一轮大单元二 第六章 第三十讲 陌生过渡金属及其化合物的制备流程分析(课件+讲义+练习),文件包含大单元二第六章第30讲陌生过渡金属及其化合物的制备流程分析pptx、大单元二第六章第30讲陌生过渡金属及其化合物的制备流程分析教师版docx、大单元二第六章第30讲陌生过渡金属及其化合物的制备流程分析学生版docx、第六章第30练陌生过渡金属及其化合物的制备流程分析同步练习docx等4份课件配套教学资源,其中PPT共55页, 欢迎下载使用。
1、全面、系统复习回顾基本知识。了解知识规律的来龙去脉,透彻理解概念的内涵外延,让学生经历教材由薄变厚的过程。要正确理解基础,不是会做几个简单题就叫基础扎实。对于一轮复习,基础就是像盖房子一样,需要着力做好两件大事:一是夯实地基,二是打好框架。2、扎实训练学科基本技能、理解感悟学科基本方法。一轮复习,要以教材为本,全面细致的回顾课本知识,让学生树立“教材是最好的复习资料”的观点,先引导学生对教材中所涉及的每个知识点进行重新梳理,对教材中的概念、定理、定律进一步强化理解。3、培养学生积极的学习态度、良好的复习习惯和运用科学思维方法、分析解决问题的能力。落实解题的三重境界:一是“解”,解决问题。二是“思”,总结解题经验和方法。三是“归”,回归到高考能力要求上去。解题上强化学生落实三个字:慢(审题),快(书写),全(要点全面,答题步骤规范)。 4、有计划、有步骤、有措施地指导学生补齐短板。高三复习要突出重点,切忌主次不分,无的放矢。要在“精讲”上下足功夫。抓住学情,讲难点、重点、易混点、薄弱点;讲思路、技巧、规范;讲到关键处,讲到点子上,讲到学生心里去。
陌生过渡金属及其化合物的制备流程分析
2025年高考化学大一轮复习
1.了解常考过渡金属及其重要化合物。2.能依据信息及化合价解答陌生过渡金属及其化合物制备流程中的有关问题。
1.过渡金属——多变价(1)高价态金属通常形成含氧酸根离子的盐,具有较强的氧化性,如KMnO4、K2Cr2O7、K2FeO4等,均能将浓盐酸氧化成Cl2。(2)在空气中灼烧一些不稳定的低价金属的化合物,在分解的同时可能被氧化:
(3)低价金属的氢氧化物,为难溶性的弱碱,且易分解成氧化物,如Fe(OH)2、Mn(OH)2、Cr(OH)3。(4)低价硫化物,通常为有色难溶物,如HgS(黑或红)、FeS(黑)、Cu2S(黑)、FeS2(金黄)。工业生产中,常通过转化价态、调节pH将过渡金属生成氢氧化物沉淀或生成难溶硫化物分离除去。
2.过渡金属易形成配合物(1)金属离子常易水解,其水合离子通常显色,如Cu2+(aq,蓝)、Fe2+(aq,浅绿)、Fe3+(aq,黄)、Cr3+(aq,绿)。(2)容易形成配合物的中心离子,如[Cu(NH3)4]2+、[Ag(NH3)2]+、[Fe(SCN)6]3-、[Cr(NH3)3(H2O)2Cl]2+。(3)向一些盐溶液中滴加氨水,先生成难溶性碱,继续滴加,生成含氨配合物,如
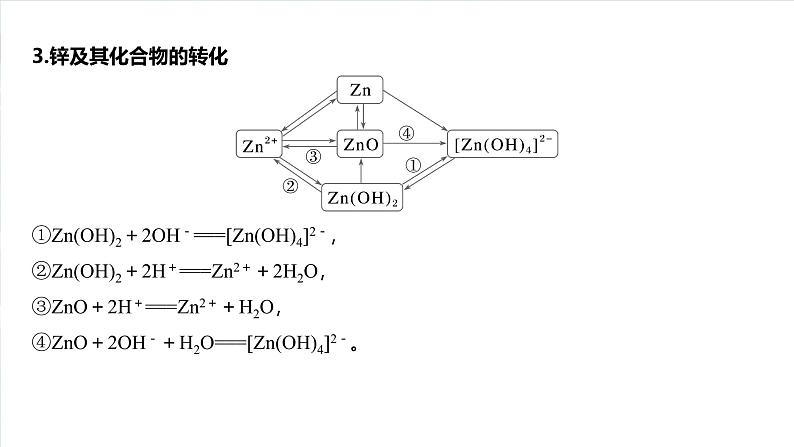
3.锌及其化合物的转化①Zn(OH)2+2OH-===[Zn(OH)4]2-,②Zn(OH)2+2H+===Zn2++2H2O,③ZnO+2H+===Zn2++H2O,④ZnO+2OH-+H2O===[Zn(OH)4]2-。
4.铬的重要化合物(1)Cr2O3和Cr(OH)3显两性,其转化关系如下:Cr3+ Cr(OH)3 [Cr(OH)4]-。反应的离子方程式:①Cr3++3OH-===Cr(OH)3↓;②Cr(OH)3+OH-===[Cr(OH)4]-,Cr3++4OH-===[Cr(OH)4]-;③[Cr(OH)4]-+H+===Cr(OH)3↓+H2O;④Cr(OH)3+3H+===Cr3++3H2O,[Cr(OH)4]-+4H+===Cr3++4H2O。
5.钒的重要化合物(1)五氧化二钒既能溶于强碱,又能溶于强酸,如:V2O5+6NaOH===2Na3VO4+3H2O;V2O5+6HCl===2VOCl2+Cl2↑+3H2O。
6.钴的配合物(1)C(Ⅱ)与H2O、Cl-配合的平衡转化[C(H2O)6]2+ [CCl4]2- 粉红色 蓝色(2)C(Ⅱ)的配合物具有较强的还原性C2++6NH3―→ [C(NH3)6]2+ [C(NH3)6]3+
1.(2023·湖南衡阳校联考三模)锌是一种浅灰色的过渡金属。在现代工业中,是电池制造中不可替代且相当重要的金属,以菱锌矿(主要成分为ZnCO3、ZnO,含有少量SiO2和Na2SiO3)制备锌单质的流程如图所示:下列说法错误的是A. 的空间结构为正四面体形B.滤渣的主要成分为SiO2和H2SiO3C.“沉淀”步骤中,消耗CO2的物质的量与消耗Na2[Zn(OH)4]的物质的量之比为1∶1D.“热还原”过程发生了置换反应
菱锌矿(主要成分为ZnCO3、ZnO,含有少量SiO2和Na2SiO3)与硫酸反应生成硫酸锌、硅酸、硫酸钠,二氧化硅不与硫酸反应,过滤,向滤液中加入过量氢氧化钠溶液,向溶液中通入二氧化碳得到氢氧化锌,过滤,将氢氧化锌煅烧得到氧化锌,再用过量焦炭还原得到锌。“沉淀”时CO2会先与未反应完的NaOH反应,因此消耗的二氧化碳量比Na2[Zn(OH)4]多,故C错误;ZnO+C Zn+CO↑是置换反应,故D正确。
2.(2024·长沙模拟)以黄铁矿(主要成分是FeS2,含少量SiO2)和软锰矿(主要成分是MnO2,含少量Fe2O3、Al2O3)为原料制备MnSO4·H2O的工艺流程如图。下列说法正确的是A.酸浸和沉锰操作均应在较高温度下进行B.滤渣1的成分中含有S和SiO2C.调pH的目的只为除去溶液中的Fe3+D.沉锰操作中主要反应的离子方程式是 +Mn2+===MnCO3↓ +CO2 ↑ +H2O
酸浸时采用高温可以使反应速率加快,而沉锰时如果温度过高,氨水和NH4HCO3受热分解,MnCO3溶解度增大,导致沉锰效率降低,因此应该在低温下进行沉锰,A错误;SiO2、生成的S均不溶于稀硫酸,因此用稀硫酸溶解后的滤渣1的成分中含有S和SiO2,B正确;调pH的目的是使溶液中的Fe3+、Al3+转化为Fe(OH)3、Al(OH)3沉淀,从而达到除去Fe3+、Al3+的目的,C错误;
碘离子的还原性强于亚铁离子且加入足量酸性(VO2)2SO4溶液,碘离子应参与氧化还原反应,故B错误;
4.[2019·全国卷Ⅲ,26(1)(2)(3)(4)(5)]高纯硫酸锰作为合成镍钴锰三元正极材料的原料,工业上可由天然二氧化锰粉与硫化锰矿(还含Fe、Al、Mg、Zn、Ni、Si等元素)制备,工艺如图所示。回答下列问题:
相关金属离子[c0(Mn+)=0.1 ml·L-1]形成氢氧化物沉淀的pH范围如下:
(1)“滤渣1”含有S和_____________________;写出“溶浸”中二氧化锰与硫化锰反应的化学方程式:__________________________________________。
SiO2(或不溶性硅酸盐)
MnO2+MnS+2H2SO4===2MnSO4+S+2H2O
硫化锰矿中硅元素主要以SiO2或不溶性硅酸盐形式存在,则“滤渣1”的主要成分为S和SiO2(或不溶性硅酸盐)。结合“滤渣1”中含S,可知“溶浸”时MnO2与MnS在酸性条件下发生氧化还原反应生成MnSO4和S,根据化合价升降法可配平该反应。
(2)“氧化”中添加适量的MnO2的作用是___________________。(3)“调pH”除铁和铝,溶液的pH范围应调节为____~6之间。(4)“除杂1”的目的是除去Zn2+和Ni2+,“滤渣3”的主要成分是_________。(5)“除杂2”的目的是生成MgF2沉淀除去Mg2+。若溶液酸度过高,Mg2+沉淀不完全,原因是_______________________________________________________________________。
Fe2+氧化为Fe3+
F-与H+结合生成弱电解HF,导致MgF2(s) Mg2+(aq)+2F-(aq)平衡向右移动
5.(2023·江西新余统考二模)铬(Cr)广泛应用于冶金、化工、航天等领域。工业上以铬铁矿(主要成分为FeCr2O4,含有少量Al2O3)为原料制备金属铬的工艺流程如图所示:回答下列问题:(1)为提高焙烧效率,可以采取的措施为____________________________________。(2)亚铬酸亚铁(FeCr2O4)中Cr的化合价为____,“焙烧”中FeCr2O4反应的化学方程式为___________________________________________________。
将矿石粉碎或增大空气的量等(任选一条)
(3)“酸化”中反应的离子方程式为_____________________________,已知:“酸化”后溶液中c( )=1.6×10-3ml·L-1,c( )=2×10-8ml·L-1。则该温度下该反应的平衡常数为_______。
(4)“沉铝”需控制pH=6~10的原因为________________________________________________________________________________________________________________________________________________________。(5)以铬酸钾(K2CrO4)为原料,用电化学法制备重铬酸钾的实验装置如图。测定阳极液中K和Cr的含量,若K与Cr的物质的量之比( )为a,则此时铬酸钾的转化率为____。
pH高于10时, 不能完全转化为氢氧化铝,pH低于6时,氢氧化铝会继续溶解转化为铝离子,故需控制pH在6~10的范围,让 中铝以氢氧化铝形式存在而过滤除去
6.(2023·广西南宁三中校考二模)[C(NH3)6]Cl3(三氯化六氨合钴)是合成其他含钴配合物的重要原料,实验室中可由金属钴及其他原料制备[C(NH3)6]Cl3。(一)CCl2的制备CCl2易潮解,可用金属钴与氯气反应制备CCl2。实验中利用下列装置进行制备。
(1)装置A中发生反应的离子方程式为____________________________________________。
+10Cl-+16H+===2Mn2++5Cl2↑+8H2O
(2)按图中A→E的顺序组合装置制备CCl2,E为盛装有_______(填试剂名称)的干燥管,其作用为___________________________________________________________。
吸收未反应完的Cl2,防止空气中的水蒸气进入D装置使CCl2潮解
(3)该实验需配制12 ml·L-1的浓盐酸250 mL,需要用到的玻璃仪器是烧杯、量筒、玻璃棒、_____________和_________,若配制过程中未恢复室温即转移液体进行后续操作,则所配溶液实际浓度______(填“大于”或“小于”)12 ml·L-1。
(二)[C(NH3)6]Cl3的制备步骤如下:Ⅰ.在100 mL锥形瓶内加入4.5 g研细的CCl2、3 g NH4Cl和5 mL水,加热溶解后加入0.3 g活性炭作催化剂。Ⅱ.冷却后,加入浓氨水混合均匀。控制温度在10 ℃以下并缓慢加入10 mL H2O2溶液。Ⅲ.在60 ℃下反应一段时间后,经过一系列操作后,过滤、洗涤、干燥得到[C(NH3)6]Cl3晶体。已知:不同温度下[C(NH3)6]Cl3在水中的溶解度如图所示。
回答下列问题:(4)步骤Ⅱ中在加入H2O2溶液时,控制温度在10 ℃以下的目的是_________________________________。(5)制备[C(NH3)6]Cl3的总反应的化学方程式为____________________________________________________________。(6)Ⅲ中的“一系列操作”包括__________、__________。
防止温度过高使H2O2和NH3·H2O分解
2CCl2+2NH4Cl
2[C(NH3)6]Cl3+12H2O
由[C(NH3 )6 ]Cl3在水中的溶解度曲线可知,[C(NH3)6]Cl3的溶解度随温度变化较大,降温时[C(NH3)6]Cl3会结晶析出,所以在60 ℃下反应一段时间后,应该趁热过滤除去活性炭,再冷却结晶使[C( NH3)6 ]Cl3晶体析出,经过过滤、洗涤、干燥等操作得到[C(NH3)6]Cl3晶体。
1.以含镍废料(主要成分为NiO,含少量FeO、Fe2O3、CO、BaO和SiO2)为原料制备NixOy和碳酸亚钴(CCO3)的工艺流程如图:下列说法不正确的是A.“滤渣Ⅰ”的主要成分是SiO2、BaSO4B.“氧化”时的离子反应为6Fe2++6H+ + ===6Fe3++Cl-+3H2OC.“调pH”过程中形成黄钠铁矾渣,Na2CO3必须过量D.“沉钴”过程发生的反应为C2++ ===CCO3↓+CO2↑+H2O
废料中加入硫酸,NiO、FeO、Fe2O3、CO、BaO均能与硫酸反应,生成的NiSO4、FeSO4、Fe2(SO4)3、CSO4进入溶液,SiO2和硫酸钡为滤渣,A正确;“调pH”过程中形成黄钠铁矾渣,Na2CO3不能过量,防止C2+、Ni2+形成沉淀而损失,C错误。
2.某铬贫矿主要成分为Fe(CrO2)2,还含有Fe2O3、MgO、Al2O3,采用次氯酸钠法处理矿石并制备CrO3的工艺流程如图,已知“氧化浸出”时铁以最高价氧化物存在。下列说法错误的是
A.“氧化浸出”时煮沸的目的是加快氧化 浸出速率B.滤渣的主要成分是MgO、Fe2O3C.化合物Ⅰ为NaOH,化合物Ⅱ为NaHCO3D.实验室进行“混合”时,将Na2Cr2O7溶 液缓慢倒入浓硫酸中,边倒边搅拌
温度升高,反应速率变快,A正确;Al2O3与NaOH溶液反应,则“滤渣”的主要成分为MgO、Fe2O3,B正确;由于电解时产生氢气和氯气,故会产生NaOH,“沉铝”时通入过量的CO2,产生NaHCO3,C正确;实验室进行“混合”时,将浓硫酸缓慢倒入Na2Cr2O7溶液中,边倒边搅拌,D错误。
3.(2023·山东省实验中学一模)以红土镍镉矿(NiS、CdO,含SiO2、CuO、PbO、Fe2O3等杂质)为原料回收部分金属单质,其工艺流程如图所示:已知:电极电位是表示某种离子或原子获得电子而被还原的趋势。在25 ℃下,部分电对的电极电位如表:
下列说法错误的是A.“浆化”的目的是增大接触面积,加快酸 浸反应速率,提高某些金属元素浸取率B.“物质A”可以是NiCO3,“调pH”后, 所得滤渣Ⅱ为Fe(OH)3C.“金属A”是Pb和Cu混合物,“金属B”是CdD.该工艺流程中可以循环利用的物质有CO、H2SO4、Ni等
由电极电位表可知金属活动性顺序为Fe>Cd>Ni>Pb>Cu。镍镉矿浆化后,在空气中加入稀硫酸酸浸,硫化镍和金属氧化物溶于稀硫酸得到硫酸盐,二氧化硅不与稀硫酸反应,过滤得到含有二氧化硅、硫酸铅的滤渣Ⅰ和滤液;向滤液中加入碳酸镍或氧化镍调节溶液pH,将溶液中铁离子转化为氢氧化铁沉淀,过滤得到含有氢氧化铁的滤渣Ⅱ和滤液;由金属活动性顺序可知,向滤液中只能加入镍,将溶液中铜离子转化为铜,过滤得到含有铜、镍的金属A和硫酸镍、硫酸镉的滤液;滤液经电解、过滤得到含有镉和镍的固体和稀硫酸;固体通入一氧化碳气化分离得到Ni(CO)4和镉;Ni(CO)4受热分解生成一氧化碳和镍,则该工艺流程中可以循环利用的物质为一氧化碳、硫酸和镍等。
4.实验室模拟工业处理含铬废水,操作及现象如图甲所示,反应过程中铬元素的化合价变化如图乙。已知:深蓝色溶液中生成了CrO5。下列说法不正确的是
C.30~80 s过程中,Cr元素被氧化,可能是溶解的氧气 和剩余的H2O2所致D.0~80 s时,溶液中含铬微粒依次发生氧化反应、还原反应和氧化反应
0~80 s时,溶液中含铬微粒转化过程中Cr元素化合价变化为+6→+6、+6→+3、+3→+6,依次发生非氧化还原反应、还原反应和氧化反应,D不正确。
5.氧钒(Ⅳ)碱式碳酸铵晶体的化学式为(NH4)5[(VO)6(CO3)4(OH)9]·10H2O,实验室以V2O5为原料制备该晶体的流程如图所示:(1)N2H4的电子式是_____________,若“还原”过程中其他产物均绿色环保,写出该过程中发生反应的化学方程式:___________________________________________。
(2)“转化”可在如图所示装置中进行(已知VO2+能被O2氧化)。①仪器M的名称是__________。使装置A中制气反应停止的操作是__________。②在装置C中VOCl2转化为产品,实验操作的顺序为打开活塞a→___→___→___(填序号)。Ⅰ.取下P(如图所示),在锥形瓶口塞上无孔橡胶塞Ⅱ.将锥形瓶置于干燥器中,静置后抽滤Ⅲ.打开旋塞b,加入VOCl2溶液,持续搅拌一段时间,使反应完全
VO2+能被O2氧化,先打开旋塞a,通入一段时间CO2排尽装置中的空气,然后再打开旋塞b,加入VOCl2溶液,持续搅拌一段时间,使反应完全。为防止空气进入,反应结束后取下P,在锥形瓶口塞上无孔橡胶塞,然后在干燥器中静置后抽滤。
(3)“转化”后得到紫红色晶体,抽滤,并用饱和NH4HCO3溶液洗涤3次,用无水乙醇洗涤2次,再用无水乙醚洗涤2次,抽干。用饱和NH4HCO3溶液洗涤除去的阴离子主要是____(填离子符号),用无水乙醚洗涤的目的是___________________。
用饱和NH4HCO3溶液洗涤可除去产物表面的Cl-,用无水乙醇洗涤除去产物表面的水,用无水乙醚(更易挥发)洗涤除去产物表面残留的乙醇。
(4)称取m g产品于锥形瓶中,先将产品中的钒元素转化为 ,消除其他干扰,再用c ml·L-1(NH4)2Fe(SO4)2标准溶液滴定至终点,消耗标准溶液的体积为V mL(已知滴定反应为 +Fe2++2H+===VO2++Fe3++H2O),则产品中钒元素的质量分数为__________________(列出计算式即可)。
6.(2023·银川一中三模)HDS催化剂广泛用于石油炼制和化学工业生产中,通常利用加碱焙烧-水浸取法从HDS废催化剂(主要成分为MS、NiS、V2O5、Al2O3)中提取贵重金属钒和钼,其工艺流程如图所示。已知:Ⅰ.MO3、V2O5、Al2O3均可与纯碱反应生成对应的钠盐,而NiO不行。Ⅱ.高温下,NH4VO3易分解产生N2和一种含氮元素的气体。
回答下列问题:(1)“浸渣”的成分为______(填化学式);“滤液2”中的成分除了Na2MO4外,还含有________________(填化学式)。
硫化物焙烧时生成氧化物和二氧化硫,由于NiO不能与碳酸钠反应,故“水浸”时以“浸渣”的形式沉淀出来,而MO3、V2O5、Al2O3与纯碱反应生成Na2MO4、NaVO3和NaAlO2,通入过量CO2生成沉淀Al(OH)3和NaHCO3,故“滤液2”中的成分除了Na2MO4外,还含有NaVO3、NaHCO3。
NaVO3、NaHCO3
(2)请写出“焙烧”过程中MS及Al2O3分别与纯碱反应的化学方程式:___________________________________________________,_________________________________。
2MS+2Na2CO3
(3)“沉钒”时提钒率随初始钒的浓度及氯化铵的加入量的关系如图所示,则选择的初始钒的浓度和NH4Cl的加入量分别为_________、_________。
(4)“沉钒”时生成NH4VO3沉淀,则“煅烧”后生成氧化产物和还原产物的物质的量之比为_______。
由信息和流程及氧化还原反应原理可知,NH4VO3沉淀煅烧时分解产生V2O3、N2和NH3,故反应的化学方程式为6NH4VO3 3V2O3+2N2↑+2NH3↑+9H2O,氧化产物为N2,还原产物为V2O3,故比值为2∶3。
7.(2023·哈尔滨三中校考模拟)用锌精矿(ZnS)和软锰矿(MnO2)两种矿料(含少量杂质Fe、Cu、Pb等元素的化合物及SiO2)生产硫酸锌和硫酸锰的流程如右:已知:ZnSO4的溶解度如图所示:
回答下列问题:(1)基态S原子占据最高能级的原子轨道形状为_______。
(2)“滤渣1”主要成分为____________和硫;写出“酸浸”过程中MnO2和ZnS反应的化学方程式:_______________________________________________。
ZnS+MnO2+2H2SO4===ZnSO4+MnSO4+S↓+2H2O
(3)“除铁”的萃取剂1为磷酸二(2-乙基己基)酯(用HA表示),萃取后含铁的物质为[Fe(HA)2(H2O)2]ASO4,该物质中Fe3+的配位数为__。
(4)BaS为可溶性钡盐。向“水相1”中加入适量BaS,发生主要反应的离子方程式为______________________________________。(5)从“反萃取液”中获得ZnSO4·H2O晶体的操作为控制温度在_____K以上,蒸发至有大量固体析出、__________、洗涤、干燥。
(6)ZnSO4·H2O产品的纯度可用配位滴定法测定。下列关于滴定分析正确的是______(填字母)。A.滴定前,锥形瓶和滴定管均须用标准溶液 润洗B.将标准溶液装入滴定管时,应借助漏斗转移C.滴定终点时,读取标准溶液体积时俯视滴 定管液面,则测得的体积比实际消耗的小D.滴定前滴定管尖嘴内有气泡,滴定后尖嘴 内无气泡,则测得的体积比实际消耗的大
利用锌精矿(ZnS)和软锰矿(MnO2)两种矿料(含少量杂质Fe、Cu、Pb等元素的化合物及SiO2)生产硫酸锌和硫酸锰的流程中,加硫酸酸浸,锌、铁、铜、锰生成硫酸盐,硫酸铅为沉淀和二氧化硅一起进入滤渣1,萃取剂1溶解铁离子,加入BaS,除去铜离子和硫酸根离子,萃取剂2萃取硫酸锌,水相为硫酸锰,进一步得到MnSO4·H2O,有机相为硫酸锌,进一步反萃取得到ZnSO4·H2O。
相关课件
这是一份2025年高考化学大一轮大单元二 第六章 第二十八讲 常见气体的实验室制备、净化和收集(课件+讲义+练习),文件包含大单元二第六章第28讲常见气体的实验室制备净化和收集pptx、大单元二第六章第28讲常见气体的实验室制备净化和收集教师版docx、大单元二第六章第28讲常见气体的实验室制备净化和收集学生版docx、第六章第28练常见气体的实验室制备净化和收集同步练习docx等4份课件配套教学资源,其中PPT共60页, 欢迎下载使用。
这是一份2025年高考化学大一轮大单元三 第九章 第37讲 晶胞结构分析与计算(课件+讲义+练习),文件包含大单元三第九章第37讲晶胞结构分析与计算pptx、大单元三第九章第37讲晶胞结构分析与计算教师版docx、大单元三第九章第37讲晶胞结构分析与计算学生版docx、第九章第37练晶胞结构分析与计算同步练习docx等4份课件配套教学资源,其中PPT共60页, 欢迎下载使用。
这是一份高考化学一轮复习微专题6“微流程”——常见过渡金属及其化合物的转化课件,共18页。PPT课件主要包含了锌及其化合物,钛及其化合物,铬及其化合物,锰及其化合物等内容,欢迎下载使用。








