





所属成套资源:【核心素养目标】人教版 化学选择性必修一授课课件
化学选择性必修1第一节 反应热优秀课件ppt
展开
这是一份化学选择性必修1第一节 反应热优秀课件ppt,共23页。PPT课件主要包含了学习目标,素养目标,情境引入,反应热,测定方法,教学过程,思考交流,实验用品,仪器简易量热计,实验步骤等内容,欢迎下载使用。
1.能解释中和反应反应热的测定原理;能根据实验中测定并记录的数据计算反应热。2.会分析产生误差的原因,并不断完善和改进测定方法。
通过对中和反应热实验测定、原理分析,激发学习兴趣,培养从微观的角度理解化学反应、尊重科学、严谨求学、勤于思考的态度,树立透过现象看本质的唯物主义观点。
1.含义:在等温条件下,化学反应体系向环境释放或从环境吸收的热量,称为化学反应的热效应,简称反应热。
测定原理:用温度计测量反应前后体系的温度变化,根据有关物质的比热容等来计算反应热。
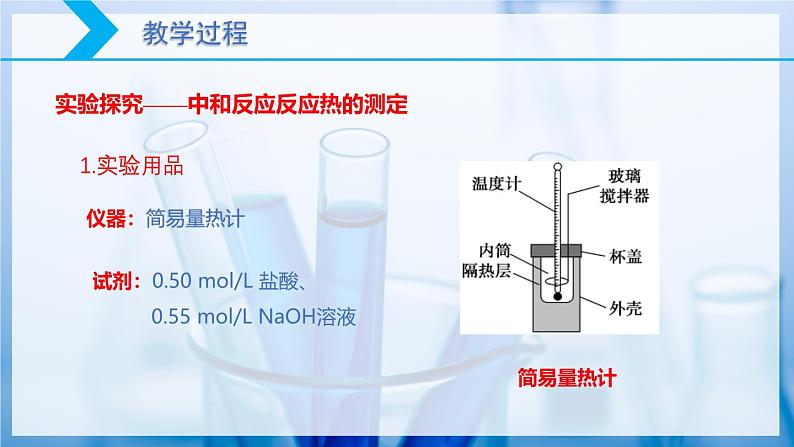
实验探究——中和反应反应热的测定
在测定中和反应的反应热时,实验原理是什么?应该测量哪些数据?如何根据测得的数据计算反应热?为了提高测定的准确度,应该采取哪些措施?
试剂:0.50 ml/L 盐酸、 0.55 ml/L NaOH溶液
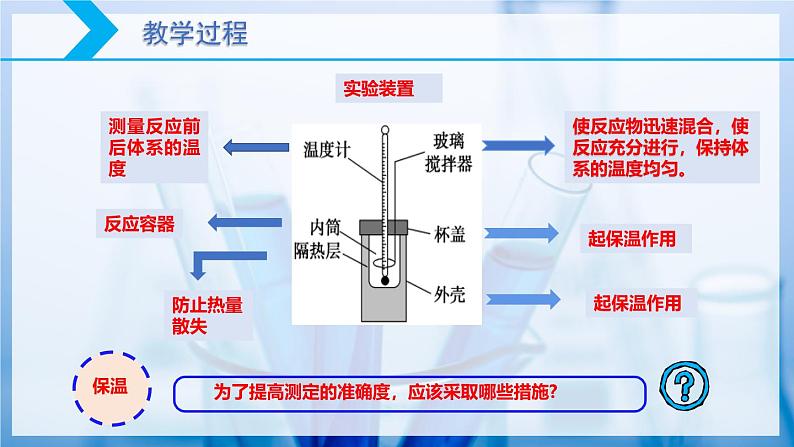
使反应物迅速混合,使反应充分进行,保持体系的温度均匀。
测量反应前后体系的温度
为了提高测定的准确度,应该采取哪些措施?
a. 用量筒量取50 mL 0.50ml/L盐酸,打开杯盖,倒入量热计的内筒,用温度计测量盐酸的温度。用水冲洗干净温度计上的酸。
(1)反应物温度的测量
b. 用另一个量筒量取50 mL 0.55ml/L NaOH溶液,用温度计测量其温度。
防止残留的酸与碱反应,导致测量的t2 数据不准。
NaOH稍过量,确保盐酸完全反应
打开杯盖,将量筒中的NaOH溶液迅速倒入量热计的内筒,立即盖上杯盖,插入温度计,用玻璃搅拌器匀速搅拌。密切关注温度变化,将最高温度记为反应后体系的温度(t2)。
(2)反应后体系温度的测量
需要记录哪些实验数据?如何处理这些数据?
①取盐酸温度和NaOH溶液温度的平均值记为反应前体系的温度(t1)。计算温度差(t2-t1),将数据填入下表。
②取三次测量所得温度差的平均值作为计算依据。
③根据温度差和比热容等计算反应热。
【计算反应热】(1)以三次测量所得数据的平均值为计算依据。(2)为了计算方便,盐酸和NaOH溶液的密度近似为1 g/cm3。忽略实验装置的比热容。(3)盐酸质量为m1、NaOH溶液质量为m2,反应后溶液比热容c=4.18 J/(g·°C),则实验中反应放出的热量为(m1+m2)·c·(t2-t1)=0.418(t2-t1)kJ,生成1 ml H2O时的反应热为:
H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·ml-1
大量实验测得,在25℃和101kPa下,强酸的稀溶液与强碱的稀溶液发生中和反应生成1ml水时,放出57.3kJ的热量。
(1)测量盐酸的温度后,要将温度计上的酸冲洗干净后,再测量NaOH溶液的温度,避免酸、碱在温度计的表面反应放热而影响测量结果。(2)实验中要用强酸、强碱的稀溶液(0.1~0.5 ml·L-1)。(3)测定中和热不能用弱酸或弱碱,因弱酸、弱碱电离时吸收热量而使测量数值偏低。(4)中和热的数值是57.3 kJ·ml-1,测定时与强酸、强碱的用量无关。(5)加过量碱液使酸完全反应,碱过量对中和热测定没有影响。(6)数据处理时,相差较大的数据可能是偶然误差引起的,应舍去。
(1)装置中的环形玻璃搅拌棒能否用金属(不与酸、碱反应)质环形搅拌棒代替?为什么?(2)能否用浓硫酸代替盐酸?对结果会产生什么影响?(3)能否用醋酸代替盐酸或用氨水代替KOH溶液?对结果会产生什么影响?
不能。原因是金属质环形搅拌棒易导热,造成实验过程中热量损失
不能。浓硫酸溶解于水时放热,所测ΔH 偏小,即ΔH-57.3 kJ·ml-1
以50mL0.50ml·L-1盐酸与50mL0.55ml·L-1NaOH反应为例
关于中和反应反应热的测定实验,下列说法正确的是( )A.为了使反应进行得更完全,可以使酸或碱适当过量B.为了使反应充分,可以向酸(碱)中分次加入碱(酸)C.中和反应反应热测定的实验结果与所用酸、碱的用量和种类均无关D.用铜丝代替玻璃搅拌棒,会使中和反应反应热的测定值偏大
【答案】A 【解析】为了使反应进行得更完全,可以使酸或碱适当过量,A正确;向酸(碱)中分次加入碱(酸),会导致热量损失较多,使实验误差过大,B不正确;中和反应反应热测定的实验结果与所用酸、碱的用量无关,但是与所用酸、碱的种类有关,C不正确;用铜丝代替玻璃搅拌棒,铜丝是热的良导体,造成热量散失过多,会使中和反应反应热的测定值偏小,D不正确。
下列有关中和热的说法正确的是( )A.中和热的热化学方程式:H+(l)+OH-(l)=H2O(l) ΔH=-57.3 kJ·ml-1B.准确测量中和热的实验过程中,至少需测定温度4次C.玻璃搅拌器材料若用铜代替,则测量出的中和热数值偏小D.若稀酸溶液中H+与稀碱溶液中OH-的物质的量相等,则所测中和热数值更准确
【答案】C 【解析】A项,H+和OH-不能用l符号,应该用aq,错误;B项,每次实验中需要测量NaOH溶液的温度,盐酸的温度,和反应后的温度,一般实验要重复操作,所以至少6次,错误;C项,铜容易导热,使热量损失,所以测量的中和热数值偏小,正确;D项,当酸和碱中的H+和OH-物质的量相等时,实验过程中稍有误差就不能确定产生水的量,一般都是有一种物质稍微过量,错误。
用一定浓度的NaOH溶液与稀盐酸进行中和反应反应热的测定实验时,测得生成1 ml液态水时的ΔH>-57.3 kJ·ml-1,产生这种偏差的原因不可能是( )A.实验用NaOH溶液的浓度过大B.实验时搅拌速度慢C.分2~3次把NaOH溶液倒入盛有稀盐酸的小烧杯中D.用量取完稀盐酸的量筒直接量取氢氧化钠溶液
【答案】A 【解析】NaOH溶液浓度过大,稀释过程释放热量,导致测得生成1 ml液态水时的ΔH-57.3 kJ·ml-1,B不符合题意;分2~3次把NaOH溶液倒入盛有稀盐酸的小烧杯中,导致热量散失较多,测得生成1 ml液态水时的ΔH>-57.3 kJ·ml-1,C不符合题意;用量取完稀盐酸的量筒直接量取氢氧化钠溶液,氢氧化钠部分被反应,导致测得生成1 ml液态水时的ΔH>-57.3 kJ·ml-1,D不符合题意。
假设盐酸和氢氧化钠溶液的密度都是1 g·cm-3,又知中和反应后生成的溶液的比热容c=4.18 J·g-1·℃-1。为了计算中和热,某学生实验记录数据如下:依据该学生的实验数据计算,该实验测得的中和热ΔH= (结果保留一位小数)。
ΔH=-51.8 kJ·ml-1
某实验小组用0.50 ml/L NaOH溶液和0.50 ml/L硫酸溶液进行中和反应反应热的测定。实验装置如图所示。
(1)仪器a的名称是 。 (2)取50 mL NaOH溶液和30 mL硫酸溶液进行实验,测得起止温度差的平均值为4.0 ℃。近似认为0.50 ml/L NaOH溶液和0.50 ml/L硫酸溶液的密度都是1 g/cm3,实验后所得溶液的比热容c=4.18 J/(g·℃)。 则计算得ΔH= (取小数点后一位)。 (3)上述实验结果与-57.3 kJ/ml有偏差,产生偏差的原因可能是 (填字母)。 a.实验装置保温、隔热效果差 b.用量筒量取NaOH溶液的体积时仰视刻度线读数 c.分多次把NaOH溶液倒入盛有硫酸溶液的小烧杯中 d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
【答案】(1)环形玻璃搅拌棒 (2) -53.5 kJ/ml (3)acd【解析】(1)仪器a的名称是环形玻璃搅拌棒。(2)ΔH=-
kJ/ml≈-53.5 kJ/ml。(3) -57.3 kJ/ml
相关课件
这是一份高中化学人教版 (2019)选择性必修1第一章 化学反应的热效应第二节 反应热的计算优质ppt课件,共19页。PPT课件主要包含了学习目标,素养目标,情境引入,教学过程,盖斯定律,能量守恒定律,能量守恒,图示表示,CO2g,△H1等内容,欢迎下载使用。
这是一份选择性必修1第一节 反应热完美版课件ppt,共23页。PPT课件主要包含了学习目标,素养目标,情境引入,教学过程,热化学方程式,物质变化,能量变化,书写注意事项,思维模型,课堂练习等内容,欢迎下载使用。
这是一份化学选择性必修1第一节 反应热优质课课件ppt,共19页。PPT课件主要包含了学习目标,素养目标,情境引入,回顾旧知,生活中常见的放热反应,生活中常见的吸热反应,放热反应,吸热反应,定性描述,定量描述等内容,欢迎下载使用。











