





所属成套资源:【核心素养目标】人教版 化学选择性必修一授课课件
人教版 (2019)选择性必修1第二节 水的电离和溶液的pH试讲课课件ppt
展开
这是一份人教版 (2019)选择性必修1第二节 水的电离和溶液的pH试讲课课件ppt,共18页。PPT课件主要包含了学习目标,素养目标,情境引入,教学过程,总结归纳,课堂练习,课堂小结等内容,欢迎下载使用。
1.认识水的电离,水是一种极弱的电解质。2.结合电离常数,了解水的离子积常数,其适用于任何水溶液。能够运用水的离子积常数进行有关计算及判断。
1.能从微观角度通过c(H+)和c(OH-)的相对大小判断溶液的酸碱性,同时从宏观角度通过pH计、pH试纸等判断溶液的酸碱性,培养“宏观辨识与微观探析”学科素养。2.能从电离平衡的角度,理解外界条件对水的电离平衡的影响,解释溶液酸碱性的变化,培养“变化观念与平衡思想” 3.理解水的离子积常数,形成认知模型,能够运用水的离子积常数进行有关计算及判断,培养“证据推理与模型认知”学科素养。
在水溶液中,酸、碱和盐全部或部分以离子形式存在,那么,其中的溶剂水是全部以分子形式存在,还是部分以离子形式存在呢? 怎样验证你的猜想?
【实验探究1】水的导电性实验
(1)灵敏电流表指针偏转;(2)灯泡不亮。
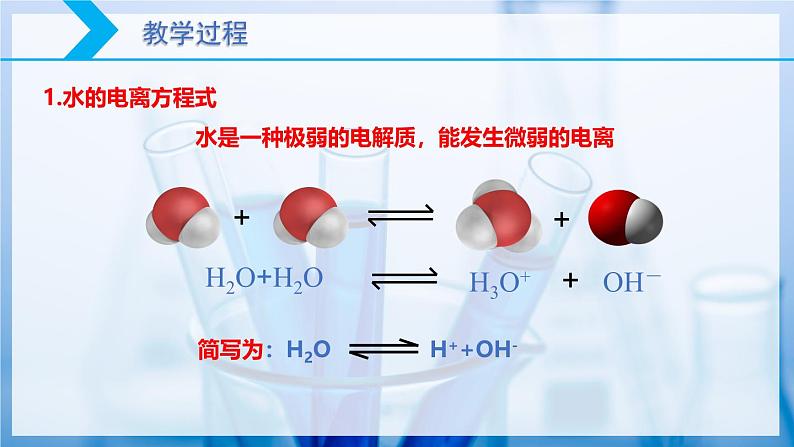
水是一种极弱的电解质,能发生微弱的电离
精确的电导性实验表明:纯水大部分以H2O分子的形式存在,但其中也存在着极少量的离子。
【实验探究2】利用手持技术测定水的电导率
当水的电离达到平衡时,电离平衡常数K 的表达式为:
Kw 水的离子积常数,简称水的离子积
纯水及稀溶液中c(H2O)为常数
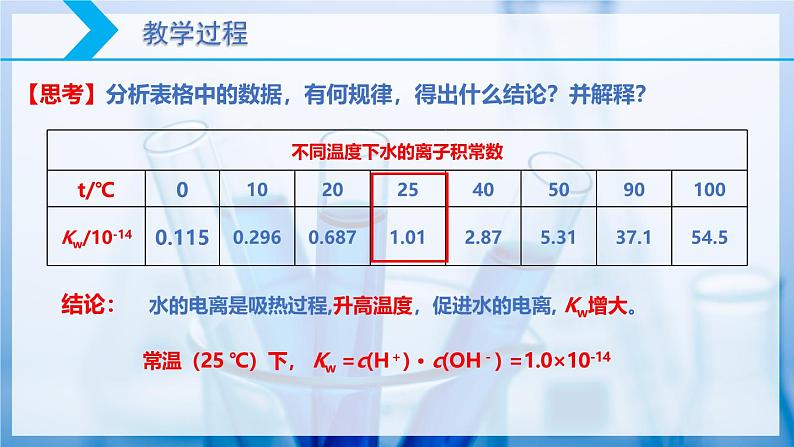
【思考】分析表格中的数据,有何规律,得出什么结论?并解释?
水的电离是吸热过程,升高温度,促进水的电离, Kw增大。
常温(25 ℃)下, Kw =c(H+) · c(OH-) =1.0×10-14
注意:(1)Kw是温度函数,只随温度的升高而增大, 与c(H+) 、c(OH-) 无关。(2)Kw适用于一定温度下任何稀的电解质溶液, 不管是哪种溶液均有: c(H+)H2O = c (OH―)H2O KW=c (H+)溶液·c (OH―)溶液(3)在任何水溶液中,均存在水的电离平衡,也就是任何水溶液中都是H+、OH-共存的。
根据水的电离平衡,思考下列情况中,c(H+)和c(OH-)的如何变化?
1、 温度升高,促进水的电离,Kw增大;
3、外加能与H+、OH- 反应的物质,会促进水的电离,Kw不变。
2、酸(H+)、碱(OH- )抑制水的电离,Kw不变;
(1)曲线上的任意点的Kw都相同,即c(H+)·c(OH-)相同,温度相同。 (2)曲线外的任意点与曲线上任意点的Kw不同,温度不同。 (3)实现曲线上点之间的转化需保持温度相同,改变酸碱性;实现曲线上点与曲线外点之间的转化一定改变温度。
典例1.25 ℃时,水溶液中c(H+)与c(OH-)的变化关系如图所示,下列判断错误的是( )
A.ac曲线上的任意一点都有c(H+)·c(OH-)=10-14 B.bd线段上任意一点对应的溶液都呈中性 C.d点对应溶液的温度高于25 ℃,pH<7 D.c点溶液不可能是盐溶液
【答案】D【解析】ac曲线上的任意一点,由于温度相同,所以水的离子积常数相同,根据b点可知,c(H+)·c(OH-)=10-14,A项正确;bd线段上任意一点都满足c(H+)=c(OH-),溶液一定呈中性,B项正确;d点时,c(H+)=c(OH-)=1×10-6 ml·L-1>1×10-7 ml·L-1,溶液的pH=6,水的电离为吸热反应,所以d点温度高于25 ℃,C项正确;在c点c(H+)=1×10-8 ml·L-1,c(OH-)=1×10-6 ml·L-1,溶液显碱性,而醋酸钠溶液显碱性,所以c点可能为醋酸钠溶液,D项错误。
【答案】C【解析】25 ℃时,纯水的pH=7,4 ℃时,纯水的电离程度减小,pH稍大于7,A错误;温度升高,水的电离平衡向右移动,c(H+)与c(OH-)均增大,B错误;水是一种极弱的电解质,电离程度很小,25 ℃时,纯水电离出的H+浓度只有1.0×10-7 ml·L-1,纯水中主要存在形态是水分子,C正确;水的离子积不受溶液酸碱性的影响,D错误
水是最宝贵的资源之一。下列表述正确的是( )A.4 ℃时,纯水的pH=7B.温度升高,纯水中的c(H+)增大,c(OH-)减小C.水的电离程度很小,纯水中主要存在形态是水分子D.向水中加入酸或碱,都可抑制水的电离,使水的离子积减小
【答案】A【解析】A项,二者c(H+)、c(OH-)相同,对水电离抑制程度相同;B、C项,没有告诉温度,Kw不知,无法求水电离出的cH2O(H+)、cH2O(OH-);D项,二者均抑制水电离。
在相同温度下,0.01 ml·L-1的NaOH溶液和0.01 ml·L-1的盐酸相比较,下列说法正确的是( )A.由水电离出的c(H+)相等B.由水电离出的c(H+)都是1.0×10-12 ml·L-1C.由水电离出的c(OH-)都是0.01 ml·L-1D.两者都促进了水的电离
相关课件
这是一份化学第二节 水的电离和溶液的pH评优课ppt课件,共26页。PPT课件主要包含了学习目标,素养目标,情境引入,教学过程,思维建模,pH的测定,pH的应用,课堂练习等内容,欢迎下载使用。
这是一份人教版 (2019)选择性必修1第二节 水的电离和溶液的pH优质ppt课件,文件包含32水的电离和溶液的pH第3课时酸碱中和滴定pptx、media1mp4等2份课件配套教学资源,其中PPT共29页, 欢迎下载使用。
这是一份高中化学人教版 (2019)选择性必修1第二节 水的电离和溶液的pH优质ppt课件,文件包含第二节水的电离和溶液的酸碱性ppt、实验活动2强酸与强碱的中和滴定mp4等2份课件配套教学资源,其中PPT共58页, 欢迎下载使用。










