











高中化学苏教版 (2019)必修 第一册专题5 微观结构与物质的多样性第二单元 微粒之间的相互作用说课ppt课件
展开这是一份高中化学苏教版 (2019)必修 第一册专题5 微观结构与物质的多样性第二单元 微粒之间的相互作用说课ppt课件,文件包含521微粒之间的相互作用力离子键同步课件pptx、521微粒之间的相互作用力离子键分层练习-原卷版docx、521微粒之间的相互作用力离子键分层练习解析版docx、氯化钠的形成mp4等4份课件配套教学资源,其中PPT共30页, 欢迎下载使用。
1.以同素异形现象、同分异构现象为例,认识物质的多样性与微观结构有关。2.认识物质的结构决定物质的性质,性质的特点体现了结构的特点。3.利用结构模型,研究物质的微观结构。
思考1:这一变化过程中,外界提供的能量的作用是什么?
思考2:在这一过程中,外界提供的能量的作用是什么?
加热至100℃时,水会沸腾变成水蒸气。加热至2200℃以上时,水会分解为氢气和氧气。这两个过程有什么不同,所需温度的差异的原因是什么?
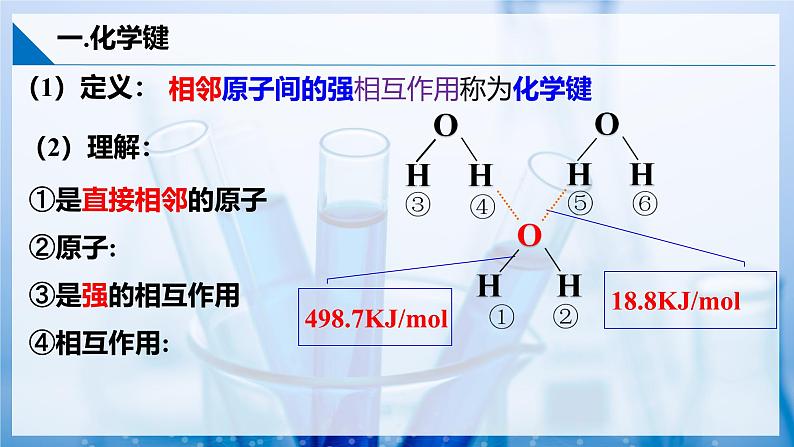
说明水分子间有微弱的相互作用力;水分子内H和O原子之间有强的相互作用,要破坏这种相互作用要消耗足够多的能量。
相邻原子间的强相互作用称为化学键
①是直接相邻的原子②原子:③是强的相互作用④相互作用:
(1)是不是所有物质中都存在化学键? (2)原子之间为什么要形成化学键?(3)那么不同元素间形成的化学键是否相同呢?
稀有气体分子内不存在化学键
元素的原子并未达到稳定结构,化学性质活泼,它们会通过”自助或者互助”达到稳定结构.
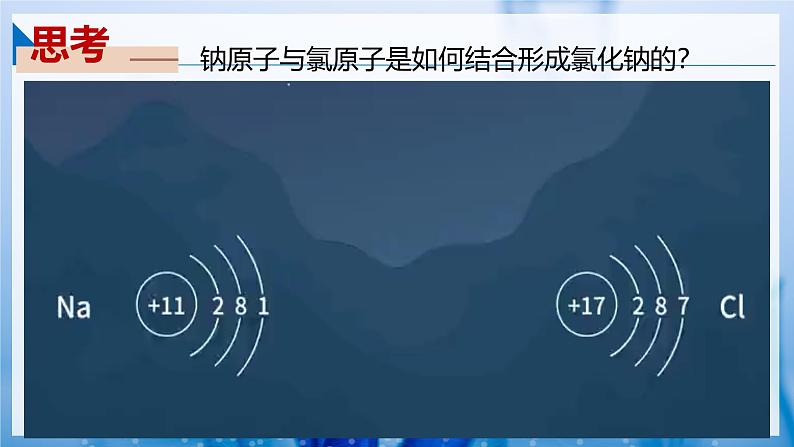
钠原子与氯原子是如何结合形成氯化钠的?
阴离子的核外电子与阳离子的核外电子之间、阴离子的原子核与阳离子的原子核之间的静电斥力使阴、阳离子相互排斥。
阴、阳离子之间的静电引力使阴、阳离子相互吸引
阴、阳离子之间存在的强烈的相互作用
成键元素:一般是活泼金属元素与活泼非金属元素
成键本质:静电作用(包括静电引力和静电斥力)
成键粒子:阳离子和阴离子
AlCl3中Al原子与Cl原子之间不是离子键
常见的哪些元素之间易形成离子键?形成的过程是什么?
活泼金属与活泼非金属元素原子易形成离子键,一般为位于周期表中ⅠA、ⅡA族的金属元素与ⅥA、ⅦA族的非金属元素。
由阴、阳离子构成的化合物。
NaCl、K2SO4、CaCO3
NaOH、Ba(OH)2
离子化合物在溶于水或受热熔化时,离子键被破坏,形成自由移动的阴、阳离子,能够导电。
离子化合物中离子键一般比较牢固,破坏它需要很高的能量,所以离子化合物的熔点一般较高,常温下为固体。
离子化合物中的4个“一定”
离子化合物中一定含有离子键。
含有离子键的化合物一定是离子化合物。
离子化合物中一定含有阳离子和阴离子。
含有铵根离子的化合物一定属于离子化合物。
离子化合物中的2个“不一定”
(1)含有金属元素的化合物不一定是离子化合物,如AlCl3中含有金属元素,但其属于共价化合物。
(2)离子化合物中不一定含有金属元素,如NH4Cl、NH4NO3等铵盐全部由非金属元素组成,但属于离子化合物。
例1.下列关于离子键和离子化合物的说法正确的是( )
在元素符号周围用“·”或“×”来表示原子、离子的最外层电子的式子叫作电子式。
元素符号周围标明元素原子的最外层电子,每个方向不能超过2个电子。当最外层电子数小于或等于4时以单电子分布,多于4时多出部分以电子对分布。
镁原子: ;碳原子: ;氧原子: ;氖原子: 。
简单阳离子是由金属原子失电子形成的,原子的最外层已无电子,故用阳离子的符号表示。
Na+、Li+、Mg2+、Al3+
不但要画出最外层电子数,而且还应用“[ ]”括起来,并在右上角标出“n-”以表示其所带的电荷。
氯离子 ;硫离子 ;
A2B或AB2型的离子化合物:①同种电荷的离子相互排斥②离子数目少的微粒写在中间③离子数目多的同种微粒分开写在左右,不得合并
氧化钙: ;硫化钾: 。
①漏标阴离子的括号,如将S2-的电子式错写为 。②给阳离子多标电子和括号,如将Al3+的电子式错写为 或 。③漏标或错标离子的电荷,如将S2-的电子式错写为 或 。④将多个相同的离子归在一起,如将K2S的电子式错写为 。
书写离子化合物的电子式常出现的错误
(1)NaCl: 。(2)MgBr2: 。
用电子式表示下列物质的形成过程
用电子式表示离子化合物形成过程时注意的问题
①连接符号必须用“―→”而不用“===”。②构成离子化合物的每个离子都要单独写,不能合并。③要标明电子转移的方向。
例2.下列用电子式表示的化合物的形成过程正确的是( )
原子、离子、化合物电子式物质形成过程
1.下列叙述错误的是( )
2.下列各式为用电子式表示的物质的形成过程,其中正确的是( )
相关课件
这是一份高中化学苏教版 (2019)必修 第一册第三单元 从微观结构看物质的多样性获奖ppt课件,文件包含53从微观结构看物质的多样性同步课件pptx、53从微观结构看物质的多样性分层练习-原卷版docx、53从微观结构看物质的多样性分层练习-解析版docx、人造钻石是怎么来的以及石墨变钻石的制造原理1mp4等4份课件配套教学资源,其中PPT共27页, 欢迎下载使用。
这是一份苏教版 (2019)第三单元 防治二氧化硫对环境的污染获奖课件ppt,文件包含43防治二氧化硫对环境的污染同步课件pptx、43防治二氧化硫对环境的污染分层练习-原卷版docx、43防治二氧化硫对环境的污染分层练习---解析版docx、1-人类灭绝的N种方式二氧化硫-480P清晰-AVCmp4、人类忽视的‘杀手’酸雨危害农业我国已成为世界强酸雨中心mp4等5份课件配套教学资源,其中PPT共31页, 欢迎下载使用。
这是一份高中化学苏教版 (2019)必修 第一册专题1 物质的分类及计量第三单元 物质的分散系优秀ppt课件,文件包含13物质的分散系同步课件pptx、13物质的分散系分层练习-原卷版docx、13物质的分散系分层练习-解析版docx、丁达尔效应是如何产生的mp4、导电性实验mp4、氢氧化铁胶体制备丁达尔效应mp4、胶体浊液过滤mp4、胶体的制备mp4、胶体的渗析mp4等9份课件配套教学资源,其中PPT共41页, 欢迎下载使用。













