
人教版 (2019)必修 第一册第三节 氧化还原反应测试题
展开
这是一份人教版 (2019)必修 第一册第三节 氧化还原反应测试题,共6页。试卷主要包含了单选题,实验探究题等内容,欢迎下载使用。
1.下列属于氧化还原反应的是( )
A.CO2+NaOH=NaHCO3
B.2NO2+2NaOH=NaNO2+NaNO3+H2O
C.ICl+2NaOH=NaCl+NaIO+H2O
D.NaOH+HCl=NaCl+H2O
2.黑火药是中国古代四大发明之一,其爆炸反应为2KNO3+S+3C=K2S+N2↑+3CO2↑
下列说法正确的是( )
A.黑火药中含有两种单质B.氮气是氧化产物
C.反应中S作还原剂D.反应为置换反应
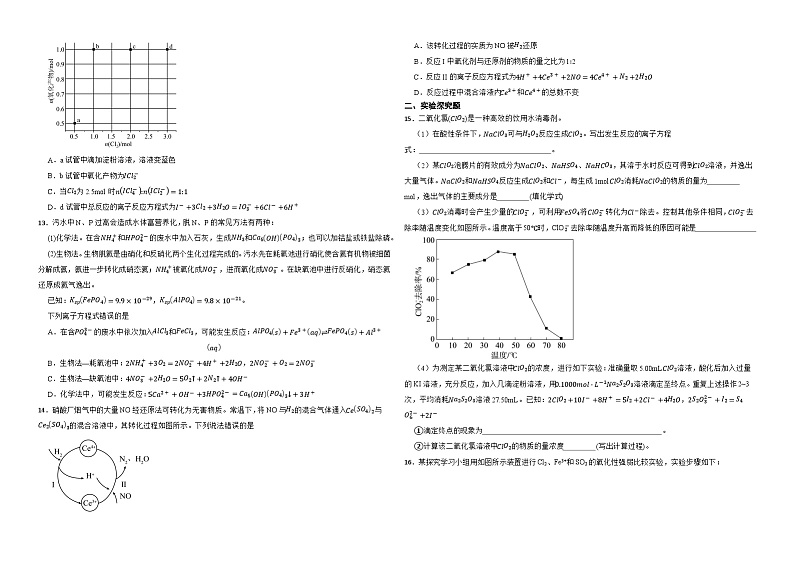
3.关于实验室铁和稀盐酸反应的描述正确的是( )
A.这是一个置换反应
B.反应的化学方程式是2Fe+6HCl → 2FeCl3+3H2↑
C.实验现象是出现气泡,溶液由无色变为棕黄色
D.如果把稀盐酸改为浓盐酸会出现钝化现象
4.在常温下,发生下列几种反应:
①16H++10Z-+2XO 4- =2X2++5Z2+8H2O ②2A2++B2=2A3++2B-③2B-+Z2=B2+2Z-
同一反应中,氧化剂氧化性大于氧化产物氧化性,还原剂还原性大于还原产物还原性。根据上述反应,下列结论判断错误的是( )
A.溶液中可发生:Z2+2A2+=2A3++2Z-
B.Z2在①、③反应中为还原剂
C.氧化性强弱的顺序为:XO 4- >Z2>B2>A3+
D.X2+是XO 4- 的还原产物
5.关于反应5NH4NO3△__2HNO3+4N2↑+9H2O,下列说法正确的是( )
A.HNO3是氧化产物
B.生成1mlN2时,转移3.75ml电子
C.氧化产物与还原产物的物质的量之比为3∶5
D.N2只是还原产物
6.根据硫元素的化合价判断下列物质中的硫元素不能表现氧化性的是( )
A.Na2SB.SC.SO2D.H2SO4
7.长久未使用的铜质器皿中常含有“铜绿”(铜锈),它的化学成分是Cu2(OH)2CO3(碱式碳酸铜)。铜在潮湿的空气中生锈的化学方程式为2Cu+O2+CO2+H2O=Cu2(OH)2CO3。下列有关该反应的说法错误的是( )
A.该反应是氧化还原反应
B.反应物中铜元素和氧气中的氧元素的化合价均发生了变化
C.该反应中Cu得电子,O2失电子,Cu被氧化
D.该反应中O2发生了还原反应
8.某种飞船是以N2H4和N2O4为动力源,化学方程式为2N2H4+N2O4=3N2+ 4H2O,反应温度可高达2700℃,对于该反应,下列说法正确的是( )
A.N2H4分子中所有原子可能共平面
B.N2O4 是还原剂
C.N2既是氧化产物又是还原产物
D.每转移16NA电子则会生成标况下67.2LN2
9.中华民族有着光辉灿烂的历史,下列有关描述不涉及氧化还原反应的是( )
A.用胆矾湿法炼铜
B.用铁矿石高炉炼铁
C.“爆竹声中一岁除,春风送暖入屠苏”
D.只要功夫深,铁杵磨成针
10.已知三个氧化还原反应: ①2FeCl3+2KI=2FeCl2+2KCl+I2 ,②2FeCl2+Cl2=2FeCl3 ,③ 2KMnO4+16HCl(浓)= 2KCl+2MnCl2+8H2O+5Cl2 ↑。若某溶液中有 Fe2+、I-、Cl-共存,要将 I-氧化除去而不氧化 Fe2+和 Cl- ,则可加入的试剂是( )
A.Cl2B.KMnO4C.FeCl3D.HCl
11.能正确表示下列反应的离子方程式为( )
A.Ca(HCO3)2溶液与少量Ca(OH)2溶液混合:Ca2++OH-+HCO3-=CaCO3↓+H2O
B.Fe(NO3)3溶液与少量HI溶液混合:2Fe3++2I-=2Fe2++I2
C.向酸性KMnO4溶液中滴加双氧水:2MnO4-+H2O2+6H+=2Mn2++3O2↑+4H2O
D.向NaHS溶液中滴加Cu(NO3)2溶液:S2-+Cu2+=CuS↓
12.已知:不同量氯气氧化I-可能生成I2、ICl2-、ICl4-、IO3-。现有编号a、b、c、d的4支试管分别装有1L1.0ml⋅L-1KI溶液,分别通入不同量的氯气使每支试管中恰好完全反应且只有一种氧化产物。实验测得结果如图所示。下列叙述错误的是
A.a试管中滴加淀粉溶液,溶液变蓝色
B.b试管中氧化产物为ICl2-
C.当Cl2为2.5ml时nICl4-:nICl2-=1:1
D.d试管中总反应的离子反应方程式为I-+3Cl2+3H2O=IO3-+6Cl-+6H+
13.污水中N、P过高会造成水体富营养化,脱N、P的常见方法有两种:
(1)化学法。在含NH4+和HPO42-的废水中加入石灰,生成NH3和Ca5OHPO43;也可以加铝盐或铁盐除磷。
(2)生物法。生物脱氦是由硝化和反硝化两个生化过程完成的。污水先在耗氧池进行硝化使含氦有机物被细菌分解成氨,氨进一步转化成硝态氦;NH4+被氧化成NO2-,进而氧化成NO3-。在缺氧池中进行反硝化,硝态氦还原成氦气逸出。
已知:KspFePO4=9.9×10-29,KspAlPO4=9.8×10-21。
下列离子方程式错误的是
A.在含PO43-的废水中依次加入AlCl3和FeCl3,可能发生反应:AlPO4s+Fe3+aq⇌FePO4s+Al3+aq
B.生物法—耗氧池中:2NH4++3O2=2NO2-+4H++2H2O,2NO2-+O2=2NO3-
C.生物法—缺氧池中:4NO3-+2H2O=5O2↑+2N2↑+4OH-
D.化学法中,可能发生反应:5Ca2++OH-+3HPO42-=Ca5OHPO43↓+3H+
14.硝酸厂烟气中的大量NO经还原法可转化为无害物质。常温下,将NO与H2的混合气体通入CeSO42与Ce2SO43的混合溶液中,其转化过程如图所示。下列说法错误的是
A.该转化过程的实质为NO被H2还原
B.反应I中氧化剂与还原剂的物质的量之比为1∶2
C.反应II的离子反应方程式为4H++4Ce3++2NO=4Ce4++N2+2H2O
D.反应过程中混合溶液内Ce3+和Ce4+的总数不变
二、实验探究题
15.二氧化氯(ClO2)是一种高效的饮用水消毒剂。
(1)在酸性条件下,NaClO3可与H2O2反应生成ClO2。写出发生反应的离子方程式: 。
(2)某ClO2泡腾片的有效成分为NaClO2、NaHSO4、NaHCO3,其溶于水时反应可得到ClO2溶液,并逸出大量气体。NaClO2和NaHSO4反应生成ClO2和Cl-,每生成1mlClO2消耗NaClO2的物质的量为 ml,逸出气体的主要成分是 (填化学式)
(3)ClO2消毒时会产生少量的ClO2-,可利用FeSO4将ClO2-转化为Cl-除去。控制其他条件相同,ClO2-去除率随温度变化如图所示。温度高于50℃时,ClO2-去除率随温度升高而降低的原因可能是
(4)为测定某二氧化氯溶液中ClO2的浓度,进行如下实验:准确量取5.00mLClO2溶液,酸化后加入过量的KI溶液,充分反应,加入几滴淀粉溶液,用0.1000ml⋅L-1Na2S2O3溶液滴定至终点。重复上述操作2~3次,平均消耗Na2S2O3溶液27.50mL。已知:2ClO2+10I-+8H+=5I2+2Cl-+4H2O,2S2O32-+I2=S4O62-+2I-
①滴定终点的现象为 。
②计算该二氧化氯溶液中ClO2的物质的量浓度 (写出计算过程)。
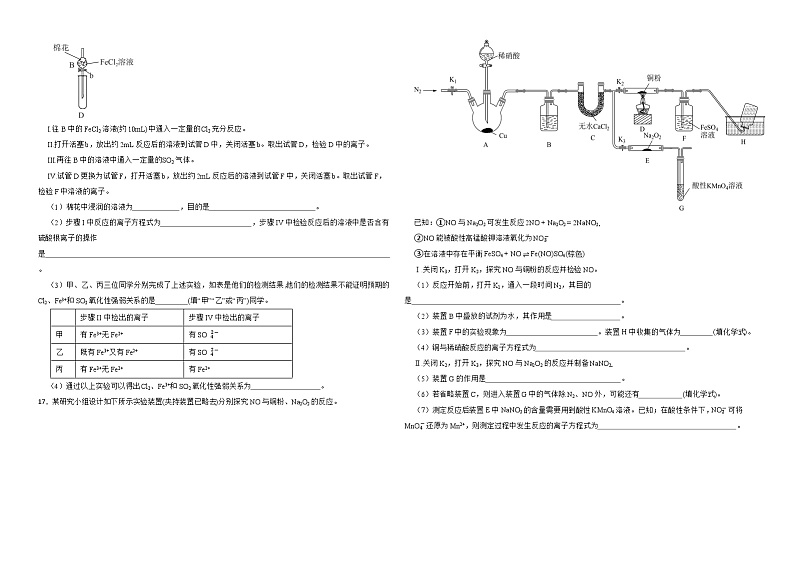
16.某探究学习小组用如图所示装置进行Cl2、Fe3+和SO2的氧化性强弱比较实验,实验步骤如下:
I.往B中的FeCl2溶液(约10mL)中通入一定量的Cl2充分反应。
II.打开活塞b,放出约2mL反应后的溶液到试管D中,关闭活塞b。取出试管D,检验D中的离子。
III.再往B中的溶液中通入一定量的SO2气体。
IV.试管D更换为试管F,打开活塞b,放出约2mL反应后的溶液到试管F中,关闭活塞b。取出试管F,检验F中溶液的离子。
(1)棉花中浸润的溶液为 ,目的是 。
(2)步骤I中反应的离子方程式为 ,步骤IV中检验反应后的溶液中是否含有硫酸根离子的操作是 。
(3)甲、乙、丙三位同学分别完成了上述实验,如表是他们的检测结果,他们的检测结果不能证明预期的Cl2、Fe3+和SO2氧化性强弱关系的是 (填“甲”“乙”或“丙”)同学。
(4)通过以上实验可以得出Cl2、Fe3+和SO2氧化性强弱关系为 。
17.某研究小组设计如下所示实验装置(夹持装置已略去)分别探究NO与铜粉、Na2O2的反应。
已知:①NO与Na2O2可发生反应2NO + Na2O2 = 2NaNO2。
②NO能被酸性高锰酸钾溶液氧化为NO3-
③在溶液中存在平衡FeSO4 + NO ⇌ Fe(NO)SO4(棕色)
Ⅰ.关闭K3,打开K2,探究NO与铜粉的反应并检验NO。
(1)反应开始前,打开K1,通入一段时间N2,其目的是 。
(2)装置B中盛放的试剂为水,其作用是 。
(3)装置F中的实验现象为 。装置H中收集的气体为 (填化学式)。
(4)铜与稀硝酸反应的离子方程式为 。
Ⅱ.关闭K2,打开K3,探究NO与Na2O2的反应并制备NaNO2。
(5)装置G的作用是 。
(6)若省略装置C,则进入装置G中的气体除N2、NO外,可能还有 (填化学式)。
(7)测定反应后装置E中NaNO2的含量需要用到酸性KMnO4溶液。已知;在酸性条件下,NO2-可将MnO4-还原为Mn2+,则测定过程中发生反应的离子方程式为 。
答案
1.【答案】B
【解析】【解答】A.CO2+NaOH=NaHCO3反应中没有元素化合价变化,故A不选;
B.2NO2+2NaOH=NaNO2+NaNO3+H2O,反应中N由+4价变为+2和+5价,有元素化合价变化,故B选;
C.ICl+2NaOH=NaCl+NaIO+H2O反应中没有元素化合价变化,故C不选;
D.NaOH+HCl=NaCl+H2O反应中没有元素化合价变化,故D不选;
故答案为:B。
【分析】反应中元素化合价发生变化的反应,属于氧化还原反应。
2.【答案】A
【解析】【解答】A.黑火药中含有碳和硫两种单质, A选项是正确的;
B.氮气是还原产物,B选项是错误的;
C.S的化合价降低,作氧化剂,C选项是错误的;
D.该反应不是置换反应,D选项是错误的。
故答案为:A。
【分析】A.单质指的是只有一种元素的纯净物;
B.N元素在反应中得到电子,发生还原反应,N2属于还原产物;
C.S的化合价降低,作氧化剂;
D.置换反应指的是一种化合物与一种单质反应得到一种新的单质和新的化合物的反应。
3.【答案】A
【解析】【解答】A.铁和稀盐酸反应时有单质铁参加,有单质氢气生成,该反应属于置换反应,故A符合题意;
B.铁和稀盐酸发生置换反应生成氯化亚铁和氢气,反应的化学方程式是Fe+2HCl=FeCl2+H2↑,故B不符合题意;
C.铁和稀盐酸反应的实验现象是固体溶解,有气泡逸出溶液,溶液由无色变为浅绿色,故C不符合题意;
D.铁在浓盐酸中不会出现钝化现象,故D不符合题意。
故答案为:A。
【分析】A.铁和盐酸的反应是一种单质和一种化合物生成一种新的单质和一种新的化合物的反应,因此属于置换反应;
B.铁和盐酸反应后生成的是二价的铁离子;
C.氯化亚铁溶液的颜色为浅绿色;
D.铁在浓硫酸中会出现钝化的现象,但是在浓盐酸中不会出现。
4.【答案】B
【解析】【解答】①16H++10Z-+2XO 4- =2X2++5Z2+8H2O,氧化剂氧化性大于氧化产物氧化性,则氧化性:XO 4- >Z2;②2A2++B2=2A3++2B-,氧化性:B2>A3+;③2B-+Z2=B2+2Z-,氧化性:Z2>B2;
所以氧化性关系为:XO 4- >Z2>B2>A3+,则还原性为A2+>B−>Z−>X2+。
A. 氧化性:Z2> A3+,则溶液中可发生:Z2+2A2+=2A3++2Z-,故A不符合题意;
B. ①16H++10Z-+2XO 4- =2X2++5Z2+8H2O,还原性:Z−>X2+,Z−是还原剂;③2B-+Z2=B2+2Z-,反应中Z2是氧化剂;故B符合题意;
C. 由分析可知,氧化性关系为:XO 4- >Z2>B2>A3+,故C不符合题意;
D. 化合价降低,发生还原反应,产物是还原产物,则X2+是XO 4- 的还原产物,故D不符合题意。
故答案为:B。
【分析】 ①16H++10Z-+2XO 4- =2X2++5Z2+8H2O 中,Z元素的化合价升高,X元素的化合价降低; ②2A2++B2=2A3++2B- 中,A元素的化合价升高,B元素的化合价降低; ③2B-+Z2=B2+2Z- 中,B元素的化合价升高,Z元素的化合价降低;结合氧化还原反应基本概念及氧化剂的氧化性大于氧化产物的氧化性。还原剂的还原性大于还原产物的还原性来解答。
5.【答案】B
【解析】【解答】A.硝酸中的N是硝酸铵中+5价的N未变价生成的,所以硝酸既不是氧化产物也不是还原产物,故A不符合题意;
B.依据分析可知,当有1ml氮气生成时,转移3.75ml电子,故B符合题意;
C.依据分析可知,氧化产物与还原产物的物质的量之比应为5∶3,故C不符合题意;
D.氮气既是氧化产物又是还原产物,故D不符合题意;
故答案为:B。
【分析】反应 5NH4NO3△__2HNO3+4N2↑+9H2O中,NH4NO3中部分N元素的化合价从-3价升高到0价,被氧化,部分N从+5价降低到0价,被还原。
6.【答案】A
【解析】【解答】A.硫化钠中硫元素处于最低价,为-2价,该物质只有还原性,不能表现氧化性,A符合题意;
B.单质硫中,硫元素化合价为0价,处于中间价,既有氧化性又有还原性,B不符合题意;
C.二氧化硫中,硫元素化合价为+4价,处于中间价,既有氧化性又有还原性,C不符合题意;
D.硫酸中硫元素处于最高价,为+6价,该物质中的硫元素只能表现氧化性,D不符合题意。
故答案为:A
【分析】元素化合价处于最高价态的物质可能具有氧化性,处于中间价态的物质既有氧化性又有还原性,而处于最低价态时,只具有还原性。
7.【答案】C
【解析】【解答】A.2Cu+O2+CO2+H2O=Cu2(OH)2CO3反应中,铜元素化合价升高、氧气中氧元素的化合价降低,该反应属于氧化还原反应,故A不符合题意;
B.2Cu+O2+CO2+H2O=Cu2(OH)2CO3反应中,铜元素化合价升高、氧气中氧元素的化合价降低,反应物中铜元素和氧气中的氧元素的化合价均发生了变化,故B不符合题意;
C.2Cu+O2+CO2+H2O=Cu2(OH)2CO3反应中,铜元素化合价升高,失电子,铜发生氧化反应;氧气中氧元素的化合价降低,氧气得电子,发生还原反应,故C符合题意;
D.2Cu+O2+CO2+H2O=Cu2(OH)2CO3反应中,铜元素化合价升高,失电子,铜发生氧化反应;氧气中氧元素的化合价降低,氧气得电子,发生还原反应,故D不符合题意;
故答案为:C。
【分析】A.氧化还原反应的特征是由元素化合价的改变。
B.反应中,铜元素化合价升高、氧气中氧元素的化合价降低。
C.反应中,铜元素化合价升高,失电子;氧元素的化合价降低,得电子。
D.氧化剂发生还原反应。
8.【答案】C
【解析】【解答】A.sp3杂化,不可能共平面,故A不符合题意
B. N2O4 中N的化合价降低,作氧化剂,故B不符合题意
C.氮气既是氧化产物,又是还原产物,故C符合题意
D. 3N2 ~8e-,转移16ml电子,生成氮气6*22.4L,故D不符合题意
故答案为:C
【分析】氧化还原反应中,有元素化合价升高的物质为还原剂,被氧化得到氧化产物。
9.【答案】D
【解析】【解答】A.用胆矾炼铜,Cu的化合价从+2价降低到0价,所以涉及氧化还原反应,选项A不选;
B.用铁矿石炼铁,Fe元素的化合价降低,铁矿石被还原,属于氧化还原反应,选项B不选;
C.“爆竹声中一岁除”中黑火药的使用时,发生了剧烈的爆炸,
C、S、N等元素的化合价发生变化,涉及氧化还原反应,选项C不选;
D.铁杵磨成针,属于物理变化,不是化学变化,不涉及氧化还原反应,选项D选;
故答案为:D。
【分析】理解选项的各个意思,了解氧化还原反应的含义,即可解决本题。
10.【答案】C
【解析】【解答】A.据分析知氧化性:Cl2>Fe3+,故Cl2可将溶液中的Fe2+一并氧化,A不符合题意;
B.据分析知氧化性:MnO4->Cl2>Fe3+,故KMnO4可将溶液中的Cl-和Fe2+一并氧化,B不符合题意;
C.据分析知氧化性Cl2>Fe3+>I2,因此加入FeCl3溶液后只会发生反应:2Fe3++2I-=2Fe2++I2,可 将I-氧化除去而不氧化Fe2+和Cl-,达到了实验目的,C符合题意;
D.HCl中Cl显-1价,已显最低价态,不具有氧化性,同时由于HI可以在溶液中稳定存在,因此H+也不可将I-氧化,因此加入HCl无法将I-氧化除去,无法达到实验目的,D不符合题意;
故答案为:C。
【分析】根据氧化还原反应“强制弱”的规律,强氧化剂可以制取弱氧化剂。结合反应①可知氧化性:Fe3+>I2;结合反应②知氧化性:Cl2>Fe3+;结合反应③知氧化性:MnO4->Cl2。综合以上结果可知氧化性:MnO4->Cl2>Fe3+>I2。
11.【答案】A
【解析】【解答】A.足量Ca(HCO3)2溶液与少量Ca(OH)2反应的离子方程式为: Ca2++OH-+HCO3-=CaCO3↓+H2O ,A选项是正确的;
B.该反应应该是HNO3与I-之间的氧化还原反应,B选项是错误的;
C.该反应中的电子转移数目是不正确的,C选项是错误的;
D.HS-离子不能拆分,D选项是错误的。
故答案为:A。
【分析】A.当Ca(OH)2的物质的量少时,可认为Ca(OH)2的物质的量是1ml,然后再定Ca(HCO3)2的物质的量;
B.该反应的离子方程式应该是:2NO3-+6I-+8H+=2NO+3I2+4H2O;
C.该反应的离子方程式应该是:2MnO4-+5H2O2+6H+=2Mn2++5O2+8H2O;
D.该反应的离子方程式为:2HS-+2Cu2+=2CuS+2H+.
12.【答案】C
13.【答案】D
14.【答案】B
15.【答案】(1)2ClO3-+H2O2+2H+=2ClO2+O2↑+2H2O
(2)1.25;CO2
(3)温度高于50℃时,Fe2+水解程度增大,Fe2+的浓度减小,故ClO2-去除率降低
(4)溶液由蓝色变为无色,且半分钟内不恢复原来颜色;0.11
【解析】【解答】(1)在酸性条件下,NaClO3可与H2O2反应生成ClO2,同时生成氧气、氯化钠和水,发生反应的离子方程式为:2ClO3-+H2O2+2H+=2ClO2+O2↑+2H2O;
(2)NaHSO4溶液完全电离得到H+,NaClO2和NaHSO4反应生成ClO2和Cl-,即ClO2-发生歧化反应生成ClO2和Cl-, 结合酸性条件配平的离子方程式为5ClO2-+4H+=4ClO2+Cl-+2H2O,根据反应可知,每生成1mlClO2消耗NaClO2的物质的量为1.25ml,因溶液显酸性与NaHCO3反应产生二氧化碳,故逸出气体的主要成分是CO2;
(3)FeSO4是强酸弱碱盐,升高温度促进了Fe2+水解,使更多的Fe2+水解生成Fe(OH)2,导致参与氧化还原反应的Fe2+减少,故ClO2-去除率降低;故答案为: 温度高于50℃时,Fe2+水解程度增大,Fe2+的浓度减小,故ClO2-去除率降低;
(4)①用0.1000ml⋅L-1Na2S2O3溶液滴定至终点,产生的碘恰好完全反应后溶液蓝色褪去,故滴定终点的现象为溶液由蓝色变为无色,且半分钟内不恢复原来颜色;
②依据反应原理得关系式:2C1O2~5I2~10Na2S2O3,n(ClO2)=15n(Na2S2O3),n(C1O2)=0.1m1⋅L-1×27.5mL×10-3L⋅mL-1/5=5.5×10-4m1,c(C1O2)=5.5×10-4m1/5.00mL×10-3L⋅mL-1=0.1100m1⋅L-1。
【分析】(1)酸性条件下含有氢离子,次氯酸根作为氧化剂生成二氧化硫,过氧化氢作为还原剂生成氧气;
(2)结合方程式5ClO2-+4H+=4ClO2+Cl-+2H2O,可以知道亚氯酸根和二氧化硫的化学计量数之比为5:4,结合化学计量数之比等于物质的量之比可以判断亚氯酸根的物质的量;
(3)升高温度会使亚铁离子发生水解,降低去除率;
(4) ① 由于有淀粉和碘,因此溶液为蓝色,滴定终点碘消耗完,溶液变为无色;
② 结合关系式2C1O2~5I2~10Na2S2O3可以判断其二氧化硫的物质的量,计算其浓度。
16.【答案】(1)NaOH溶液;防止SO2、Cl2逸出污染环境
(2)Cl2+2Fe2+=2Fe3++2Cl-;取溶液少许于试管中,先加入足量稀盐酸酸化,再滴加少量BaCl2溶液,若有白色沉淀生成,证明有SO 42- ,反之无SO 42-
(3)甲
(4)Cl2>Fe3+>SO2
【解析】【解答】(1)实验中使用的Cl2、SO2均为有毒气体,会污染空气,应进行尾气处理,由于Cl2、SO2都能被碱溶液吸收,故装置棉花中浸润的溶液为NaOH溶液,用于吸收Cl2、SO2,防止SO2、Cl2逸出污染环境;故答案为:NaOH溶液;防止SO2、Cl2逸出污染环境。
(2)步骤I中Cl2与FeCl2溶液反应生成FeCl3,反应的离子方程式为Cl2+2Fe2+=2Fe3++2Cl-;检验溶液中是否有 SO42- 可先加入足量稀盐酸酸化,再滴加少量BaCl2溶液,通过观察有无白色沉淀产生来判断,故步骤IV中检验反应后的溶液中是否含有硫酸根离子的操作是:取溶液少许于试管中,先加入足量稀盐酸酸化,再滴加少量BaCl2溶液,若有白色沉淀生成,证明有 SO42- ,反之无 SO42- ;故答案为:Cl2+2Fe2+=2Fe3++2Cl-;取溶液少许于试管中,先加入足量稀盐酸酸化,再滴加少量BaCl2溶液,若有白色沉淀生成,证明有 SO42- ,反之无 SO42- 。
(3)甲:步骤II中检出有Fe3+无Fe2+,说明发生了反应Cl2+2Fe2+=2Fe3++2Cl-且Fe2+被完全氧化成Fe3+,可证明Cl2的氧化性强于Fe3+,但步骤II完成后B中可能有未反应的氯气,氯气也能氧化SO2,即使步骤IV中检出了 SO42- ,也不能证明发生了反应2Fe3++SO2+2H2O=2Fe2++ SO42- +4H+,从而不能证明Fe3+、SO2氧化性的强弱;
乙:步骤II中检出既有Fe3+又有Fe2+,说明Cl2能将Fe2+氧化成Fe3+,能证明Cl2氧化性强于Fe3+,由于溶液中仍有Fe2+,说明Cl2完全反应了;步骤IV中检出了 SO42- ,说明步骤III中SO2被Fe3+氧化成了 SO42- ,即发生了反应2Fe3++SO2+2H2O=2Fe2++ SO42- +4H+,从而能证明Fe3+的氧化性强于SO2;
丙:步骤II中检出有Fe3+无Fe2+,说明发生了反应Cl2+2Fe2+=2Fe3++2Cl-且Fe2+被完全氧化成Fe3+,可证明Cl2的氧化性强于Fe3+;步骤IV中检出了Fe2+,说明步骤III中Fe3+被SO2还原成了Fe2+,即发生了反应2Fe3++SO2+2H2O=2Fe2++ SO42- +4H+,从而能证明Fe3+的氧化性强于SO2;
检测结果不能证明预期的Cl2、Fe3+和SO2氧化性强弱关系的是甲同学。
(4)根据(3)的分析可知,氧化性强弱关系为Cl2>Fe3+>SO2。
【分析】要证明氧化性的强弱一般利用“同一氧化还原反应中,氧化性:氧化剂>还原剂,氧化剂>氧化产物”;I.先往B中的FeCl2溶液(约10mL)中通入一定量的Cl2,Cl2与FeCl2溶液发生反应Cl2+2FeCl2=2FeCl3;II.打开活塞b,放出约2mL的溶液到试管D中,检验溶液中是否有Fe3+和Fe2+,判断Cl2与Fe3+氧化性的强弱;III.接着再往B中通入一定量的SO2气体;IV.更换试管D为试管F,重复步骤II,检验F中溶液的离子,判断Fe3+与SO2氧化性的强弱;实验过程中要注意过量Cl2对实验结论的干扰,据此分析解答。
17.【答案】排尽装置中的空气,防止NO被空气中的氧气氧化为二氧化氮;溶解挥发的硝酸;溶液由浅绿色变为棕色;NO和N2;3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O;;吸收未参与反应的NO,防止污染空气;NO2和O2;5NO2-+2MnO4-+6H+=2Mn2++5NO3-+3H2O
步骤II中检出的离子
步骤IV中检出的离子
甲
有Fe3+无Fe2+
有SO 42-
乙
既有Fe3+又有Fe2+
有SO 42-
丙
有Fe3+无Fe2+
有Fe2+
相关试卷
这是一份化学第三节 氧化还原反应练习题,共14页。试卷主要包含了3 氧化还原反应 同步练习题,4L氧气,转移2ml电子,224L气体产生;,2g白色沉淀生成;等内容,欢迎下载使用。
这是一份人教版 (2019)必修 第一册第一章 物质及其变化第三节 氧化还原反应同步训练题,共5页。试卷主要包含了单选题,多选题,填空题等内容,欢迎下载使用。
这是一份高中化学人教版 (2019)必修 第一册第三节 氧化还原反应课后练习题,共16页。试卷主要包含了3 氧化还原反应 同步练习题,6 ml 电子转移时,生成0,4L氧气,转移2ml电子等内容,欢迎下载使用。










