




人教版 (2019)第三节 氧化还原反应优秀导学案
展开01
学习目标
02
预习导学
自主梳理
如何配平较为复杂的氧化还原反应方程式?
请配平工业上制备单质磷的化学方程式:Ca3(PO4)2+SiO2+C→P+CaSiO3+CO↑。
提示:根据氧化剂得电子总数或化合价降低总数与还原剂失电子总数或化合价升高总数相等解题。
一标:写出反应物和生成物的化学式,标出反应前后变价元素的化合价。
二等:据得失电子数相等,找最小公倍数
最小公倍数为10,Ca3(PO4)2乘1,C乘5
三定:先定氧化剂及还原剂的计量数,后定还原产物及氧化产物的计量。
①确定氧化剂及还原剂的计量数:
②确定还原产物及氧化产物的计量数:
四平:用观察法配其它物质的计量数
五查:查各微粒个数、得失电子数是否相等,查离子方程式电荷守恒(对离子方程式而言)
,反应前后原子数、电子得失数都相等。
预习检测
配平以下化学方程式:
1.___NH3+___O2eq \(=====,\s\up7(催化剂),\s\d5(Δ))___NO+___H2O
2.___C+___HNO3(浓)eq \(====,\s\up6(Δ))___NO2↑+___CO2↑+___H2O
3.___KMnO4+___FeSO4+___H2SO4=___K2SO4+___MnSO4+___Fe2(SO4)3+___H2O
4.___Na2SO3+___KIO3+___H2SO4=___Na2SO4+___K2SO4+___I2+___H2O
1.【答案】4 5 4 6
【解析】NH3+O2eq \(=====,\s\up7(催化剂),\s\d5(Δ))NO+H2O反应中,N元素从-3价升为+2价,共升高5价,O元素从0价降为-2价,O2共降低4价,则NH3配4、O2配5得:4NH3+5O2eq \(=====,\s\up7(催化剂),\s\d5(Δ))NO+H2O,再据质量守恒得:4NH3+5O2eq \(=====,\s\up7(催化剂),\s\d5(Δ))4NO+6H2O。
2.【答案】1 4 4 1 2
【解析】C+HNO3(浓)eq \(====,\s\up6(Δ))NO2↑+CO2↑+H2O反应中,C元素从0价升为+4价,共升高4价,N元素从+5价降为+4价,共降低1价,则C配1、HNO3配4得:1C+4HNO3(浓)eq \(====,\s\up6(Δ))NO2↑+CO2↑+H2O,据质量守恒得:1C+4HNO3(浓)eq \(====,\s\up6(Δ))4NO2↑+1CO2↑+2H2O。
3.【答案】2 10 8 1 2 5 8
【解析】KMnO4+FeSO4+H2SO4=K2SO4+MnSO4+Fe2(SO4)3+H2O反应中,Fe元素从+2价升为+3价,共升高1价,Mn元素从+7价降为+2价,共降低5价,则FeSO4配5、KMnO4配1得:1KMnO4+5FeSO4+H2SO4=K2SO4+MnSO4+Fe2(SO4)3+H2O,据Mn、Fe守恒得:1KMnO4+5FeSO4+H2SO4=K2SO4+1MnSO4+ EQ \f(5,2)Fe2(SO4)3+H2O,据K+、SO42-守恒得:1KMnO4+5FeSO4+ EQ \f(8,2)H2SO4= EQ \f(1,2)K2SO4+1MnSO4+ EQ \f(5,2)Fe2(SO4)3+H2O,再由H、O守恒得:1KMnO4+5FeSO4+ EQ \f(8,2)H2SO4= EQ \f(1,2)K2SO4+1MnSO4+ EQ \f(5,2)Fe2(SO4)3+ EQ \f(8,2)H2O,最后各物质计量数同时乘以2得:2KMnO4+10FeSO4+8H2SO4=1K2SO4+2MnSO4+5Fe2(SO4)3+8H2O。
4.【答案】5 2 1 5 1 1 1
【解析】Na2SO3+KIO3+H2SO4=Na2SO4+K2SO4+I2+H2O反应中,S元素从+4价升为+6价,共升高2价,I元素从+5价降为0价,共降低5价,则Na2SO34配5、KIO3配2得:5Na2SO3+2KIO3+H2SO4=Na2SO4+K2SO4+I2+H2O,据I、Na+、K+守恒得5Na2SO3+2KIO3+H2SO4=5Na2SO4+1K2SO4+1I2+H2O,再由SO42-守恒得5Na2SO3+2KIO3+1H2SO4=5Na2SO4+1K2SO4+1I2+H2O,最后由H、O守恒有:5Na2SO3+2KIO3+1H2SO4=5Na2SO4+1K2SO4+1I2+1H2O。
►环节一 氧化还原反应方程式配平
情境材料
高铁酸钠(Na2FeO4)是水处理过程中使用的一种新型净水剂。它的氧化性比高锰酸钾还强,本身在反应中被还原为Fe3+。制取高铁酸钠的离子方程式为:
__Fe3++__Cl2+__eq \x( )=__Cl-+__FeOeq \\al(2-,4)+__H2O
问题探究
1.该反应中,氧化剂是_______,被氧化的元素是______。
2.反应物中缺少的物质是__________。
【答案】1.Cl2 Fe 2.OH-
【解析】1.Cl2生成Cl-,氯的价态降低,故Cl2为氧化剂;铁由+3价升为+6,价态升高被氧化;2.Fe3++Cl2+__eq \x( )=Cl-+FeOeq \\al(2-,4)+H2O反应中,铁共升高3价,氯共降低2价,故Fe3+配2、Cl2配3:2Fe3++3Cl2+__eq \x( )=Cl-+FeOeq \\al(2-,4)+H2O,由铁、氯守恒得:2Fe3++3Cl2+__eq \x( )=6Cl-+2FeOeq \\al(2-,4)+H2O,右边负电荷为-10,则左边缺少16外负电荷,应为16个OH-:2Fe3++3Cl2+16OH-=6Cl-+2FeOeq \\al(2-,4)+H2O,最后由氢氧守恒有:2Fe3++3Cl2+16OH-=6Cl-+2FeOeq \\al(2-,4)+8H2O。
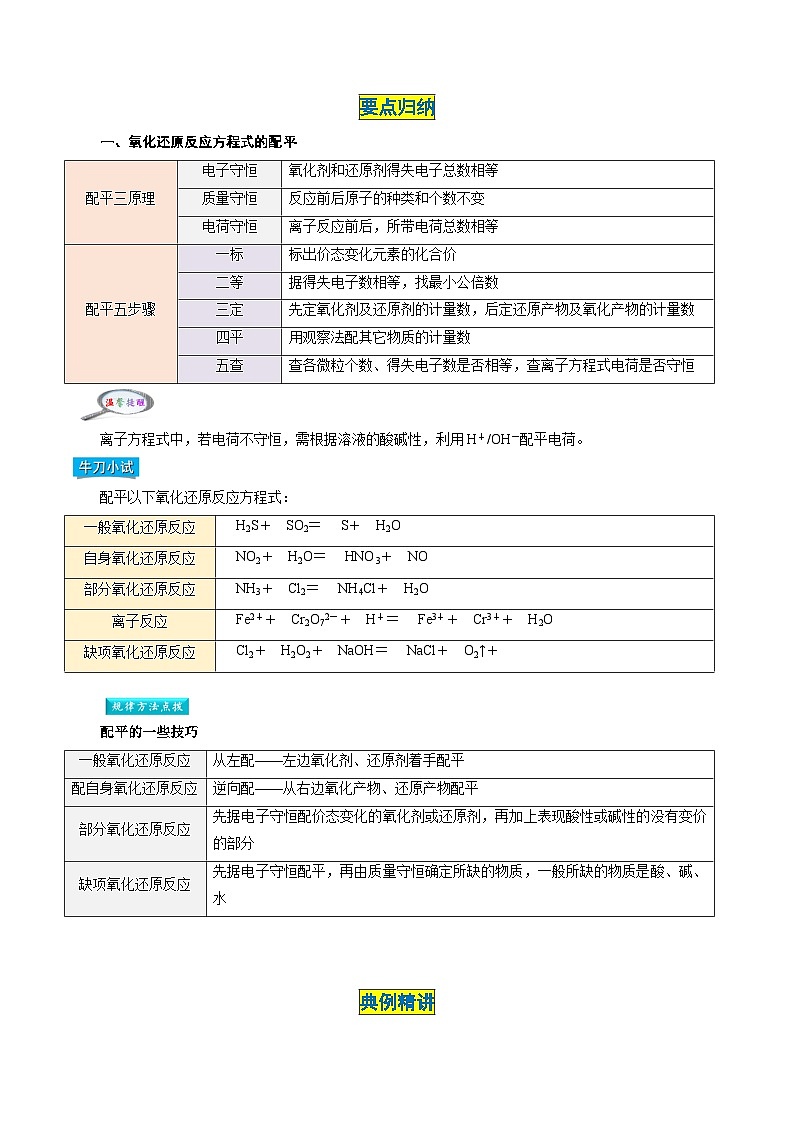
要点归纳
一、氧化还原反应方程式的配平
离子方程式中,若电荷不守恒,需根据溶液的酸碱性,利用H+/OH-配平电荷。
配平以下氧化还原反应方程式:
【答案】2H2S+1SO2=3S+2H2O 3NO2+1H2O=2HNO3+1NO 8NH3+3Cl2=6NH4Cl+2N2 6Fe2++1Cr2O72-+14H+=6Fe3++2Cr3++7H2O 1Cl2+1H2O2+2NaOH=2NaCl+1O2↑+2H2O
配平的一些技巧
典例精讲
【例1】配平方程式:__Cu+__HNO3(稀)=__Cu(NO3)2+__NO↑+__H2O。
【答案】3 8 3 2 4
【解析】Cu+HNO3(稀)=Cu(NO3)2+NO↑+H2O反应中,Cu价态从0价升高为+2价,共升2价,N元素从+5价降低为+2价,共降3价,则Cu配3,HNO3配2:3Cu+2HNO3(稀)=Cu(NO3)2+NO↑+H2O,据Cu、被还原的N守恒得:3Cu+2HNO3(稀)=3Cu(NO3)2+2NO↑+H2O,再据NO3-守恒得还需6个HNO3:3Cu+(2+6)HNO3(稀)=3Cu(NO3)2+2NO↑+H2O,最后由氢氧守恒有:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O。
【例2】(2022年天津市五校联考期中)自来水中的NO3-对人类健康产生危害。为了降低自来水中NO3-的浓度,某研究人员提出在碱性条件下用Al粉还原NO3-,产物是N2。发生的反应可表示如下,请完成方程式的配平。
______Al+______NO3-+______OH-→______AlO2-+______N2↑+_____H2O
【答案】10Al+6NO3-+4OH-=10AlO2-+3N2↑+2H2O
【解析】反应中铝元素化合价由0升高为+3,、氮元素化合价由+5降低为0,根据得失电子守恒有5Al+3NO3-+OH-→5AlO2-+ EQ \f(3,2)N2↑+H2O,由电荷守恒5Al+3NO3-+2OH-→5AlO2-+ EQ \f(3,2)N2↑+H2O,再由质量守恒有5Al+3NO3-+2OH-→5AlO2-+ EQ \f(3,2)N2↑+ EQ \f(1,2)H2O,最后将化学计量数扩大2倍得:10Al+6NO3-+4OH-=10AlO2-+3N2↑+2H2O。
【例3】高铁酸钠(Na2FeO4)是水处理过程中使用的一种新型净水剂。它的氧化性比高锰酸钾还强,本身在反应中被还原为Fe3+。制取高铁酸钠的离子方程式如下,请完成方程式的配平:
__ClO-+__Fe(OH)3+__eq \x( )=__Cl-+__FeOeq \\al(2-,4)+__H2O。
【答案】3 2 4OH- 3 2 5
【解析】ClO-+Fe(OH)3+__eq \x( )=Cl-+FeOeq \\al(2-,4)+H2O反应中,Fe价态从+3价升高为+6价,共升高3价,Cl元素从+1价降为-1价,共降低2价,则Fe(OH)3配2,ClO-配3,得3ClO-+2Fe(OH)3+__eq \x( )=Cl-+FeOeq \\al(2-,4)+H2O,据Cl、Fe守恒:3ClO-+2Fe(OH)3+__eq \x( )=3Cl-+2FeOeq \\al(2-,4)+H2O,再由电荷守恒,右边负电荷为-7,则左边缺少4个负电荷,应为4OH-:3ClO-+2Fe(OH)3+4OH-=3Cl-+2FeOeq \\al(2-,4)+H2O,最后由氢氧守恒得:3ClO-+2Fe(OH)3+4OH-=3Cl-+2FeOeq \\al(2-,4)+5H2O。
►环节二 信息方程式书写
情境材料
工业上用矿石制备物质时,溶液中常含有Fe2+,为除去此离子通常加入酸性H2O2溶液将Fe2+氧化Fe3+,再调节pH将Fe3+转化Fe(OH)3而被除去。
问题探究
1.Fe2+在反应中作__________(填氧化剂、还原剂)。
2.写出Fe2+被酸性H2O2溶液氧化Fe3+的离子方程式。
【答案】1.还原剂 2.2Fe2++H2O2+2H+=2Fe3++2H2O
【解析】1.Fe2+生成Fe3+,铁的价态升高,被氧化,故Fe2+作还原剂;2.由题意有:Fe2++H2O2―→Fe3+,Fe2+作还原剂,则H2O2作氧化剂,其还原产物为H2O,则反应为Fe2++H2O2―→Fe3++H2O,铁的价态升高1价、氧的价态降低2价,由电子守恒及铁守恒有:2Fe2++1H2O2―→2Fe3++H2O,再据电荷守恒,右边电荷为+6,左边缺少2个正电荷,因在酸性溶液中反应,故缺少的粒子是H+,则反应为2Fe2++1H2O2+2H+―→2Fe3++H2O,最后由氢氧守恒有:2Fe2++H2O2+2H+=2Fe3++2H2O。
要点归纳
二、信息型氧化还原反应方程式的书写及配平
1.一判:根据题给信息,联想所学知识,判断主要的反应物、生成物。
若反应物、生成物中主要元素化合价不一致的,要考虑是否为氧化还原反应,就要写出氧化剂、还原剂、氧化产物、还原产物。
2.二平:根据质量守恒定律和氧化还原反应规律配平主要物质的化学计量数。
3.三补:根据溶液的介质条件以及电荷守恒补足反应物或生成物,一般酸性环境可以消耗或生成酸,碱性环境可以消耗或生成碱。
典例精讲
【例4】+6价铬的化合物毒性较大,常用NaHSO3将废液中的Cr2Oeq \\al(2-,7)还原成Cr3+,该反应的离子方程式为____________________________________________________________。
【答案】Cr2Oeq \\al(2-,7)+3HSOeq \\al(-,3)+5H+=2Cr3++3SOeq \\al(2-,4)+4H2O
【解析】Cr2Oeq \\al(2-,7)还原成Cr3+,Cr2Oeq \\al(2-,7)作氧化剂,则NaHSO3作还原剂,被氧化为NaHSO4。发生的反应为Cr2Oeq \\al(2-,7)+HSOeq \\al(-,3)=Cr3++SOeq \\al(2-,4),Cr价态共降低6价,S价态共降低2价,由电子守恒及Cr、S有:1Cr2Oeq \\al(2-,7)+3HSOeq \\al(-,3)=2Cr3++3SOeq \\al(2-,4),左边电荷为-5,右边电荷为0,故左边应添5个H+:1Cr2Oeq \\al(2-,7)+3HSOeq \\al(-,3)+5H+=2Cr3++3SOeq \\al(2-,4),最后由氢氧守恒得Cr2Oeq \\al(2-,7)+3HSOeq \\al(-,3)+5H+=2Cr3++3SOeq \\al(2-,4)+4H2O。
【例5】(2022年江苏省徐州市12月月考选编)亚硝酸钠(NaNO2)像食盐一样有咸味,但有很强的毒性,误食NaNO2会使人中毒。
自来水中的NO3-对人类健康会产生危害,碱性条件下用Mg还原NO3-,主要产物是Mg(OH)2 、N2等,写出该反应过程的离子方程式_______________________________________。
【答案】5Mg+2NO3-+6H2O=5Mg(OH)2+N2↑+2OH-
【解析】根据信息可知发生的反应为:Mg+NO3-―→Mg(OH)2+N2↑,Mg的化合价由0价升为+2价,共升高2价;N的化合价由+5价降为0价,共降低5价。根据电子守恒Mg配5,NO3-配2得:5Mg+2NO3-―→5Mg(OH)2+1N2↑,右边电荷为0,左边电荷为-2,再根据电荷守恒有5Mg+2NO3-―→5Mg(OH)2+1N2↑+2OH-,最后由质量守恒配平得方程式5Mg+2NO3-+6H2O=5Mg(OH)2+N2↑+2OH-。
04
课堂总结
一、氧化还原反应方程式配平
配平的依据是:电子守恒、电荷守恒及质量守恒。
配平的步骤是:一标、二等、三定、四平、五查。
二、信息氧化还原反应方程式书写
一是题意,写出反应物和生成物(有的直接给出,有时要根据反应现象及有关原理判断)。
二是由电子守恒、质量守恒配平,如是离子方程式还要结合电荷守恒配平。
0503
强化训练
1.检验加“碘”盐含“KIO3”可通过在酸性条件下,加入碘化钾溶液和淀粉来实现。反应原理如下:KIO3+KI+HCl―→I2+KCl+H2O(未配平)。下列有关说法正确的是
A.KI是氧化剂
B.KIO3被氧化
C.该反应配平后化学计量数依次为1、5、6、3、6、3
D.每生成3个I2分子,转移6个电子
【答案】C
【解析】A项,KI是还原剂,错误;B项,KIO3被还原,错误;C项,反应中,KIO3中I元素的化合价从+5价降低到0价,KI中I元素的化合价从-1价升高到0价,配平化学方程式为KIO3+5KI+6HCl=3I2+6KCl+3H2O,正确;D项,KI为还原剂,KIO3为氧化剂,反应中每生成3个I2分子,转移5个电子,错误。
2.(2021年四川省成都高一检测)用高铁酸钠(Na2FeO4)对河、湖水消毒是城市饮水处理的新技术。一种生成Na2FeO4的反应如下:Fe2O3+Na2O2(O为-1价)―→Na2FeO4+Na2O(未配平),下列说法不正确的是
A.Na2O2既是氧化剂又是还原剂
B.Fe2O3在反应中失去电子
C.配平后反应为Fe2O3+3Na2O2=2Na2FeO4+Na2O
D.Na2FeO4能杀菌消毒是因其具有强氧化性
【答案】A
【解析】A项,在反应Fe2O3+Na2O2(O元素为-1价)―→Na2FeO4+Na2O中,Fe2O3中的Fe元素失电子被氧化,化合价由+3价升高到+6价,故Fe2O3是还原剂,Na2O2中的O元素得电子被还原,化合价由-1价降低到-2价,故Na2O2是氧化剂,错误;B项,由上分析,Fe2O3在反应中失去电子正确;C项,由得失电子守恒和原子守恒配平,反应为Fe2O3+3Na2O2=2Na2FeO4+Na2O,正确;D项,Na2FeO4中Fe元素处于高价态,具有强氧化性,所以能用于河、湖水的杀菌消毒。
3.已知反应:C2O3+HCl(浓)―→CCl2+Cl2↑+H2O(未配平)。下列说法正确的是
A.每生成1个Cl2,转移6个电子
B.Cl2被氧化,发生氧化反应
C.配平后HCl的系数为4
D.该反应生成x个Cl2,被氧化的HCl为2x个
【答案】D
【解析】C2O3+HCl(浓)―→CCl2+Cl2↑+H2O反应中,C价态共降低2价,Cl价态共升高1价,由电子守恒及C、被氧化的Cl守恒得:1C2O3+2HCl(浓)―→2CCl2+1Cl2↑+H2O,由氯守恒得:1C2O3+(2+4)HCl(浓)―→2CCl2+1Cl2↑+H2O,最后由氢氧守恒有1C2O3+6HCl(浓)―→2CCl2+1Cl2↑+3H2O。
A项,由1C2O3+6HCl(浓)―→2CCl2+1Cl2↑+3H2O可知,每生成1个Cl2,转移2个电子,错误;B项,是HCl被氧化,错误;C项,配平后HCl的系数为6,错误;D项,由2HCl―→Cl2可知,生成x个Cl2,被氧化的HCl为2x个,正确。
4.(2023年江苏省海安中学期中)已知反应:①SO2+2Fe3++2H2O→SO42-+2Fe2++W;②Cr2O72-+aFe2++bH+→cR3++Fe3++H2O(未配平)。下列有关说法正确的是
A.方程式①中W为4OH-
B.还原性强弱:Fe2+>SO2
C.a=6,b=7
D.反应Cr2O72-+3SO2+2H+=2Cr3++3SO42-+H2O能发生
【答案】D
【解析】A项,根据原子守恒并结合离子方程式两边离子所带电荷总数相等可知,反应①为SO2+2Fe3++2H2O=SO42-+2Fe2++4H+,W为4H+,错误;B项,还原剂的还原性强于还原产物,由反应①可知,还原性:SO2>Fe2+,错误;C项,反应②中,Cr元素的化合价由+6降到+3,Cr价态降低6价,Fe元素化合价由+2升高到+3,Fe价态升高1价,根据得失电子守恒可得,1Cr2O72-+6Fe2++bH+→2Cr3++6Fe3++H2O,再结合离子方程两边离子所带电荷总数相等可得1Cr2O72-+6Fe2++14H+→2Cr3++6Fe3++H2O,则a=6,b=14,错误;D项,Cr2O72-具有强氧化性,SO2具有还原性,且由①、②可知氧化性:Cr2O72->SO42-,则Cr2O72-能将SO2氧化为SO42-,即反应Cr2O72-+3SO2+2H+=2Cr3++3SO42-+H2O能发生,正确。
5.若锌与稀硝酸反应时,其反应的化学方程式为4Zn+10HNO3=aZn(NO3)2+bM+cH2O,则a、b、c、M可能分别为
A.4、5、5、NO2↑B.4、2、4、NO2↑
C.4、1、3、NH4NO3D.4、3、5、NO↑
【答案】C
【解析】由反应可知,锌元素的化合价升高,则氮元素的化合价降低。若M为NO2,由得失电子守恒可知,b=eq \f(4×(2-0),5-4)=8,A、B两选项错误;若M为NH4NO3,由得失电子守恒可知,b=eq \f(4×(2-0),5-(-3))=1,结合原子守恒可知,a=4,c=3,C项正确;若M为NO,由得失电子守恒可知,b=eq \f(4×(2-0),5-2)=eq \f(8,3),D项错误。
6.请配平下列反应方程式:
KMnO4+____HCl=____KCl+____MnCl2+____Cl2↑+____H2O,若反应中发生氧化反应的HCl个数为12,则反应中转移的电子数为________。
【答案】2 16 2 2 5 8 12
【解析】反应中Mn元素的化合价由+7价转变成+2价,1个KMnO4得5个电子,Cl元素的化合价由-1价转变成产物中的0价,每个1个HCl失去1个电子,根据得失电子守恒,1KMnO4+5HCl=KCl+1MnCl2+5/2Cl2↑+H2O,由K+、Cl-守恒:1KMnO4+(5+3)HCl=1KCl+1MnCl2+5/2Cl2↑+H2O,再据氢氧守恒得1KMnO4+(5+3)HCl=1KCl+1MnCl2+5/2Cl2↑+4H2O,最后各物质同时乘以2得:2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O,反应中发生氧化反应的HCl个数为12,每个HCl失去1个电子,则失电子数为12。
7.(2022年贵州赫章县高一检测节选)高铁酸钾K2FeO4是一种新型、高效、多功能绿色水处理剂,且无二次污染。K2FeO4中Fe为_______价,盐酸中加入少量K2FeO4固体,产生Cl2,K2FeO4被还原成FeCl3,该反应的化学方程式是_____________________________________________。
【答案】+6 2K2FeO4+16HCl=4KCl+2FeCl3+3Cl2↑+8H2O
【解析】高铁酸钾中钾元素化合价为+1价,氧元素化合价为-2价,依据化合物正、负化合价代数和为零,可知铁元素化合价为+6价;依据题意可知,高铁酸钾与盐酸发生氧化还原反应生成氯化铁和氯气,根据得失电子守恒和原子守恒可知,反应的化学方程式为2K2FeO4+16HCl=4KCl+2FeCl3+3Cl2↑+8H2O。
8.某反应的反应物与生成物有K2Cr2O7、KCl、CrCl3、Cl2、HCl、H2O,已知氧化性:K2Cr2O7>Cl2,写出并配平该化学方程式:________________________________________。
【答案】K2Cr2O7+14HCl=3Cl2↑+2KCl+2CrCl3+7H2O
【解析】根据题中信息可知反应为:K2Cr2O7+HCl=Cl2↑+KCl+CrCl3+H2O。Cr价态共降低6价,Cl的价态升高1价,由电子守恒有:1K2Cr2O7+6HCl=Cl2↑+KCl+CrCl3+H2O,据Cr及被还原的Cl守恒有:1K2Cr2O7+6HCl=3Cl2↑+2KCl+2CrCl3+H2O,再由氯守恒:1K2Cr2O7+(6+8)HCl=3Cl2↑+2KCl+2CrCl3+H2O,最后由氢氧守恒有:1K2Cr2O7+14HCl=3Cl2↑+2KCl+2CrCl3+7H2O。
9.FeCl2、FeCl3和K2FeO4(高铁酸钾)都是铁的重要化合物。回答下列问题:
(1)K2FeO4所含铁元素的化合价是__________。
(2)FeCl2、FeCl3和K2FeO4的氧化性强弱顺序是______>________>________。
(3)在酸性溶液中,Fe2+和FeOeq \\al(2-,4)发生反应生成Fe3+,该反应的离子方程式是
_________________________________________________。
【答案】(1)+6 (2)K2FeO4 FeCl3 FeCl2 (3)3Fe2++FeOeq \\al(2-,4)+8H+=4Fe3++4H2O
【解析】(1)K2FeO4中K和O的化合价分别是+1和-2,设Fe的化合价是x,根据化合物中各元素正、负化合价代数和等于零,得2×(+1)+x+4×(-2)=0,解得x=+6;(2)FeCl2、FeCl3和K2FeO4的氧化性都是铁元素的氧化性,FeCl2、FeCl3和K2FeO4所含铁元素的化合价依次升高,则氧化性强弱的顺序是K2FeO4>FeCl3>FeCl2;(3)Fe2++FeOeq \\al(2-,4)―→Fe3+是在酸性溶液里发生的氧化还原反应,也是离子反应。根据铁元素化合价升降守恒,得3Fe2++FeOeq \\al(2-,4)―→4Fe3+;根据电荷守恒和质量守恒,得3Fe2++FeOeq \\al(2-,4)+8H+=4Fe3++4H2O。
10.(2022年河南省新乡市期中)高铁酸钠(Na2FeO4)是一种新型绿色消毒剂,主要用于饮用水处理,工业上有多种制备高铁酸钠的方法,其中一种方法的化学反应原理可用离子方程式表示为3ClO-+2Fe3++xOH-=2FeO42-+3Cl-+yH2O。
(1)上述反应中的x=_______,y=_______。
(2)上述反应中氧化剂为_______;还原产物为_______。
(3)由上述反应可知,氧化性强弱:ClO-_______(填“>”或“<”,下同)FeO42-;还原性强弱:Cl-_______Fe3+。
(4)请用单线桥法表示该反应中电子的转移情况:_______________________________________。
(5)已知:Na2FeO4在处理饮用水的过程中铁元素会被转化为Fe3+,进而Fe3+在水中产生Fe(OH)3胶体,Fe(OH)3胶体具有吸附性。
①Na2FeO4在处理饮用水的过程中_______(填“发生了”或“未发生”)氧化还原反应。
②Fe(OH)3胶体为_______色,写出区分胶体与溶液的操作及现象:_____________________________
___________________________________________________。
【答案】(1)10 5 (2)ClO- Cl- (3)> < (4) (5)①发生了 ②红褐 用激光笔照射液体,从垂直于光束的方向观察,若是胶体则可以看到一条光亮的“通路”
【解析】(1)在3ClO-+2Fe3++xOH-=2FeO42-+3Cl-+yH2O中,根据电荷守恒:-3+6-x=-4-3,所以x=10,然后根据质量守恒可求出y=5,即该反应的化学方程式为:3ClO-+2Fe3++10OH-=2FeO42-+3Cl-+5H2O;(2)在3ClO-+2Fe3++10OH-=2FeO42-+3Cl-+5H2O中,ClO-中氯元素的化合价从+1价降低到反应后Cl-中的-1价,做氧化剂,被还原,还原产物为Cl-;(3)该反应中,ClO-做氧化剂,Cl-是还原产物,Fe3+被氧化为FeO42-,则Fe3+是还原剂,FeO42-是氧化产物。在一个氧化还原反应中,氧化剂的氧化性强于氧化产物的氧化性,还原剂的还原性强于还原产物的还原性,则氧化性:ClO->FeO42-,还原性:Fe3+>Cl-;(4)该反应中,1 个ClO-转化为Cl-,得到2个电子,则3个ClO-转化为Cl-,得到6个电子;1个Fe3+转化为FeO42-,失去3个电子,则2个Fe3+转化为FeO42-,失去6个电子。即2个Fe3+转移6个电子给3个ClO-,用单线桥法表示表示该反应中电子的转移情况为:;(5)Na2FeO4在处理饮用水的过程中铁元素会被转化为Fe3+,铁元素发生了化合价的变化,发生了氧化还原反应。Fe(OH)3胶体为红褐色,区分胶体与溶液的方法为丁达尔效应,具体操作为用激光笔照射液体,从垂直于光束的方向观察,若是胶体则可以看到一条光亮的“通路”。
1.知道氧化还原反应方程式配平的三个原理——电子守恒原理、电荷守恒原理及质量守恒原理。
2.能初步配平不同类型的氧化还原反应方程式。
3.能根据信息书写陌生的氧化还原反应方程式。
配平三原理
电子守恒
氧化剂和还原剂得失电子总数相等
质量守恒
反应前后原子的种类和个数不变
电荷守恒
离子反应前后,所带电荷总数相等
配平五步骤
一标
标出价态变化元素的化合价
二等
据得失电子数相等,找最小公倍数
三定
先定氧化剂及还原剂的计量数,后定还原产物及氧化产物的计量数
四平
用观察法配其它物质的计量数
五查
查各微粒个数、得失电子数是否相等,查离子方程式电荷是否守恒
一般氧化还原反应
eq \x( )H2S+eq \x( )SO2=eq \x( )S+eq \x( )H2O
自身氧化还原反应
eq \x( )NO2+eq \x( )H2O=eq \x( )HNO3+eq \x( )NO
部分氧化还原反应
eq \x( )NH3+eq \x( )Cl2=eq \x( )NH4Cl+eq \x( )H2O
离子反应
eq \x( )Fe2++eq \x( )Cr2O72-+eq \x( )H+=eq \x( )Fe3++eq \x( )Cr3++eq \x( )H2O
缺项氧化还原反应
eq \x( )Cl2+eq \x( )H2O2+eq \x( )NaOH=eq \x( )NaCl+eq \x( )O2↑+eq \x( )eq \x( )
一般氧化还原反应
从左配——左边氧化剂、还原剂着手配平
配自身氧化还原反应
逆向配——从右边氧化产物、还原产物配平
部分氧化还原反应
先据电子守恒配价态变化的氧化剂或还原剂,再加上表现酸性或碱性的没有变价的部分
缺项氧化还原反应
先据电子守恒配平,再由质量守恒确定所缺的物质,一般所缺的物质是酸、碱、水
第08讲 氧化还原反应方程式的书写与配平-2025年高考化学大一轮复习卓越讲义(含答案): 这是一份第08讲 氧化还原反应方程式的书写与配平-2025年高考化学大一轮复习卓越讲义(含答案),文件包含第08讲氧化还原反应方程式的书写与配平-2025年高考化学大一轮复习卓越讲义教师版pdf、第08讲氧化还原反应方程式的书写与配平-2025年高考化学大一轮复习卓越讲义学生版pdf等2份学案配套教学资源,其中学案共18页, 欢迎下载使用。
新高考化学一轮复习精品学案 第1章 第5讲 氧化还原反应方程式的书写与配平(含解析): 这是一份新高考化学一轮复习精品学案 第1章 第5讲 氧化还原反应方程式的书写与配平(含解析),共15页。
2024年高考化学一轮复习 第8讲 氧化还原反应方程式的书写与配平 学案(含答案): 这是一份2024年高考化学一轮复习 第8讲 氧化还原反应方程式的书写与配平 学案(含答案),共8页。













