



所属成套资源:2024年高中化学同步精品讲义(人教版必修一)
人教版 (2019)必修 第一册第三节 物质的量优秀导学案
展开
这是一份人教版 (2019)必修 第一册第三节 物质的量优秀导学案,文件包含第17讲29物质的量浓度及其计算教师版-2024年高中化学同步精品讲义必修一docx、第17讲29物质的量浓度及其计算学生版-2024年高中化学同步精品讲义必修一docx等2份学案配套教学资源,其中学案共22页, 欢迎下载使用。
02
预习导学
自主梳理
一.物质的量浓度
1.在很多情况下取用溶液时,一般不是称量它的质量,而是量取它的_______。
2.物质的量浓度是表示单位_______的溶液里所含溶质B的___________,常用的单位为__________。
二、物质的量浓度计算
1.已知溶液中某种粒子的浓度,求其他粒子的浓度。
如是单一溶质的溶液,可根据溶质的化学式计算;如为混合溶液,则据______守恒计算。
2.溶液稀释的计算。
实验室中常要将浓溶液稀释成不同浓度的稀溶液,稀释前后溶质的物质的量保持不变。在用浓溶液配制稀溶液时,用c(浓)·V(浓)=______________的式子进行计算。
一、1.体积 2.体积 物质的量 ml·L-1
二、1.电荷 2.c(稀)·V(稀)
预习检测
1.(2022年陕西陈仓区期中)某同学体检的血液化验单中,葡萄糖为0.0059 ml·L-1。表示该体检指标的物理量是
A.溶解度(S)B.物质的量浓度(c)
C.质量分数(ω)D.摩尔质量(M)
【答案】B
【解析】葡萄糖为0.0059 ml·L-1,涉及单位为ml·L-1,为物质的量浓度的单位,溶解度的单位为g,质量分数无单位,摩尔质量单位为g·ml-1,答案为B项。
2.(2023年江苏省海门中学期中)等物质的量浓度的氯化铝、氯化镁、氯化钠三种溶液的体积比为3∶2∶1,则三种溶液中氯离子的物质的量浓度之比为
A.1∶2∶3B.9∶4∶1C.3∶2∶1D.1∶1∶1
【答案】C
【解析】离子的物质的量浓度=溶质的物质的量浓度×溶质化学式中含有离子的个数,等物质的量浓度的AlCl3、MgCl2、NaCl三种溶液中氯离子的物质的量浓度之比为(1×3)∶(1×2)∶(1×1)=3∶2∶1,与溶液的体积无关;答案选C项。
3.(2023年辽宁省葫芦岛市期中)欲配制100 mL 1.0 ml·L-1 Na2SO4溶液,正确的方法是
①将14.2 g Na2SO4,溶于100 mL水中
②将32.2 g Na2SO4•10H2O溶于少量水中,再用水稀释至100 mL
③将20 mL 5.0 ml·L-1 Na2SO4溶液用水稀释至100 mL
A.①②B.②③C.①③D.①②③
【答案】B
【解析】①14.2 g Na2SO4的物质的量为 EQ \f(14.2 g,142 g·ml-1)=0.1 ml,但溶液的体积不等于溶剂的体积,所以无法计算出物质的量浓度,故①错误;②32.2 g Na2SO4•10H2O物质的量为 EQ \f(32.2 g,322 g·ml-1)=0.1 ml,硫酸钠的物质的量等于硫酸钠晶体的物质的量,硫酸钠的物质的量浓度c= EQ \f(0.1 ml,0.1 L)=1.0 ml·L-1,故②正确;③根据稀释定律,稀释前后溶质硫酸钠的物质的量不变,则20 mL×5 ml·L-1=100 mL×c(硫酸钠),则c(硫酸钠)=1.0 ml·L-1,故③正确;②③正确,故答案为B项。
4.(2023年河北省唐山市十县一中联盟上学期期中)美国UNC化学教授ThmasJ·Meyer等研发了环境友好、安全型的“绿色”引爆炸药,其中一种可表示为Na2R,它保存在水中可以失去活性,爆炸后不会产生危害性残留物。已知10 mL Na2R溶液含Na+的数目为N,该Na2R溶液的物质的量浓度为
A.N×10-2 ml·L-1B. EQ \f(N,1.204×1022) ml·L-1
C. EQ \f(N,6.02×1021) ml·L-1D. EQ \f(N,6.02×1025) ml·L-1
【答案】B
【解析】10 mL该Na2R溶液中含Na+的数目为N,则Na2R的物质的量为 EQ \f(N,2×6.02×1023) ml,Na2R的物质的量浓度为 EQ \f( EQ \f(N,2×6.02×1023),0.01 L)= EQ \f(N,1.204×1022) ml·L-1,B项符合题意。
5.(2022年江苏省扬州市邗江区期中)将100 mL 2.50 ml·L-1 BaCl2溶液加水稀释至500 mL,所得溶液中Cl-物质的量浓度为___________。
【答案】1.0 ml·L-1
【解析】100 mL 2.50 ml·L-1 BaCl2溶液中,c(Cl-)=2.50 ml·L-1×2=5.0 ml·L-1。
将100 mL 2.50 ml·L-1BaCl2溶液加水稀释至500 mL,设稀释后氯化钡溶液的浓度中c(Cl-)为x,根据稀释前后Cl-物质的量不变,则100 mL×5.0 ml·L-1=x×500 mL,x= EQ \f(100 mL×5.0 ml·L-1,500 mL)=1.0 ml·L-1,则所得溶液中Cl-物质的量浓度为1 ml·L-1。
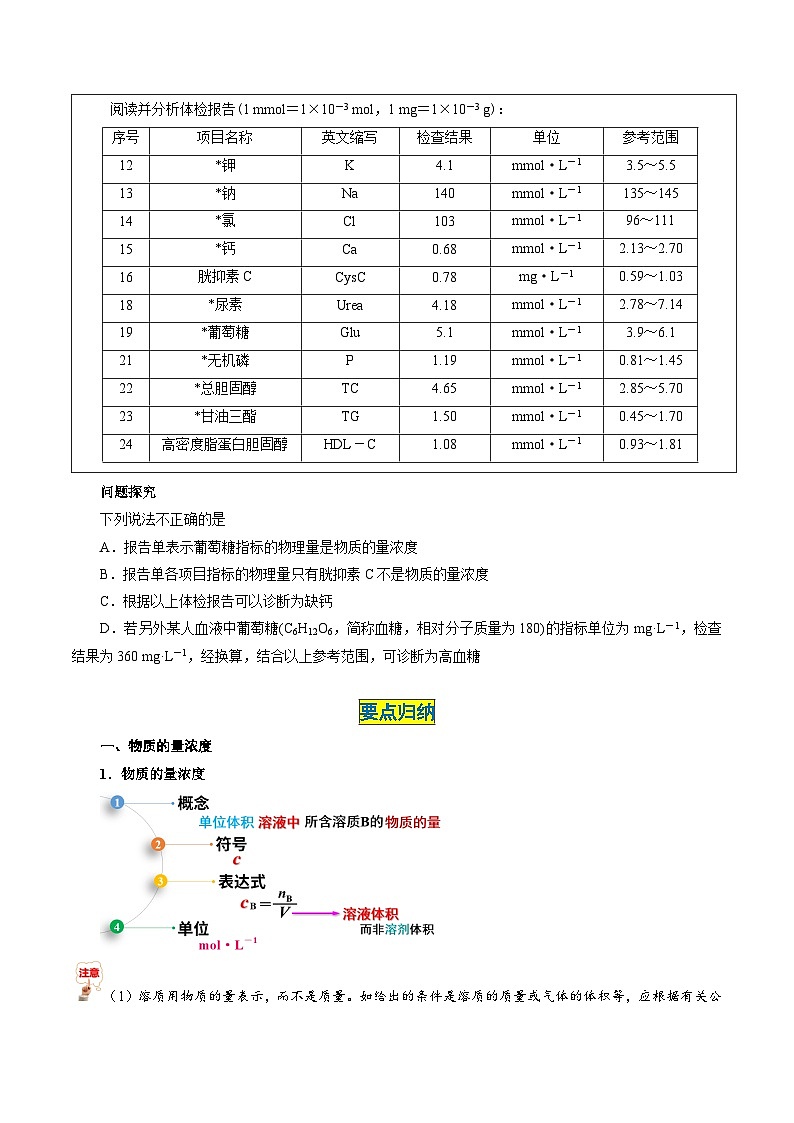
6.(2022年四川资阳期末)下表是某儿童在医院临床检验结果报告单的部分数据:
根据上表的数据,回答下列问题。
(1)该儿童___________元素含量偏低。(填元素符号)
(2)报告单中“mml/L”是___________(填“质量”、“体积”或“浓度”)的单位。
(3)检测人的血液中葡萄糖(简称血糖,分子式:C6H12O6)的含量。葡萄糖的摩尔质量为___________。如果以医学中惯用单位“mg/dL”来表示,该儿童的血糖值是___________mg/dL(已知:1 L=10 dL)。
【答案】(1)Ca (2)浓度 (3)①180 g/ml ②90
【解析】(1)根据图表信息可知该儿童Ca元素含量偏低;(2)报告单中“mml/L”是浓度的单位;(3)检测人的血液中葡萄糖(简称血糖,分子式:C6H12O6)的含量。葡萄糖的相对分子质量为180,摩尔质量在数值上与相对分子质量相等,摩尔质量为180 g/ml。如果以医学中惯用单位“mg/dL”来表示,该儿童的血糖值是 EQ \f(5.0 mml/L×1 L×180 mg/mml,10 dL)=90 mg/dL。
►环节一 物质的量浓度
情境材料
阅读并分析体检报告(1 mml=1×10-3 ml,1 mg=1×10-3 g):
序号
项目名称
英文缩写
检查结果
单位
参考范围
12
*钾
K
4.1
mml·L-1
3.5~5.5
13
*钠
Na
140
mml·L-1
135~145
14
*氯
Cl
103
mml·L-1
96~111
15
*钙
Ca
0.68
mml·L-1
2.13~2.70
16
胱抑素C
CysC
0.78
mg·L-1
0.59~1.03
18
*尿素
Urea
4.18
mml·L-1
2.78~7.14
19
*葡萄糖
Glu
5.1
mml·L-1
3.9~6.1
21
*无机磷
P
1.19
mml·L-1
0.81~1.45
22
*总胆固醇
TC
4.65
mml·L-1
2.85~5.70
23
*甘油三酯
TG
1.50
mml·L-1
0.45~1.70
24
高密度脂蛋白胆固醇
HDL-C
1.08
mml·L-1
0.93~1.81
问题探究
下列说法不正确的是
A.报告单表示葡萄糖指标的物理量是物质的量浓度
B.报告单各项目指标的物理量只有胱抑素C不是物质的量浓度
C.根据以上体检报告可以诊断为缺钙
D.若另外某人血液中葡萄糖(C6H12O6,简称血糖,相对分子质量为180)的指标单位为mg·L-1,检查结果为360 mg·L-1,经换算,结合以上参考范围,可诊断为高血糖
【答案】D
【解析】A项,由表可知报告单表示葡萄糖指标的物理量——mml·L-1,是物质的量浓度,正确;B项,报告单各项目指标的物理量——mg·L-1,不是物质的量浓度,正确;C项,由报告单可知钙的量0.68,低于2.13~2.70,正确;D项,若另外某人血液中葡萄糖(C6H12O6,简称血糖,相对分子质量为180)的指标单位为mg·L-1,检查结果为360 mg·L-1,c(葡萄糖)= EQ \f( EQ \f(1360,180) mml,1 L)=2 mml·L-1,结合以上参考范围,低于血糖浓度的最低值,可诊断为低血糖,错误。
要点归纳
一、物质的量浓度
1.物质的量浓度
(1)溶质用物质的量表示,而不是质量。如给出的条件是溶质的质量或气体的体积等,应根据有关公式换算为物质的量。
(2)表达式中的体积(V)指溶液的体积,不是溶剂,也不是溶剂和溶质的体积之和。
(3)从溶液中取出部分溶液时,改变的是溶液体积,不变的是溶液的浓度,但其中所含溶质的物质的量与所取体积有关。
(4)整体与部分的关系:如0.1 ml·L-1 AlCl3溶液中,c(Al3+)=0.1 ml·L-1,c(Cl-)=0.3 ml·L-1。
(5)带有结晶水的物质作为溶质时,其“物质的量”的计算:用带有结晶水的物质的质量除以带有结晶水的物质的摩尔质量。如a g胆矾(CuSO4·5H2O)溶于水得到V L溶液,其物质的量浓度为c(CuSO4)=eq \f(\f(a g,250 g·ml-1),V L)=eq \f(a,250V) ml·L-1。
(6)确定溶液中溶质的几种特殊情况:
①带有结晶水的物质如CuSO4·5H2O溶于水时,其溶质是CuSO4,而不是CuSO4·5H2O。
②某些物质溶于水后与水发生反应生成了新物质,此时溶质为反应后的生成物,如Na、Na2O、Na2O2eq \(――→,\s\up7(水))NaOH,溶质为NaOH,SO3eq \(――→,\s\up7(水))H2SO4,溶质为H2SO4。
③NH3溶于水后溶质为NH3·H2O,但计算浓度时是以NH3分子作为溶质。
典例精讲
【例1】(2022年山西省大同市期中)用NA表示阿伏加德罗常数的值,下列关于0.2 ml·L-1的K2SO4溶液的说法正确的是
A.5 L溶液中K+的浓度是0.4 ml·L-1
B.500 mL溶液中含有0.1NA个K+
C.1 L溶液中所含K、S的原子总数为0.3NA
D.2 L溶液中SO42-的浓度是0.4 ml·L-1
【答案】A
【解析】A项,0.2 ml·L-1的K2SO4溶液,每摩尔硫酸钾含有2 ml钾离子,钾离子的浓度为硫酸钾浓度的2倍,所以K+的浓度是0.4 ml·L-1,正确;B项,K+的浓度是0.4 ml·L-1,500 mL溶液中K+的物质的量为0.5 L×0.4 ml·L-1=0.2 ml,个数为0.2NA,错误;C项,1 L溶液中所含K、S的原子总数为1 L×0.2 ml·L-1×3×NA ml-1=0.6 NA,错误;D项,溶液是均一的,每摩尔硫酸钾含有1 ml SO42-,SO42-的浓度等于硫酸钾的浓度,即为0.2 ml·L-1,错误。
【例2】(2022年黑龙江省大庆铁人中学期末)下列溶液中,溶质的物质的量浓度不是1 ml·L-1的是
A.10 g NaOH固体溶解在水中配成250 mL溶液
B.将80 g SO3溶于水并配成1 L的溶液
C.将0.5 ml·L-1的NaNO3溶液100 mL加热蒸发掉50 g水的溶液
D.标况下,将 22.4 L氯化氢气体溶于水配成1 L溶液
【答案】C
【解析】A项,10 g NaOH固体的物质的量为 EQ \f(10 g,40 g·ml-1)=0.25 ml,溶解在水中配成250 mL溶液,NaOH的物质的量浓度为 EQ \f(0.25 ml,0.25 L)=1 ml·L-1,不符合题意;B项,80 g SO3的物质的量为 EQ \f(80 g,80 g·ml-1)=1 ml,SO3溶于水和水反应:SO3+H2O=H2SO4,硫酸的物质的量也为1 ml,配成1 L溶液,溶液体积为1 L,所以H2SO4的物质的量浓度为 EQ \f(1 ml,1 L)=1 ml·L-1,不符合题意;C项,将100 mL NaNO3溶液加热蒸发掉50 g水,溶液体积不是50 mL,所以蒸发后的溶液中溶质的物质的量浓度无法计算,符合题意;D项,标况下,22.4 L氯化氢气体的物质的量为 EQ \f(22. 4 L,22.4 L·ml-1)=1 ml·L-1,溶于水配成1 L溶液,溶质的物质的量浓度为 EQ \f(1 ml,1 L)=1 ml·L-1,不符合题意。
【例3】(2022年北京丰台期中)将50 mL 0.3 ml·L-1 NaOH溶液加水稀释到500 mL,稀释后溶液中NaOH的物质的量浓度为
A.0.3 ml·L-1B.0.03 ml·L-1
C.0.05 ml·L-1D.0.04 ml·L-1
【答案】B
【解析】根据溶液稀释前后溶质的物质的量不变得到0.05 L×0.3 ml·L-1=c×0.5 L,c=0.03 ml·L-1,故B项符合题意。
►环节二 物质的量浓度计算
情境材料
如图是某校化学实验室中硫酸试剂标签上的部分内容。
硫酸 化学纯(CP)( 500 mL)
品名:硫酸
化学式:H2SO4
相对分子质量:98
密度:1.84 g·mL-1
质量分数:98%
问题探究
据此分析下列说法错误的是
A.该硫酸的物质的量浓度为9.2 ml·L-1
B.100 mL该硫酸的质量是184 g
C.硫酸的摩尔质量与磷酸(H3PO4)的摩尔质量相同
D.10 g 98%的硫酸(密度为1.84 g·cm-3)与10 mL 18.4 ml·L-1的硫酸的浓度是相同的
【答案】A
【解析】A项,该硫酸的物质的量浓度为eq \f(1 000 mL·L-1×1.84 g·mL-1×98%,98 g·ml-1)=18.4 ml·L-1,错误,符合题意;B项,100 mL该硫酸的质量为100 mL×1.84 g·mL-1=184 g,正确,不符合题意;C项,硫酸和磷酸的摩尔质量均为98 g·ml-1,正确,不符合题意;D项,由A项分析可知,10 g 98%的硫酸(密度为1.84 g·cm-3)其物质的量浓度为18.4 ml·L-1,正确,不符合题意。
要点归纳
二、物质的量浓度计算
(1)溶液中离子浓度的计算
——溶液中阴、阳离子的物质的量浓度之比=化学组成中的离子个数之比。
例如:
电荷守恒三步骤
找出所有的阳离子及阴离子
离子浓度乘以其化合价——1价可不写,2价、3价不能省略!
列等式,计算
c(M+)×1+c(M2+)×2+c(M3+)×3=c(R-)×1+c(R2-)×2+c(R3-)×3
(2)物质的量浓度与溶质的质量分数的换算
换算公式:cB=eq \f(\a\vs4\al(1 000ρw),M) ml·L-1
M:溶质B的摩尔质量(单位:g·ml-1);ρ:溶液密度(单位:g·mL-1);w:溶质的质量分数。
推导方法:
设溶液体积为1 L,则cB=eq \f(nB,V)=eq \f(\f(\a\vs4\al(ρ g·mL-1×1 000 mL×w),M g·ml-1),1 L)=eq \f(\a\vs4\al(1 000ρw),M) ml·L-1。
(3)溶液稀释与混合的计算
(4)标准状况下气体溶于水的计算
混合后溶液的体积
①若指出不考虑溶液体积改变,可认为是原溶液的体积之和。
②若给出混合后溶液的密度,应根据V(混)=eq \f(m(混),ρ(混))=eq \f(ρ1V1+ρ2V2,ρ混)来计算。
典例精讲
【例4】(2023年山东省菏泽市期中)下列溶液中的Cl-的物质的量与50 mL 1 ml·L-1 MgCl2溶液中的Cl-的物质的量相等的是
A.100 mL 1 ml·L-1 AlCl3溶液B.50 mL 0.5 ml·L-1 CaCl2
C.50 mL 2 ml·L-1 KCl溶液D.100 mL 2 ml·L-1 NaCl溶液
【答案】C
【解析】50 mL 1 ml·L-1 MgCl2溶液中的Cl-物质的量为1 ml·L-1×2×0.05 L=0.1 ml。
A项,100 mL 1 ml·L-1 AlCl3溶液中的Cl-物质的量为1 ml·L-1×3×0.1 L=0.3 ml,不符合题意;B项,50 mL 0.5 ml·L-1 CaCl2溶液中的Cl-物质的量为0.5 ml·L-1×2×0.05 L=0.05 ml,不符合题意;C项,50 mL 2 ml·L-1 KCl溶液中的Cl-物质的量为2 ml·L-1×1×0.05 L=0.1 ml,符合题意;D项,100 mL 2 ml·L-1 NaCl溶液中的Cl-物质的量为2 ml·L-1×1×0.1 L=0.2 ml,不符合题意。
【例5】(2023年辽宁省葫芦岛市期中)某溶液中仅含有Na+、Mg2+、SO42-、Cl-四种离子其物质的量浓度之比为c(Na+)∶c(Mg2+)∶c(Cl-)=3∶5∶5,若Na+浓度为3 ml·L-1。则SO42-的浓度为
A.2 ml·L-1B.3 ml·L-1C.4 ml·L-1D.8 ml·L-1
【答案】C
【解析】溶液中c(Na+)∶c(Mg2+)∶c(Cl-)=3∶5∶5,若Na+浓度为3 ml·L-1,则c(Mg2+)=5 ml·L-1,c(Cl-)=5 ml·L-1,根据电荷守恒可知,c(Na+)+2c(Mg2+)=c(Cl-)+2c(SO42-),带入数据3 ml·L-1+2×5 ml·L-1=5 ml·L-1+2×c(SO42-),c(SO42-)=4 ml·L-1,故答案为C项。
04
课堂总结
1.以物质的量为中心的各个化学计量之间的关系
2.阿伏加德罗常数判断
0503
强化训练
1.(2023年河南省南阳市期中)下列溶液中的c(Cl-)与100 mL、1 ml·L-1的AlCl3溶液中的Cl-物质的量浓度相同的是
A.100 mL、1 ml·L-1的NaCl溶液
B.150 mL、2 ml·L-1的NH4Cl溶液
C.100 mL、3 ml·L-1的KClO3溶液
D.50 mL、1.5 ml·L-1的CaCl2溶液
【答案】D
【解析】物质的量浓度与溶液体积无关,1 ml·L-1的AlCl3溶液中的Cl-物质的量浓度为1 ml·L-1×3=3 ml·L-1。
A项,1 ml·L-1的NaCl溶液中的Cl-物质的量浓度为1 ml·L-1×1=1 ml·L-1,不符合题意;B项,2 ml·L-1的NH4Cl溶液中的Cl-物质的量浓度为2 ml·L-1×1=2 ml·L-1,不符合题意;C项,KClO3溶液电离出K+和ClO3-,无Cl-,不符合题意;D项,1.5 ml·L-1的CaCl2溶液中的Cl-物质的量浓度为1.5 ml·L-1×2=3 ml·L-1,符合题意。
2.(2023年北京丰台区期中)将30 mL 0.5 ml·L-1 NaOH溶液加水稀释到300 mL,稀释后溶液中NaOH的物质的量浓度为
A.0.3 ml·L-1B.0.03 ml·L-1
C.0.05 ml·L-1D.0.04 ml·L-1
【答案】C
【解析】根据溶液稀释时溶质的物质的量不变,c= EQ \f(0.5 ml·L-1×30 mL,300 mL)=0.05 ml·L-1,答案为C项。
3.(2023年北京丰台区期中)下列说法中,不正确的是
A.S的摩尔质量是32 g·ml-1
B.1 ml O2的体积一定是22.4 L
C.1 ml N2中含有的分子数约为6.02×1023
D.1 L1 ml·L-1 NaCl溶液中含有1 ml Na+
【答案】B
【解析】A项,S的相对分子质量为32,S的摩尔质量是32 g·ml-1,正确;B项,1 mlO2的体积在标准状况下约是22.4 L,错误;C项,1 ml N2中含有的分子数约为1 ml×NA=6.02×1023,正确;D项,1 L1 ml·L-1 NaCl溶液中含有1 L×1 ml·L-1=1 ml Na+,正确。
4.(2022年福建三明期末)无土培植中,需配制含0.50 ml·L-1 NHeq \\al(+,4)、0.64 ml·L-1 K+、0.66 ml·L-1 Cl-、0.24 ml·L-1 SO42-的营养液。若用KCl、NH4Cl、(NH4)2SO4三种固体配制1 L营养液,需此三种固体的物质的量为
A.AB.BC.CD.D
【答案】C
【解析】需配制含0.50 ml·L-1 NHeq \\al(+,4)、0.64 ml·L-1 K+、0.66 ml·L-1Cl-、0.24 ml·L-1 SO42-的营养液1 L,则需0.50 ml NHeq \\al(+,4)、0.64 ml K+、0.66 ml Cl-、0.24 ml SO42-,故需要KCl的物质的量为0.64 ml,需NH4Cl的物质的量为0.66 ml-0.64 ml=0.02 ml,需(NH4)2SO4的物质的量为0.24 ml;故选C项。
5.(2023年河北省唐山市十县一中联盟上学期期中)下列溶液与20 mL 2 ml·L-1 NaNO3溶液中NO3-物质的量浓度相等的是
A.40 mL l ml·L-1 AgNO3溶液B.10 mL 1 ml·L-1 Mg(NO3)2溶液
C.5 mL 0.4 ml·L-1 Al(NO3)3溶液D.40 mL 0.5 ml·L-1 Cu(NO3)2溶液
【答案】B
【解析】2 ml·L-1 NaNO3溶液中NO3-物质的量浓度为2 ml·L-1。
A项,40 mL l ml·L-1 AgNO3溶液中NO3-物质的量浓度为1 ml·L-1,不符合题意;B项,10 mL 1 ml·L-1 Mg(NO3)2溶液中NO3-物质的量浓度为1 ml·L-1×2=2 ml·L-1,符合题意;C项,5 mL 0.4 ml·L-1 Al(NO3)3溶液中NO3-物质的量浓度为0.4 ml·L-1×3=1.2 ml·L-1,不符合题意;D项,40 mL 0.5 ml·L-1 Cu(NO3)2溶液中NO3-物质的量浓度为0.5 ml·L-1×2=1 ml·L-1,不符合题意。
6.(2023年河北省唐山市十县一中联盟上学期期中)设NA为阿伏加德罗常数的值,下列对0.3 ml·L-1 K2SO4溶液的叙述正确的是
A.1 L该溶液中含有0.3NA个K+
B.1 L该溶液中含有K+和SO42-的总数为0.9NA
C.2 L该溶液中K+的浓度为1.2 ml·L-1
D.将0.3 ml硫酸钾溶于1 L水中,所得硫酸钾溶液的浓度为0.3 ml·L-1
【答案】B
【解析】A项,K2SO4中含有2个钾离子、1个硫酸根离子,则1 L 0.3 ml·L-1 K2SO4溶液中含有0.6NA个K+、0.3NA个SO42-,错误;,B项,含有K+和SO42-的总数为0.9NA,正确;C项,溶液具有均一性和稳定性,故溶液中K的浓度为0.6 ml·L-1,与溶液体积无关,错误;D项,溶于1 L水中配成溶液,溶液体积不是1 L,其浓度不是0.3 ml·L-1,错误。
7.(2023年福建省宁德市上学期期中)某试剂瓶上贴有如图标签,对该试剂理解正确的是
A.该溶液中含有的微粒主要有:NaCl、Na+、Cl-、H2O
B.若取50毫升溶液,其中的c(Cl-)=0.05 ml·L-1
C.若取该溶液与0.1 ml·L-1 AgNO3 100 mL溶液完全反应,需要取该溶液10 mL
D.该溶液与1.0 ml·L-1 Na2SO4溶液的c(Na+)相等
【答案】C
【解析】A项,氯化钠溶于水后完全电离,故溶液中无氯化钠分子,错误;B项,1 ml·L-1的氯化钠溶液中氯离子的浓度为1 ml·L-1,而溶液是均一稳定的,故当取出50 mL时,溶液中氯离子的浓度仍为c(Cl-)=1.0 ml·L-1,错误;C项,100 mL 0.1 ml·L-1 AgNO3溶液中:n(AgNO3)=0.1 ml·L-1×0.1 L=0.01 ml,则需要n(NaCl)=n(AgNO3)=0.01 ml,需要该NaCl溶液的体积为: EQ \f(0.01 ml,1.0 ml·L-1)=0.01L=10 mL,正确;D项,1.0 ml·L-1 NaCl溶液中c(Na+)=1.0 ml·L-1,1.0 ml·L-1 Na2SO4溶液中c(Na+)=1.0 ml·L-1×2=2.0 ml·L-1,错误。
8.(2023年江苏省海门中学期中)4℃时,100 mL水中溶解了33.6 L(STP)HCl气体,所得盐酸密度为1.18 g·mL﹣1。下列有关说法不正确的是
A.该盐酸的物质的量浓度为15 ml·L-1
B.该盐酸溶质的质量分数为35.4%
C.该温度下HCl的溶解度可能大于336(气体溶解度以体积比计算)
D.相同条件下,一定量水中溶解HCl气体越多,所得盐酸密度越大
【答案】A
【解析】标准状况下33.6 L HCl的物质的量为: EQ \f(33.6 L,22.4 L·ml-1)=1.5 ml,m(HCl)=1.5 ml×36.5 g·ml-1=54.75 g;所得盐酸密度为1.18 g·mL-1,故所得盐酸的体积为 EQ \f(54.75 g+100 g,1.18 g·mL-1)=131 mL。
A项,该盐酸的物质的量浓度为 EQ \f(1.5 ml,0.131 L)=11.45 ml·L-1,不正确;B项,该盐酸溶质的质量分数为 EQ \f(54.75 g,54.75 g+100 g)×100%=35.4%,正确;C项,常温下HCl的溶解度是1∶500,气体溶解度随温度降低而增大,故该温度下HCl的溶解度可能大于336(气体溶解度以体积比计算),正确;D项,盐酸密度大于水,相同条件下,一定量水中溶解HCl气体越多,所得盐酸密度越大,正确。
9.(2023年河南省南阳市期中)把100 g密度为1.22 g·mL-1的NaOH溶液蒸发浓缩,当余下溶液50 mL时,其物质的量浓度为8 ml·L-1,(蒸发时无固体析出),则原溶液浓度为
①2.44 ml·L-1 ②4% ③4.88 ml·L-1 ④16%
A.③④B.②③C.①②D.①④
【答案】A
【解析】由题意知,溶质不变,则溶液中溶质的质量m(NaOH)=8 ml·L-1×0.05 L×40 g·ml-1=16 g,原来溶液的质量分数ω= EQ \f(16 g,100 g)×100%=16%,原来NaOH溶液的c= EQ \f(1 000ρw,M)= EQ \f(1 000 mL·L-1×1.22 g·mL-1×16%,40 g·ml-1)=4.88 ml·L-1,即③④正确,A选项符合题意。
10.(2023年河北省唐山市十县一中联盟上学期期中)实验室为确定一瓶稀硫酸的浓度,用0.20 ml·L-1 NaOH溶液中和50.00 mL该稀硫酸,当酸与碱恰好完全反应时,消耗NaOH溶液50.00 mL,下列说法正确的是
A.该硫酸的物质的量浓度为0.10 ml·L-1
B.该硫酸的物质的量浓度为0.20 ml·L-1
C.在最终得到的溶液中,SO42-的物质的量为0.01 ml
D.在最终得到的溶液中,Na+的物质的量浓度仍为0.20 ml·L-1
【答案】A
【解析】用0.2 ml·L-1 NaOH溶液中和50.00 mL该稀硫酸,当酸与碱恰好完全反应时,消耗NaOH溶液50.00 mL,NaOH的物质的量为0.20 ml·L-1×0.05 L=0.01 ml,根据反应方程式2NaOH+H2SO4=Na2SO4+2H2O,可知稀硫酸的物质的量为0.005 ml,故稀硫酸的物质的量浓度为 EQ \f(0.005 ml,0.05 L)=0.10 ml·L-1。
A项,由分析知,该硫酸的物质的量浓度为0.10 ml·L-1,正确;B项,由分析知,该硫酸的物质的量浓度为0.10 ml·L-1,错误;C项,在最终得到的溶液中,SO42-的物质的量为0.005 ml,错误;D项,NaOH溶液中,Na+的物质的量浓度为0.10 ml·L-1,在最终得到的溶液中,混合溶液体积加倍,Na+的物质的量浓度为0.050 ml·L-1,错误。
1.了解物质的量浓度的含义和应用,能计算有关粒子的物质的量浓度。
2.能运用物质的量、摩尔质量、气体摩尔体积、物质的量浓度之间的相互关系进行简单计算。
分析项目
检测结果
单位
参考范围
锌
115.92
μml/L
66~120
铁
7.95
mml/L
7.52~11.82
钙
0.68
mml/L
1.55~2.10
血糖
5.0
mml/L
3.61~6.11
类型
方法
举例
单一溶质溶液
根据电离方程式或组成规律计算
K2SO4溶液中:c(K+)=2c(SOeq \\al(2-,4))=2c(K2SO4)
混合溶液
电荷守恒计算
(原理:电解质溶液呈电中性——溶质所有阳离子带正电荷总数与阴离子带负电荷总数相等)
Na2SO4、NaCl混合溶液中, c(Na+)、c(Cl-)分别为7 ml·L-1、3 ml·L-1,由c(Na+)=2c(SOeq \\al(2-,4))+c(Cl-),则c(SOeq \\al(2-,4))=eq \f(7-3,2) ml·L-1=2 ml·L-1。
溶液稀释
溶质的质量不变:m(浓)·w1(浓)=m2(稀)·w2(稀)
溶质的物质的量不变:c(浓)·V(浓)=c(稀)·V(稀)
溶液混合
溶质的质量不变:m1w1+m2w2=m(混)·w(混)
溶质的物质的量不变:c1V1+c2V2=c(混)·V(混)
已知气体的体积
c= EQ \f( EQ \f(V(气体),22.4),V(溶液))
V L(标准状况下)气体溶于1 L水中所得溶液的密度为ρ g·cm-3
(假定气体的摩尔质量为M g·ml-1)
V=eq \f(\f(V,22.4) ml×M g·ml-1+1 000 g,ρ g·cm-3)×1×10-3 L·mL-1=eq \f(M V+22 400,22 400ρ) L
c=eq \f(\f(V,22.4) ml,\f(MV+22 400,22 400ρ) L)=eq \f(1 000ρV,22 400+MV) ml·L-1
解题关键
把所给的各种量转化为物质的量,再求出1 ml指定物质中所含指定微粒数目
审题
如求微粒数时,是否包括溶剂水;在给出某物质的浓度时,有无告诉其体积
常设陷阱
(1)状况条件:若给出非标准状况,如已知常温常压下气体的体积,不能用22.4 L·ml-1进行计算。
(2)物质状态:已知在标准状况下非气态的物质(如水、酒精、三氧化硫等),不能用22.4 L·ml-1进行计算。
(3)单质组成:气体单质的组成除常见的双原子外,还有单原子分子(如He、Ne等)、多原子分子(如O3等)。
(4)粒子种类:粒子种类一般有分子、原子、离子、质子、中子、电子等。解答时要看准题目要求。
A
B
C
D
KCl
0.64 ml
0.40 ml
0.64 ml
0.64 ml
NH4Cl
0.05 ml
0.05 ml
0.02 ml
0.03 ml
(NH4)2SO4
0.24 ml
0.12 ml
0.24 ml
0.24 ml
1.0 ml·L-1 NaCl溶液
相关学案
这是一份人教版 (2019)必修 第一册第三节 物质的量优秀学案,共8页。学案主要包含了学习目标,学习重点,学习难点,课前预习,课中探究,答案要点,对应练习,课后巩固等内容,欢迎下载使用。
这是一份(人教版)新高一化学暑假衔接第12讲 物质的量浓度的相关计算(学生版+教师版)讲义,文件包含人教版新高一化学暑假衔接第12讲物质的量浓度的相关计算教师版docx、人教版新高一化学暑假衔接第12讲物质的量浓度的相关计算学生版docx等2份学案配套教学资源,其中学案共23页, 欢迎下载使用。
这是一份人教版 (2019)必修 第一册第二章 海水中的重要元素——钠和氯第三节 物质的量导学案,共14页。学案主要包含了容量瓶,溶液的配制步骤等内容,欢迎下载使用。









