


所属成套资源:2024年高中化学同步精品讲义(人教版必修一)
高中化学人教版 (2019)必修 第一册第一节 钠及其化合物学案
展开
这是一份高中化学人教版 (2019)必修 第一册第一节 钠及其化合物学案,文件包含第09讲21活泼的金属单质钠教师版-2024年高中化学同步精品讲义必修一docx、第09讲21活泼的金属单质钠学生版-2024年高中化学同步精品讲义必修一docx等2份学案配套教学资源,其中学案共21页, 欢迎下载使用。
02
预习导学
自主梳理
一.钠的原子结构
原子结构示意图为eq \a\vs4\al(),最外层上只有1个电子。
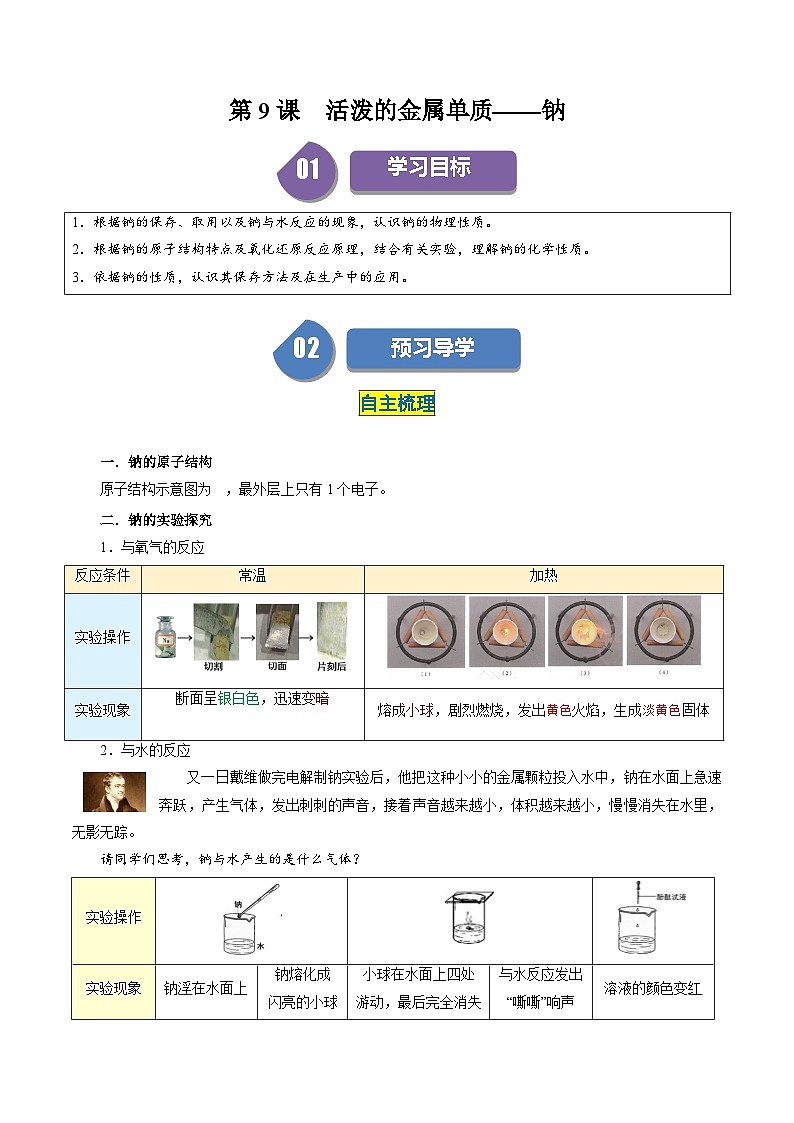
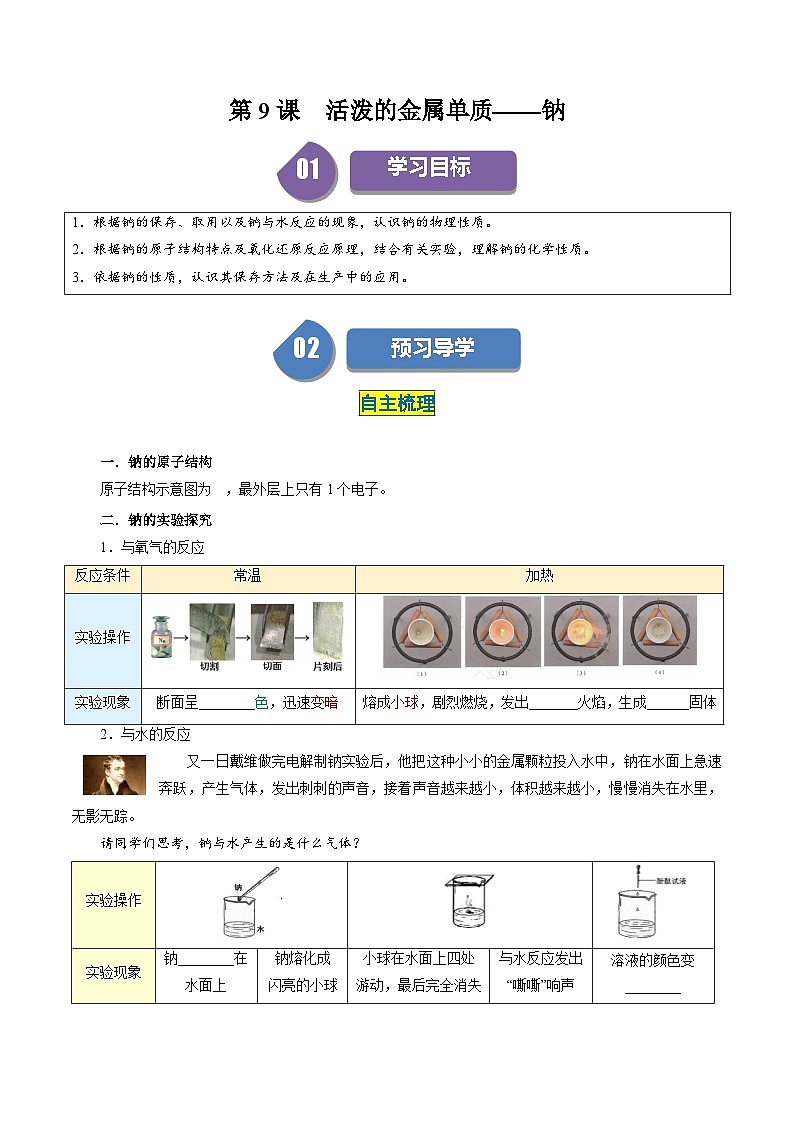
二.钠的实验探究
1.与氧气的反应
2.与水的反应
又一日戴维做完电解制钠实验后,他把这种小小的金属颗粒投入水中,钠在水面上急速奔跃,产生气体,发出刺刺的声音,接着声音越来越小,体积越来越小,慢慢消失在水里,无影无踪。
请同学们思考,钠与水产生的是什么气体?
1.钠在反应中很容易失去最外层上的电子,故钠的化学性质非常活泼,表现出很强的____________。
2.钠在常温及加热条件下,分别与氧反应的化学方程式为_________________、____________________。
3.钠与水反应的化学方程式为__________________________。
预习检测
1.(2022年北京市丰台区期中)钠的下列性质中与钠和水反应时的现象无关的是
A.钠的熔点较低B.钠的密度小于水的
C.钠能导电D.钠金属活动性强
2.(2022年北京丰台期末)下列关于金属钠的描述不正确的是
A.有银白色金属光泽B.密度小于水
C.具有很强的还原性D.在空气中燃烧只生成氧化钠
3.(2023年山东省菏泽市期中改编)下列说法错误的是
A.Na2O2是淡黄色固体,由Na+与O22-构成
B.金属钠与氧气反应,条件不同,产物不同
C.金属钠投入水中,生成NaOH,同时放出O2
D.少量的钠可保存在煤油中,实验剩余的钠需放回原试剂瓶
4.(2022年浙江衢州期末)下列物质中,常温下不能与金属钠反应的是
A.煤油B.水C.稀硫酸D.氯气
5.(2022·甘肃兰州第四片区期末)将一块金属钠投入滴有紫色石蕊溶液的盛冷水的烧杯中,甲同学认为可观察到下列现象,其中正确的有
①钠投入水中,先沉入水底,后浮出水面 ②钠立即与水反应,并有气体产生 ③反应后溶液变红 ④钠熔成闪亮的小球 ⑤小球在水面上四处游动 ⑥有“嘶嘶”的响声发出
A.①②③④B.②③④⑤C.②④⑤⑥D.③④⑥
6.(2023年山东省菏泽市期中)钠及其化合物在生产、生活中有着重要的应用。
钠是一种银白色的金属,取2.3 g钠块在干燥空气中放置一段时间后,其表面会失去金属光泽生成Na2O,此时固体质量为2.46 g,则原钠块中已被氧化的钠为_______g;再将该钠块在干燥空气中充分加热,会得到浅黄色的_______(填化学式)粉末;经过上述两步实验后,最终得到的粉末的质量应为_______g。
►环节一 钠的物理性质和化学性质
情境材料
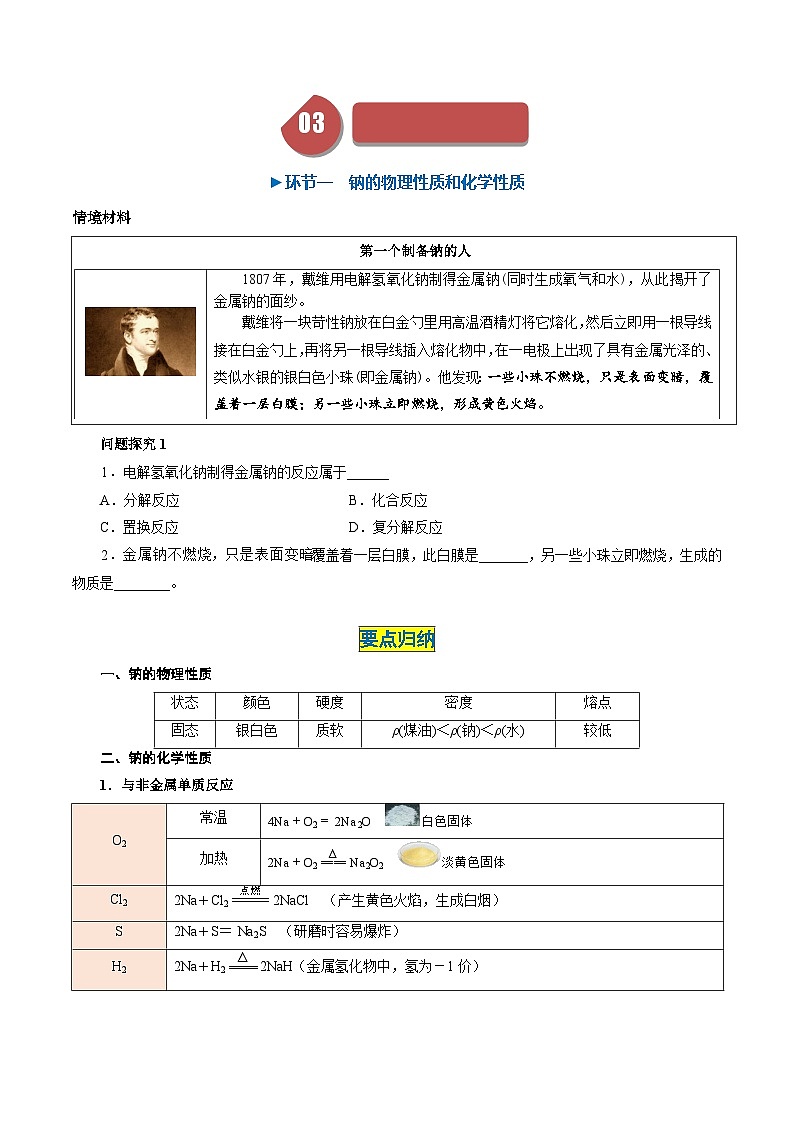
第一个制备钠的人
1807年,戴维用电解氢氧化钠制得金属钠(同时生成氧气和水),从此揭开了金属钠的面纱。
戴维将一块苛性钠放在白金勺里用高温酒精灯将它熔化,然后立即用一根导线接在白金勺上,再将另一根导线插入熔化物中,在一电极上出现了具有金属光泽的、类似水银的银白色小珠(即金属钠)。他发现:一些小珠不燃烧,只是表面变暗,覆盖着一层白膜;另一些小珠立即燃烧,形成黄色火焰。
问题探究1
1.电解氢氧化钠制得金属钠的反应属于______
A.分解反应B.化合反应
C.置换反应D.复分解反应
2.金属钠不燃烧,只是表面变暗覆盖着一层白膜,此白膜是_______,另一些小珠立即燃烧,生成的物质是________。
要点归纳
一、钠的物理性质
二、钠的化学性质
1.与非金属单质反应
钠露置在空气中的变化
(1)金属钠长期露置于空气中最终完全转变为Na2CO3粉末,此过程中的主要变化与现象有:
eq \x(\a\al(银白色金,属钠(Na)))eq \(――→,\s\up7(O2),\s\d5(①))eq \x(\a\al( 表面变暗,(生成Na2O)))eq \(――→,\s\up7(H2O),\s\d5(②))eq \x(\a\al(出现白色固体,(生成NaOH)))eq \(――→,\s\up7(H2O),\s\d5(③))eq \x(\a\al(表面变成溶液,(NaOH潮解)))eq \(――→,\s\up7(CO2),\s\d5(④))eq \x(\a\al( 白色块状物质,(生成Na2CO3·10H2O)))eq \(――→,\s\up7(风化),\s\d5(⑤))eq \x(\a\al(白色粉末状物质,(生成Na2CO3)))
(2)发生的主要变化的化学方程式
①4Na+O2=2Na2O;②Na2O+H2O=2NaOH;④2NaOH+CO2=Na2CO3+H2O,Na2CO3+10H2O=Na2CO3·10H2O;⑤Na2CO3·10H2O=Na2CO3+10H2O。
2.与水反应
化学方程式:2Na+2H2O=2NaOH+H2↑,还原剂:Na,氧化剂:H2O。
离子方程式:2Na+2H2O=2Na++2OH-+H2↑
(1)金属钠与水的反应,其实质是钠与水电离出的H+反应。
(2)切割完钠块后,剩余的钠的处理:放入原来盛有煤油的试剂瓶中(钠的活泼性非常强,易与水或氧气反应造成失火或爆炸,为保证实验安全,放回原试剂瓶比较稳妥)。
(3)做实验时,金属钠不慎失火的处理:用干燥的沙土来灭火,不能用水灭火(钠与水剧烈反应且生成氢气,会放出大量的热,甚至能引起氢气燃烧爆炸)。
(1)钠与酸的反应
如果钠过量,钠把酸耗尽后,再与水反应。
a.钠先与酸中的H+反应(不是与水先反应),离子方程式:2Na+2H+=2Na++H2↑。
b.如果钠过量,钠把酸消耗尽之后,再与水反应。
(2)钠与盐溶液的反应
a.钠与盐溶液反应时,首先与水反应生成NaOH(不是与盐先发生置换反应)。
b.然后NaOH与盐发生复分解反应(若氢氧化钠不与盐反应,则只有钠与水的反应)。
例如:Na与Fe2(SO4)3溶液的反应:2Na+2H2O=2NaOH+H2↑,6NaOH+Fe2(SO4)3=2Fe(OH)3↓+3Na2SO4;Na与KNO3溶液的反应:2Na+2H2O=2NaOH+H2↑(仅此一步反应),若是饱和盐溶液,会有晶体析出。
(3)钠与熔融盐的反应
4Na+TiCl4eq \(====,\s\up7(高温))Ti+4NaCl Na+KCleq \(====,\s\up7(高温))K↑+NaCl
典例精讲
【例1】(2022年湖北省宜昌市期中)下列关于金属钠的叙述,正确的是
A.钠在空气中燃烧,发出黄色火焰
B.钠在空气中燃烧,产物是Na2O
C.钠是银白色金属,硬度大,熔点高
D.钠的化学性质比铁、铝活泼得多,但没有镁活泼
【例2】(2022年四川广安期末)将绿豆大的钠块投入如图所示的烧杯中,可能出现的现象是
A.钠块只在煤油层中游动,并放出气体
B.钠块只在水层中游动,钠块熔化,水层变红
C.钠块在煤油、水两液体界面处反应,熔化成小球并上下跳动,水层变红
D.钠块在四氯化碳、水两液体界面处反应,熔化成小球并上下跳动,水层变红
【例3】(2022年湖北省宜昌市期中)将绿豆大小的钠投入CuSO4溶液中,下列有关现象的描述不正确的是
A.Na浮在水面,四处游动B.有红色固体生成
C.有蓝色沉淀生成D.溶液颜色变浅
►环节二 钠的保存与应用
情境材料
戴维在制备了钠后,如何保存呢?他把钠放入水中不行——它浮于水面,并在水中迅速游动,金属和水反应后的表面产生大量的气体,并立刻融化成一个闪亮的小球,并逐渐缩小,最后完全消失。放入酒精中也发生反应,生成H2。他尝试了多种液体,发现钠对煤油冷淡,因此至今人们把钠保存于煤油中。
问题探究2
1.写出钠与水反应的离子方程式________________________________________。
2.能否把钠保存在汽油或四氯化碳中?
要点归纳
二、钠的保存与应用
1.保存
(1)工业:大量的钠要用石蜡或者其他物质封存,保存于铁桶内,充氩气密封
(2)实验室:煤油或石蜡里
2.应用
典例精讲
【例4】(2022年湖北省孝感市期中)下列关于钠的说法中不正确的是
A.金属钠和氧气反应,条件不同,产物不同
B.若钠着火,不可以用水灭火
C.绿豆大小的钠投入水中,钠浮在水面上,说明钠的密度小于水的密度
D.做完实验多余的钠不能放回原来的试剂瓶
【例5】(2022年江苏连云港东海县期中改编)钛合金是具有耐压耐腐蚀性质的重要金属材料,反应4Na+TiCl4eq \(====,\s\up7(高温))4NaCl+Ti可以制取金属钛.下列说法不正确的是
A.TiCl4中的化合价:+4
B.的电离方程式:NaCl=Na++Cl-
C.该反应也可在水中完成
D.原子在反应中容易得到1个电子生成Na+
04
课堂总结
0503
强化训练
1.(2022年北京顺义期末)下列关于钠说法不正确的是
A.钠的密度比水小,比煤油大
B.钠失火时,应该用沙土盖灭
C.钠与水反应的离子方程式为:Na+H2O=Na++OH-+H2↑
D.钠在空气中燃烧,发出黄色火焰,生成淡黄色的Na2O2
2.(2022年四川自贡期末)下列实验操作过程中,观察不到金属Na光亮银白色的是
A.取出长期保存在煤油中的NaB.Na投入水中
C.用小刀将Na切开D.Na在空气中加热
3.(2022年北京市第四中学期中)向分别盛有100 mL水、100 mL稀盐酸、100 mL稀NaOH溶液的X、Y、Z三个烧杯中各投入0.5 g Na。下列有关说法正确的是
A.三个烧杯中均先发生的离子反应为2Na+2H2O=2Na++2OH-+H2↑
B.三个烧杯中钠均在液面上剧烈反应,且X烧杯中的反应最剧烈
C.三个烧杯反应后,溶质的质量分数相同
D.三个烧杯反应后,生成的气体的质量一定相同
4.(2023年广东省佛山市南海区)将绿豆大小的金属钠(Na)放入CuSO4溶液中,钠迅速熔成小球,在液面上游动,发出嘶嘶的声音(查资料表明产生了H2),产生蓝色沉淀。根据现象推理正确的是
A.Na的密度比铁高B.金属钠比铁更容易与盐酸反应
C.钠的熔点比铁高D.金属钠能在CuSO4溶液中置换出铜
5.(2023学年江苏苏州上学期期中)下列有关金属钠的说法中,不正确的是
A.钠只有在加热条件下才能与氯气反应
B.钠在化学反应中易失去电子,表现出还原性
C.实验室中少量金属钠保存在煤油中
D.钠钾合金熔点低,导热性好,可用作快中子反应堆的热交换剂
6.(2022年河北省保定市定州市期中)下列有关钠的叙述中,不正确的是
A.金属钠是银白色金属,硬度小,钠切开的断面露置在空气中变暗,是因为生成了Na2O
B.钠元素在自然界中主要以化合物形式存在
C.将一小块钠投入到CuSO4溶液中,有红色固体Cu析出
D.少量金属钠可保存在煤油中,使用后剩余的钠必须放回原试剂瓶中
7.(2022年吉林省吉林市期末)将适量钠投入下列溶液中,既能产生气体又能生成白色沉淀的是
A.硫酸铜溶液B.稀硫酸
C.氯化镁溶液D.氯化钠溶液
8.(2022年山西省怀仁市期中)下列说法中一定正确的是
A.Na2O2固体中阳离子与阴离子的个数比为1∶1
B.从试剂瓶中取出并切下未使用的钠可放回原试剂瓶中
C.将Na投入饱和Na2CO3溶液中,会导致溶液质量增加
D.金属Na失火,可用CO2灭火
9.(2022年河南三门峡期末)按如图所示进行相应实验(硫酸铜溶液显弱酸性),下列有关它们反应现象的分析正确的是
A.均有可燃性气体生成
B.反应剧烈程度:甲>乙>丙
C.丙中钠能置换出单质铜
D.乙、丙中钠在液面下反应
10.(2023年福建省宁德市上学期期中)金属钠及化合物生产、生活用途广泛。请回答下列有关问题:
(1)保存金属钠的正确方法是_______(填标号)。
A.放在棕色瓶中B.放在细沙中C.放在水中D.放在煤油中
(2)将一小块钠放在水平放置的试管中部,用酒精灯加热充分反应如下图所示,请写出该反应的化学方程式_____________________,生成物的颜色为_______。
(3)Na、NaOH久置空气中最终都是转变为_________(填化学式)。
(4)金属钠可用于生产汽车安全气囊中的气体发生剂NaN3。某汽车安全气囊中含NaN3、Fe2O3和NaHCO3等物质。
①当汽车发生较严重的碰撞时,NaN3受热分解为Na和N2,其化学方程式为____________________。
②气囊中产生的Na立即与Fe2O3反应生成Na2O与另一种单质,该反应属于四种基本反应类型中的_________反应。
③NaHCO3是冷却剂,分解时会吸收产气过程释放的热量。1.根据钠的保存、取用以及钠与水反应的现象,认识钠的物理性质。
2.根据钠的原子结构特点及氧化还原反应原理,结合有关实验,理解钠的化学性质。
3.依据钠的性质,认识其保存方法及在生产中的应用。
反应条件
常温
加热
实验操作
→→→
实验现象
断面呈________色,迅速变暗
熔成小球,剧烈燃烧,发出_______火焰,生成______固体
实验操作
实验现象
钠________在水面上
钠熔化成
闪亮的小球
小球在水面上四处
游动,最后完全消失
与水反应发出“嘶嘶”响声
溶液的颜色变________
原因解释
钠的密度
比水________
钠熔点___,反应放热
反应产生的_______
推动小球运动
钠与水
反应剧烈
反应生成________
状态
颜色
硬度
密度
熔点
固态
银白色
质软
ρ(煤油)<ρ(钠)<ρ(水)
较低
O2
常温
4Na+O2=2Na2O 白色固体
加热
2Na+O2eq \(====,\s\up6(Δ))Na2O2 淡黄色固体
Cl2
2Na+Cl2eq \(=====,\s\up7(点燃))2NaCl (产生黄色火焰,生成白烟)
S
2Na+S=Na2S (研磨时容易爆炸)
H2
2Na+H2eq \(====,\s\up6(Δ))2NaH(金属氢化物中,氢为-1价)
金属钠是在1807年通过电解氢氧化钠制得的,这个原理应用于工业生产,约在1891年才获得成功。1921年实现了电解氯化钠制钠的工业方法,其反应原理是:2NaCl(熔融)eq \(=====,\s\up7(通电))2Na+Cl2↑。
目前,世界上钠的工业生产多数是用电解氯化钠的方法,少数仍沿用电解氢氧化钠的方法。
相关学案
这是一份人教版 (2019)必修 第一册第一节 钠及其化合物优秀学案及答案,共10页。学案主要包含了学习目标,学习重点,学习难点,课前预习,课中探究,答案要点,实验2-1,对应训练等内容,欢迎下载使用。
这是一份【暑假初升高】人教版化学初三(升高一)暑假预习-第06讲 活泼的金属单质——钠 讲学案,文件包含暑假初升高人教版化学初三升高一暑假预习-第06讲活泼的金属单质钠解析版docx、暑假初升高人教版化学初三升高一暑假预习-第06讲活泼的金属单质钠原卷版docx等2份学案配套教学资源,其中学案共20页, 欢迎下载使用。
这是一份第06讲 活泼的金属单质——钠-【暑假自学课】2022年高一化学暑假精品课(人教版),文件包含第06讲活泼的金属单质钠-暑假自学课2022年高一化学暑假精品课人教版解析版docx、第06讲活泼的金属单质钠-暑假自学课2022年高一化学暑假精品课人教版原卷版docx等2份学案配套教学资源,其中学案共22页, 欢迎下载使用。