



高中人教版 (2019)第二节 氯及其化合物导学案
展开01
学习目标
02
预习导学
自主梳理
一、氯气与金属、非金属单质的反应
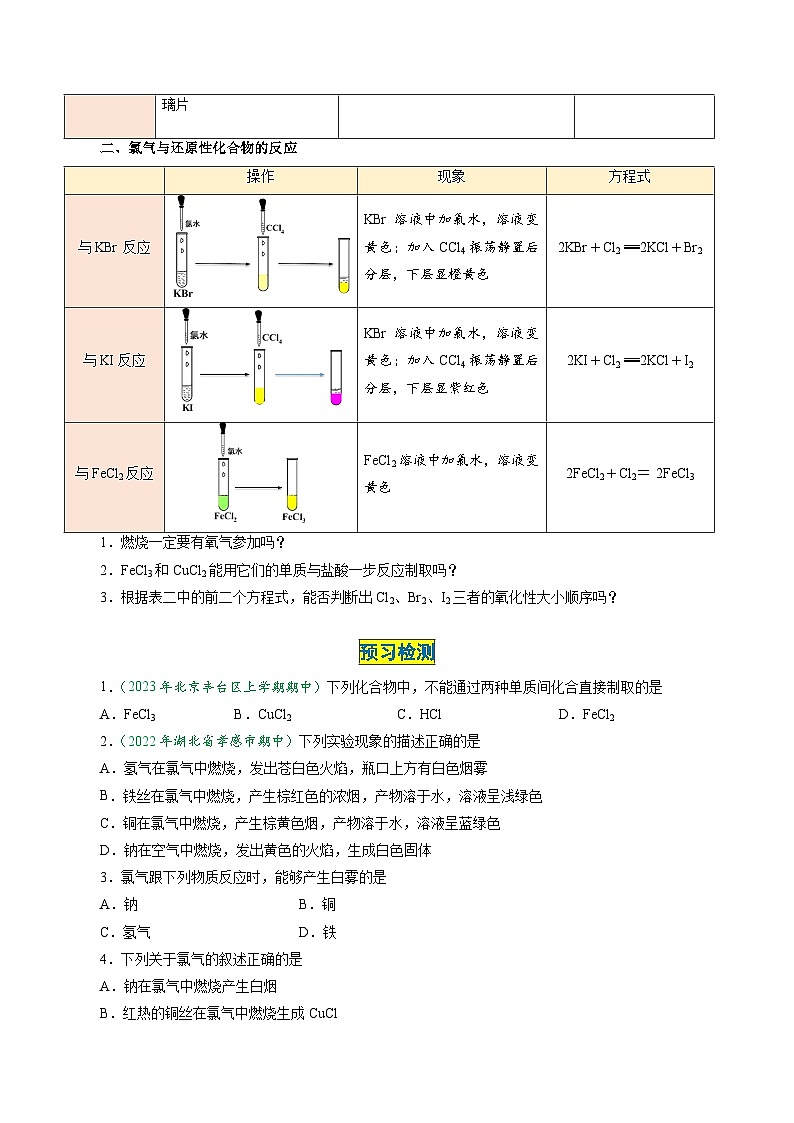
二、氯气与还原性化合物的反应
1.燃烧一定要有氧气参加吗?
2.FeCl3和CuCl2能用它们的单质与盐酸一步反应制取吗?
3.根据表二中的前二个方程式,能否判断出Cl2、Br2、I2三者的氧化性大小顺序吗?
1.燃烧是指任何剧烈的发光发热的化学反应,不一定要有氧气参加。
2.不能。Fe与盐酸反应生成的是FeCl2,Cu与盐酸不反应。FeCl3和CuCl2可以用Fe、Cu与Cl2一步步反应制取。
4.据2KBr+Cl2=2KCl+Br2,可知氧化性:Cl2>Br2;据2KI+Cl2=2KCl+I2,可知氧化性:Cl2>I2,无法判断出Br2与I2的氧化性强弱。
预习检测
1.(2023年北京丰台区上学期期中)下列化合物中,不能通过两种单质间化合直接制取的是
A.FeCl3B.CuCl2C.HClD.FeCl2
【答案】D
【解析】A项,Fe和氯气点燃时直接化合生成FeCl3,正确;B项,Cu与氯气常温下能直接化合生成CuCl2,正确;C项,氢气与氯气在点燃时能直接化合生成HCl,正确;D项,Fe和氯气点燃时直接化合生成FeCl3,不能直接由单质间化合制取FeCl2,错误。
2.(2022年湖北省孝感市期中)下列实验现象的描述正确的是
A.氢气在氯气中燃烧,发出苍白色火焰,瓶口上方有白色烟雾
B.铁丝在氯气中燃烧,产生棕红色的浓烟,产物溶于水,溶液呈浅绿色
C.铜在氯气中燃烧,产生棕黄色烟,产物溶于水,溶液呈蓝绿色
D.钠在空气中燃烧,发出黄色的火焰,生成白色固体
【答案】C
【解析】A项,氢气在氯气中燃烧,发出苍白色火焰,瓶口上方有白雾,错误;B项,铁丝在氯气中燃烧,产生棕褐色的浓烟,产物FeCl3溶于水,溶液呈黄色,错误;C项,铜在氯气中燃烧,产生棕黄色烟,产物CuCl2溶于水,溶液呈蓝绿色,正确;D项,钠在空气中燃烧,发出黄色的火焰,生成淡黄色固体,错误。
3.氯气跟下列物质反应时,能够产生白雾的是
A.钠B.铜
C.氢气D.铁
【答案】C
【解析】A项,钠与氯气反应生成固体氯化钠,会观察到白烟,错误;B项,铜与氯气反应生成固体氯化铜,会观察到棕黄色的烟,错误;C项,氢气与氯气反应生成氯化氢,氯化氢极易结合水蒸气变为盐酸小液滴,会观察到白雾,正确;D项,铁与氯气反应生成固体氯化铁,会观察到棕褐色的烟,错误。
4.下列关于氯气的叙述正确的是
A.钠在氯气中燃烧产生白烟
B.红热的铜丝在氯气中燃烧生成CuCl
C.纯净的氢气可以在氯气中安静地燃烧,发出淡蓝色火焰
D.氯气的水溶液可以导电,说明氯气是电解质
【答案】A
【解析】A项,钠在氯气中燃烧,生成NaCl固体小颗粒,形成白烟,正确;B项,红热的铜丝在氯气中燃烧生成CuCl2,错误;C项,氢气在氯气中燃烧,发出苍白色火焰,错误;D项,Cl2是单质,既不是电解质,也不是非电解质,错误。
5.(2022年河北省张家口市期中)某化学教师为“氯气与金属钠反应”设计了如图装置的实验(夹持、加热装置已略),实验操作:先给钠预热,等钠熔融成圆球时,撤火,通入氯气,即可见钠着火燃烧,生成大量白烟。以下叙述错误的是
A.反应生成大量白烟的化学方程式为2Na+Cl2eq \(====,\s\up6(Δ))2NaCl
B.塞一团浸有碱液的棉球是用于吸收过量的氯气,以免其污染空气
C.钠熔点高,所以先预热再反应
D.可据浸有石蕊溶液的棉花球的颜色变化判断氯气是否被碱液完全吸收
【答案】A
【解析】A项,钠与氯气反应产生的白烟是NaCl,其反应式为2Na+Cl2eq \(====,\s\up6(Δ))2NaCl,正确;B项,Cl2与碱溶液发生反应:Cl2+2OH-=Cl-+ClO-+H2O,浸有碱液的棉球可吸收Cl2,从而避免Cl2污染空气,正确;C项,钠与氯气反应需预热,与钠的熔点高低无关,事实上钠的熔点较低,错误;D项,少量氯气遇石蕊溶液的棉花球,变红色,岀说明氯气是否被碱液完全吸收,正确。
6.下列氯化物中,既能由金属和Cl2直接化合制得,又能由金属和盐酸反应制得的是
A.CuCl2B.MgCl2
C.FeCl2D.FeCl3
【答案】B
【解析】A项,CuCl2可以由Cu与Cl2化合制得,不能由Cu和盐酸反应制得,不符合题意;B项,MgCl2可以由Mg与Cl2化合制得,也可以由Mg和盐酸反应制得,符合题意;Fe和Cl2化合生成FeCl3,Fe和盐酸反应生成FeCl2,C、D项均不符合题意。
►环节一 氯气与金属、非金属金属的反应
情境材料
工业制盐酸生产流程及其使用的燃烧管如下图如示:
工业制盐酸使用的燃烧管
问题探究
对于工业制盐酸使用的燃烧管:
(1)A处通的气体是_______。
(2)B处通的气体是_______。
(3)氢气与氯气先通的气体是_______。
(1)H2 (2)Cl2 (3)H2
要点归纳
一、氯气与金属、非金属的反应
1.与金属的反应
(1)氯气具有很强的氧化性,能与大多数金属反应(Pt、Au除外)。
(2)与变价金属(如Fe、Cu)反应生成高价金属氯化物(FeCl3、CuCl2)。
常温下,铁与液态氯不反应。Fe与Cl2反应时,不论Cl2是否过量,均生成FeCl3而不是FeCl2。
2.与非金属的反应
Cl2除了能与H2化合,还可跟P、S、Si等非金属直接化合,都体现了Cl2的氧化性。如:
2Cl2+Sieq \(====,\s\up6(Δ))SiCl4
①燃烧是指发热、发光、剧烈的氧化还原反应,反应中并不一定要有氧气参加。
②描述现象时,固体小颗粒,分散在空气中形成烟;液体小液滴,分散在空气中形成雾。
典例精讲
【例1】(2022年江苏省扬州市扬州中学期中)下列说法错误的是
A.钠和铁一样都能在氯气中燃烧生成金属氯化物
B.液氯是氯气的水溶液,它能使干燥的有色布条褪色
C.氯气可以和氢气燃烧,产生苍白色火焰
D.氯水具有杀菌、漂白作用是因为氯水中含有强氧化性的次氯酸
【答案】B
【解析】A项,钠和铁一样,都能在氯气中燃烧生成金属氯化物,正确;B项,液氯是液态的氯气,氯气无漂白性,不能使干燥的有色布条褪色,错误;C项,氯气可以和氢气燃烧,产生苍白色火焰,正确;D项,氯水具有杀菌、漂白作用是因为氯水中含有强氧化性的次氯酸,正确。
【例2】(2023年河南省南阳市期中)如图所示钠、镁、铝、铁分别跟足量的氯气反应时,消耗金属的质量与反应的氯气的质量之间的关系,其中表示铝与氯气反应的是
A.aB.bC.cD.d
【答案】D
【解析】由图可知,当消耗相同质量的氯气时,消耗金属的质量的大小关系是:a>b>c>d。再由反应的方程式:2Na+Cl2eq \(====,\s\up7(点燃),\s\d5())2NaCl、Mg+Cl2eq \(====,\s\up7(点燃),\s\d5())MgCl2、2Al+3Cl2eq \(====,\s\up7(点燃),\s\d5())2AlCl3、2Fe+3Cl2eq \(====,\s\up7(点燃),\s\d5())2FeCl3可知,消耗相同量的氯气时存在如下关系式:6Na~3Mg~2Al~2Fe~3Cl2,即消耗213g Cl2时,消耗金属的质量分别为:m(Na)=138 g,m(Mg)=72 g,m(Al)=54 g,m(Fe)=112 g,即m(Na)>m(Fe)>m(Mg)>m(Al),所以d表示铝与氯气反应,D项符合题意。
【例3】已知I2遇淀粉变蓝色。“绿色化学实验”进课堂,某化学教师为氯气与金属钠反应设计了如图装置与操作以替代相关的实验。实验操作:钠与氯气反应的装置作如图改进,将一根玻璃管与氯气发生器相连,玻璃管内放一块黄豆粒大的金属钠(已吸净煤油),玻璃管尾部塞一团浸有NaOH溶液的棉花球。先给钠预热,到钠熔融成圆球时,撤火,通入氯气,即可见钠着火燃烧,生成大量白烟。以下叙述错误的是
A.反应生成的大量白烟是氯化钠晶体
B.玻璃管尾部塞一团浸有NaOH溶液的棉球是用于吸收过量的氯气,以免其污染空气
C.钠着火燃烧产生苍白色火焰
D.若在棉球外沿滴一滴淀粉碘化钾溶液,据其颜色变化判断氯气是否被碱液完全吸收
【答案】C
【解析】A项,根据题给信息,Na在Cl2中燃烧的化学方程式为2Na+Cl2eq \(====,\s\up6(Δ))2NaCl,NaCl为固态,故产生大量白烟,正确;B项,Cl2可与NaOH反应,故用NaOH溶液可吸收剩余Cl2,防止污染空气,正确;C项,Na着火燃烧时火焰颜色为黄色,错误;D项,因为Cl2可与KI发生反应Cl2+2KI=2KCl+I2,I2使淀粉变蓝,正确。
►环节二 氯气与还原性化合物的反应
情境材料
高铁酸钠(Na2FeO4)是新型的绿色消毒剂,主要用于饮用水处理。高铁酸钠具有很强的氧化性,溶于水中能释放大量的氧原子,从而非常有效地杀灭水中的病菌和病毒。与此同时,自身被还原成新生态的Fe(OH)3,这是一种品质优良的无机絮凝剂,能高效地除去水中的微细悬浮物。实验证明,由于其强烈的氧化和絮凝的作用,高铁酸盐的消毒和除污效果,全面优于含氯消毒剂和高锰酸盐。更为重要的是它在整个对水的消毒和净化过程中,不会产生任何对人体有害的物质,因此高铁酸盐被科学家们公认为绿色消毒剂。
它的制备是用硝酸铁、氢氧化钠和氯气共同反应制得的。
问题探究
1.高铁酸钠(Na2FeO4)属于____(填“酸、碱、盐或氧化物”),Na2FeO4中Fe的化合价是_____。
2.请完成下列方程式并配平:
___Fe(NO3)3+___NaOH+___Cl2=___Na2FeO4+___NaNO3+___NaCl+___ 。
3.该反应的氧化剂是______,还原产物是____________。
1.盐 +6
2.2Fe(NO3)3+16NaOH+3Cl2=2Na2FeO4+6NaNO3+6NaCl+8H2O
3.Cl2 Na2FeO4
要点归纳
二、氯气与还原性化合物反应
典例精讲
【例4】(2022年广西桂林期末改编)新制氯水中含多种微粒,通过下列实验操作和现象得出的结论不正确的是
【答案】CD
【解析】A项,氯气把溴离子氧化成溴单质,正确;B项,氢离子与碳酸氢根离子反应生成二氧化碳和水,正确;C项,氯气把亚铁离子氧化为铁离子,错误;D项,紫色石蕊溶液先变红,是因为有氢离子,溶液有酸性,后褪色,是因为有次氯酸,溶液有漂白性,错误。
【例5】氯水中含有多种成分,因而具有多种性质,根据氯水分别与图中四种物质发生的反应填空(a、b、c、d重合部分代表物质间反应,且氯水足量)。
(1)能证明氯水具有漂白性的是________(填“a”、“b”、“c”或“d”)。
(2)c过程中的现象是_________________________,b过程中反应的离子方程式为______________________________________________。
(3)a过程中反应的化学方程式为________________________________。
【答案】(1)d (2)溶液中产生白色沉淀 COeq \\al(2-,3)+2H+=H2O+CO2↑ (3)2FeCl2+Cl2=2FeCl3
【解析】a过程:氯水中含有Cl2分子,可将FeCl2氧化:2FeCl2+Cl2=2FeCl3;b过程:氯水中含有H+,可与COeq \\al(2-,3)反应,放出CO2:COeq \\al(2-,3)+2H+=H2O+CO2↑;c过程:氯水中含有Cl-,可与AgNO3反应生成AgCl白色沉淀:Ag++Cl-=AgCl↓;d过程:氯水中有HClO分子和H+,可使石蕊试液先变红后褪色。
04
课堂总结
0503
强化训练
1.(2023年山东省菏泽市期中)下列物质中不能由单质直接化合生成的是
A.Na2O2B.HClC.CuCl2D.FeCl2
【答案】D
【解析】A项,Na和氧气在加热条件下生成Na2O2,不符合题意;B项,氢气和氯气在点燃下可生成HCl,不符合题意;C项,铜与氯气反应生成CuCl2,不符合题意;D项,铁与氯气反应生成FeCl3,FeCl2不能由单质直接化合生成,符合题意。
2.(2023年江苏省海门中学期中)下列关于氯气的叙述不正确的是
A.氯气是一种黄绿色、有刺激性气味、有毒的气体
B.氯气溶于水得到浅黄绿色的氯水,该过程涉及化学变化
C.氯气化学性质活泼,因此自然界中不存在游离态的氯元素
D.氢气在盛有氯气的集气瓶中燃烧,产生苍白色火焰和白烟
【答案】D
【解析】A项,氯气为黄绿色气体,密度比空气大,具有刺激性气味,有毒,能溶于水,正确;B项,氯气溶于水后,部分氯气和水反应生成盐酸和次氯酸,部分氯气以分子存在于水溶液中,氯气呈黄绿色,所以新制氯水显浅黄绿色,该过程涉及化学变化,正确;C项,氯元素化学性质活泼,在自然界中以化合态形式存在,自然界中不存在游离态的氯气,正确;D项,将H2点燃后插入盛满氯气的集气瓶中,氢气在氯气中安静的燃烧,产生苍白色的火焰,产生白雾,不正确。
3.下列关于氯气的说法不正确的是
A.尽管氯气的化学性质很活泼,但是干燥的液氯能用钢瓶贮存
B.氯气和液氯是两种不同的物质
C.可以用浓硫酸除去氯气中的水蒸气
D.Cl2跟变价金属反应生成高价金属氯化物
【答案】B
【解析】氯气和液氯是同一种物质的不同状态,B项不正确。
4.下列说法中不正确的是
A.Cl2在与金属反应时表现强氧化性
B.任何物质的燃烧必须有O2参与
C.Cl2与H2O反应的离子方程式为Cl2+H2O=HClO+H++Cl-
D.漂白粉的主要成分是Ca(ClO)2和CaCl2
【答案】B
【解析】A项,Cl2能与大多数金属化合,生成金属氯化物,表现强氧化性,正确;B项,燃烧不一定有氧气参加,如氢气在氯气中燃烧,错误;C项,Cl2与H2O反应生成HCl与HClO,离子方程式为Cl2+H2O=HClO+H++Cl-,正确;D项,漂白粉的主要成分为CaCl2和Ca(ClO)2,有效成分是Ca(ClO)2,正确。
5.(2023年四川省成都市郫都区期中)下列有关氯及其化合物的说法正确的是
A.Cl2和变价金属反应生成较高价态的金属氯化物
B.将氯气通入澄清石灰水中,即可制得漂白粉
C.向新制的氯水中放入有色布条会褪色说明Cl2有漂白性
D.Cl2―→NaCl必须加入还原剂才能实现
【答案】A
【解析】A项,Cl2氧化性很强,Cl2和变价金属反应生成较高价态的金属氯化物,正确;B项,应将氯气通入石灰乳中,才可制得漂白粉,错误;C项,向新制的氯水中放入有色布条会褪色说明HClO有漂白性,Cl2本身没有漂白性,错误;D项,Cl2―→NaCl可以通过氯气与氢氧化钠反应实现,Cl2+2NaOH=NaCl+NaClO+H2O不是必须加入还原剂才能实现,错误。
6.(2022年江苏省常熟市期中)下列关于氯及其化合物的叙述正确的是
A.氢气在氯气中燃烧产生淡蓝色火焰,在瓶口出现白烟
B.向氯水中加入NaHCO3粉末,有气泡产生,说明氯水中含有H+
C.工业上将氯气通入澄清石灰水中制取漂白粉
D.为了准确地了解氯水的酸性,可以用pH试纸准确测定其pH
【答案】B
【解析】A项,氢气在氯气中燃烧产生苍白色火焰,错误;B项,向氯水中加入NaHCO3粉末,有气泡产生,即有CO2生成,这是HCO3-与H+反应生成了CO2,正确;C项,工业上将氯气通入石灰乳中制取漂白粉,错误;D项,氯水中的HClO有漂白性,因此不能用pH试纸准确测定其pH,错误。
7.(2022年山西省晋城市高平市期中)下列有关氯气实验现象的记录正确的是
A.纯净的氢气在氯气中安静燃烧,发出苍白色火焰
B.钠可以在氯气中燃烧,发出黄色火焰,生成黄色固体
C.用pH试纸检验干燥的氯气,试纸先变红后褪色
D.新制的氯水是由氯气溶于水形成的无色透明溶液
【答案】A
【解析】A项,纯净的H2可以在黄绿色的Cl2中安静燃烧,发出苍白色火焰,生成氯化氢(HCl)气体,即H2+Cl22HCl,正确;B项,钠可以在氯气中燃烧,生成氯化钠,氯化钠是白色固体,即2Na+Cl22NaCl,错误;C项,干燥氯气不能使pH试纸先变红后褪色,含水蒸气的氯气,氯气和水反应生成盐酸和次氯酸,使pH试纸先变红后褪色,错误;D项,新制的氯水是由氯气溶于水形成的,新制的氯水中含氯气分子,溶液呈浅黄绿色,错误。
8.(2022·黑龙江大庆中学高一月考)下列关于氯及其化合物的叙述正确的是
①纯净的氢气在氯气中燃烧发出苍白色的火焰
②实验室制氯气时,为了防止环境污染,多余氯气用石灰乳吸收
③向久置的氯水中滴入紫色石蕊溶液,溶液将先变红后褪色
④检验Cl2中是否混有HCl气体的方法是将气体通入硝酸银溶液
⑤除去Cl2中的HCl,可使气体通过饱和碳酸氢钠溶液
A.①B.③④⑤
C.②⑤D.①⑤
【答案】A
【解析】①纯净的氢气在氯气中燃烧生成HCl,发出苍白色的火焰,正确;②实验室制氯气时,为了防止环境污染,多余氯气用NaOH溶液吸收,错误;③久置的氯水变成盐酸,则向久置的氯水中滴入紫色石蕊溶液,溶液将变红,错误;④Cl2和HCl的溶液都能与硝酸银反应生成沉淀,则将混合气体通入硝酸银溶液无法检验是否含有HCl,错误;⑤除去Cl2中的HCl,可使气体通过饱和氯化钠溶液,错误。
9.(2023年河南省安阳市期中)“84消毒液”的主要成分是NaClO,某兴趣小组探究“84消毒液”的性质,设计了以下实验。
下列有关说法错误的是
A.试管甲中溶液变蓝,短时间内无明显现象,说明“84消毒液”是碱溶液
B.试管乙中溶液先变蓝,通入CO2后,快速褪色,说明NaClO溶液能与酸反应
C.对比试管乙的实验,将CO2换成稀硫酸,也可达到快速褪色的效果
D.试管丙中溶液变蓝,说明NaClO具有氧化性
【答案】A
【解析】A项,紫色石蕊溶液遇碱溶液变蓝,说明“84消毒液”的溶液呈碱性,是碱性溶液,但其有效成分为NaClO,属于盐类,错误;B项,通入CO2后与NaClO溶液反应生成HClO,次氯酸具有漂白性,能漂白酸碱指示剂,则快速褪色,说明NaClO溶液能与酸反应,正确;C项,硫酸的酸性比HClO强,将CO2换成稀硫酸,能快速得到次氯酸,也可达到快速褪色的效果,正确;D项,NaClO具有氧化性,氧化碘离子生成单质碘,淀粉遇见单质碘变蓝,发生离子反应为ClO-+2I-+2H+=Cl-+I2+H2O,正确。
10.(2023年江苏省海门中学期中)BrCl的化学性质与卤素单质相似,能与大多数金属反应生成金属卤化物,也可以与水发生如下反应:BrCl+H2O=HCl+HBrO,下列说法正确的是
A.BrCl与Ca(OH)2溶液反应,产物有CaBr2、Ca(ClO)2和H2O
B.BrCl与水反应时,水既是氧化剂又是还原剂
C.BrCl与钠反应,化学方程式是2Na+BrCl=NaCl+NaBr
D.BrCl与铁反应,化学方程式是2Fe+2BrCl=FeCl2+FeBr2
【答案】C
【解析】A项,BrCl与Ca(OH)2反应的化学方程式为:2BrCl+2Ca(OH)2=CaCl2+Ca(BrO)2+2H2O,产物有CaCl2、Ca(BrO)2和H2O,错误;B项,BrCl与水反应的化学方程式为:BrCl+H2O=HCl+HBrO,反应中无化合价改变,不是氧化还原反应,水既不是氧化剂也不是还原剂,错误;C项,BrCl与钠反应,化学方程式为:2Na+BrCl=NaCl+NaBr,正确;D项,由于2Fe+3Br2=2FeBr3,BrCl能将Fe氧化成Fe3+,故BrCl与铁反应的化学方程式为:2Fe+3BrCl=FeBr3+FeCl3,错误。
1.能从原子结构的角度认识氯元素是一种很活泼的非金属元素,其单质具有强氧化性。
2.通过实验探究氯气的化学性质,理解氯气与金属单质、非金属单质的反应,促进“科学探究”化学核心素养的发展。
3.根据氯气有强氧化性,认识氯气还可以和某些还原性化合物发生反应。
操作
现象
方程式
与钠反应
剧烈燃烧,黄色火焰 生成大量白色烟
2Na+Cl2eq \(====,\s\up6(Δ))2NaCl
与铁反应
产生大量棕褐色烟
2Fe+3Cl2eq \(====,\s\up6(Δ))2FeCl3
与铜反应
产生大量棕黄色烟,溶于水后,溶液呈蓝绿色
Cu+Cl2eq \(====,\s\up6(Δ))CuCl2
与氢气反应
燃烧结束后,抽去盖在集气瓶口处的毛玻璃片
H2在Cl2中能安静地燃烧,发出苍白色火焰
瓶口上方出现白雾
H2+Cl2eq \(====,\s\up8(点燃))2HCl
操作
现象
方程式
与KBr反应
KBr溶液中加氯水,溶液变黄色;加入CCl4振荡静置后分层,下层显橙黄色
2KBr+Cl2=2KCl+Br2
与KI反应
KBr溶液中加氯水,溶液变黄色;加入CCl4振荡静置后分层,下层显紫红色
2KI+Cl2=2KCl+I2
与FeCl2反应
FeCl2溶液中加氯水,溶液变黄色
2FeCl2+Cl2=2FeCl3
FeCl2溶液
Cl2+2FeCl2=2FeCl3
NaBr溶液
Cl2+2NaBr=2NaCl+Br2
KI溶液
Cl2+2KI=2KCl+I2
Na2S溶液
Cl2+Na2S=2NaCl+S↓
SO2的水溶液
Cl2+SO2+2H2O=2HCl+H2SO4
Na2SO3溶液
Cl2+Na2SO3+H2O=2HCl+Na2SO4
选项
实验操作和现象
得出的结论(氯水中含有)
A
向NaBr溶液中滴加新制氯水,溶液变橙黄色
Cl2
B
向NaHCO3溶液滴加新制氯水,产生无色气体
H+
C
向FeSO4溶液中滴加新制氯水,溶液变黄色
HClO
D
向紫色石蕊试液中滴加新制氯水,溶液先变红后褪色
OH-
高中化学人教版 (2019)必修 第一册第一节 钠及其化合物学案: 这是一份高中化学人教版 (2019)必修 第一册<a href="/hx/tb_c161979_t4/?tag_id=42" target="_blank">第一节 钠及其化合物学案</a>,文件包含第09讲21活泼的金属单质钠教师版-2024年高中化学同步精品讲义必修一docx、第09讲21活泼的金属单质钠学生版-2024年高中化学同步精品讲义必修一docx等2份学案配套教学资源,其中学案共21页, 欢迎下载使用。
高中化学人教版 (2019)必修 第一册第二节 金属材料优质学案设计: 这是一份高中化学人教版 (2019)必修 第一册<a href="/hx/tb_c161991_t4/?tag_id=42" target="_blank">第二节 金属材料优质学案设计</a>,文件包含第21讲33金属材料教师版-2024年高中化学同步精品讲义必修一docx、第21讲33金属材料学生版-2024年高中化学同步精品讲义必修一docx等2份学案配套教学资源,其中学案共28页, 欢迎下载使用。
高中化学人教版 (2019)必修 第一册第二节 氯及其化合物优质导学案及答案: 这是一份高中化学人教版 (2019)必修 第一册<a href="/hx/tb_c161981_t4/?tag_id=42" target="_blank">第二节 氯及其化合物优质导学案及答案</a>,共10页。学案主要包含了学习目标,学习重点,学习难点,课前预习,课中探究,答案要点,对应训练,实验2-8等内容,欢迎下载使用。













