



专题3 氧化还原反应-高中化学学业水平考试学考复习专题(广东专用)
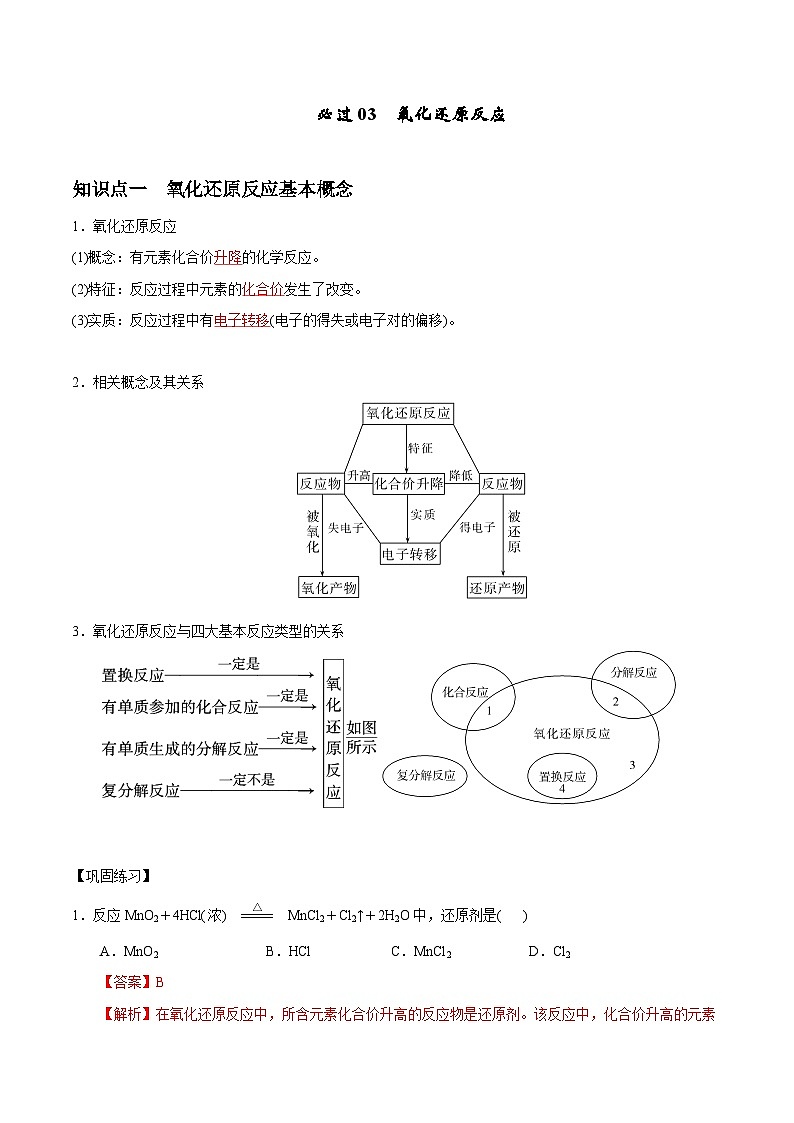
展开知识点一 氧化还原反应基本概念
1.氧化还原反应
(1)概念:有元素化合价升降的化学反应。
(2)特征:反应过程中元素的化合价发生了改变。
(3)实质:反应过程中有电子转移(电子的得失或电子对的偏移)。
2.相关概念及其关系
3.氧化还原反应与四大基本反应类型的关系
【巩固练习】
1.反应MnO2+4HCl(浓) eq \(=====,\s\up7(△)) MnCl2+Cl2↑+2H2O中,还原剂是( )
A.MnO2B.HClC.MnCl2D.Cl2
【答案】B
【解析】在氧化还原反应中,所含元素化合价升高的反应物是还原剂。该反应中,化合价升高的元素是反应物浓盐酸中的氯元素,氯从-1价升高到了0价,因此是还原剂,故选B。
2.处理汽车尾气的反应2NO+2COeq \(======,\s\up7(催化剂))2CO2+N2中,氧化剂是( )
A.NOB.COC.CO2D.N2
【答案】A
【解析】该反应中NO转化为N2,N元素化合价降低,得电子发生还原反应,作氧化剂,故答案为A。
3.黑火药的反应原理为:2KNO3+S+3C eq \(=====,\s\up7(点燃)) K2S+N2↑+3CO2↑,该反应中氧化产物是( )
A.K2SB.N2C.CO2D.K2S和N2
【答案】C
【解析】2KNO3+S+3Ceq \(=====,\s\up7(点燃))K2S+N2↑+3CO2↑中,N化合价从+5降低到0价,被还原,KNO3是氧化剂,N2是还原产物,S化合价从0价降低到-2价,被还原,S是氧化剂,K2S是还原产物,C化合价从0升高到+4价,被氧化,C是还原剂,CO2是氧化产物,故选C。
4.反应8NH3+3Cl2===N2+6NH4Cl中,还原产物是( )
A.N2B.Cl2C.NH4ClD.NH3
【答案】C
【解析】反应8NH3+3Cl2=N2+6NH4Cl中,N的化合价由-3价升为0价,失电子被氧化,生成的N2为氧化产物;Cl的化合价由0价降为-1价,得电子被还原,生成的NH4Cl为还原产物,故选C。
5.下列变化过程中,加入氧化剂才能实现的是( )
A.Cl2→Cl- B.I-→I2 C.SO2→SO32- D.CuO→Cu
【答案】B
【解析】Cl2→Cl-,化合价降低,A项错误;I-→I2,化合价升高,B项正确;SO2→SO32-,化合价不变,C项错误;CuO→Cu,化合价降低,D项错误。
6.洁厕灵(主要成分为盐酸)与84消毒液混合使用时发生反应:NaClO+2HCl===NaCl+Cl2↑+H2O,氧化剂与还原剂的物质的量之比是( )
A.1∶1B.1∶2C.2∶1D.4∶1
【答案】A
【解析】NaClO+2HCl=NaCl+Cl2↑+H2O中,NaClO中的氯元素的化合价从+1价降低到0价,HCl中氯元素的化合价从-1价升高到0价,2分子氯化氢中,只有1分子作了还原剂,NaClO是氧化剂,HCl是还原剂。化学方程式NaClO+2HCl=NaCl+Cl2↑+H2O中,1mlNaClO和2mlHCl完全反应,NaClO是氧化剂,HCl是还原剂,2mlHCl中有1mlHCl的化合价没变,体现出了酸性,故作还原剂的HCl只有1ml,氧化剂与还原剂的物质的量之比是1∶1,故选A。
7.洁厕灵和84消毒液混合使用时发生反应:NaC1O+2HCl===NaCl+Cl2↑+H2O,生成有毒的氯气。下列说法正确的是( )
A.84消毒液的有效成分是HCl
B.氯气既是氧化产物又是还原产物,氯化钠是还原产物
C.HCl只表现还原性
D.若有0.lml HCl被氧化,生成的氯气在标准状况下的体积约为2.24L
【答案】D
【解析】NaClO+2HCl═NaCl+Cl2↑+H2O中,NaClO中的Cl元素化合价由+1价降低到0价,HCl中的Cl元素化合价由-1价升高到0价,则NaClO为氧化剂,HCl是还原剂,Cl2既是氧化产物也是还原产物,NaCl是盐酸显酸性的产物,盐酸在该反应中既显酸性又显还原性。A项,84消毒液是利用其氧化性使蛋白质变性从而起到杀菌消毒的目的,根据反应方程式分析,NaClO为氧化剂,则84消毒液的有效成分是NaClO,故A错误;B项,根据分析,氯气既是氧化产物又是还原产物,氯化钠是盐酸显酸性的产物,故B错误;C项,根据分析,HCl在该反应中既显酸性又显还原性,故C错误;D项,若有0.lmlHCl被氧化,生成的氯气的物质的量为0.1ml,在标准状况下的体积约为=22.4L/ml×0.1ml=2.24L,故D正确;故选D。
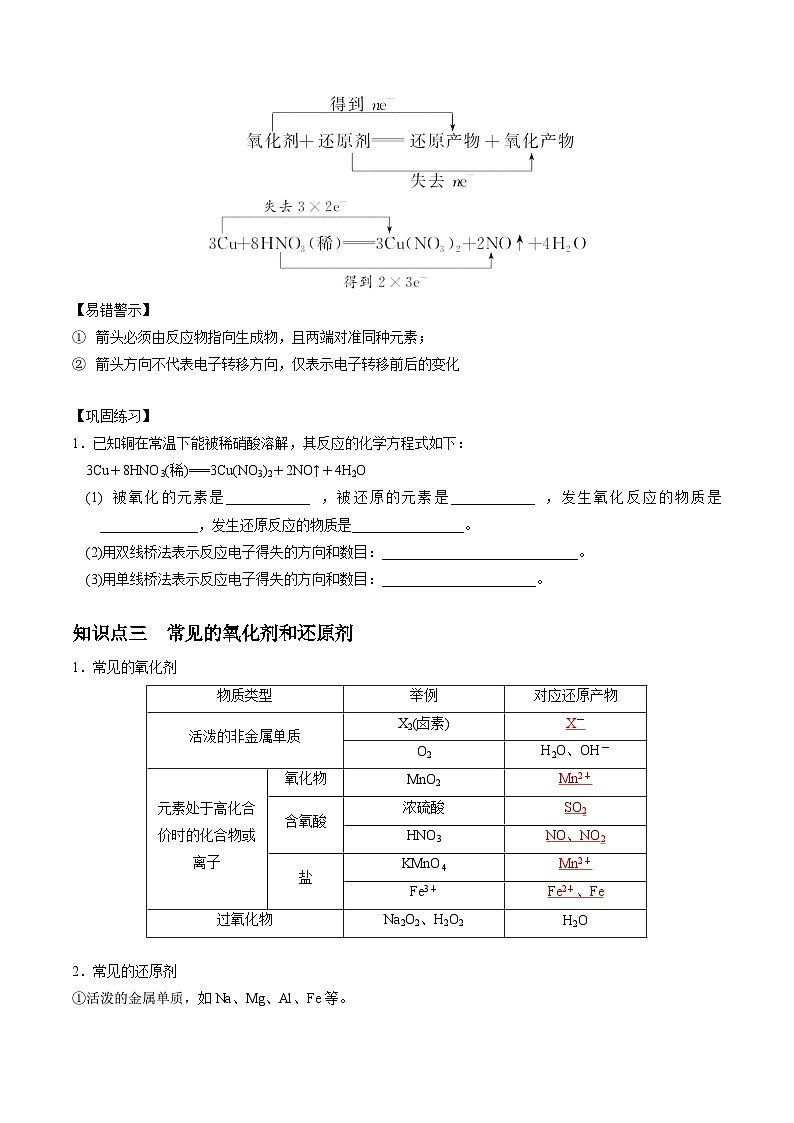
知识点二 氧化还原反应中电子转移的表示方法
1.单线桥法
表示氧化剂与还原剂之间电子转移的方向和总数。
如:
【易错警示】
①箭头必须由还原剂中失电子的元素指向氧化剂中得电子的元素;
②箭头方向表示电子转移的方向;
③在“桥”上标明转移的电子总数。
2.双线桥法
表示氧化剂及其还原产物、还原剂及其氧化产物之间电子转移情况。
如:
【易错警示】
箭头必须由反应物指向生成物,且两端对准同种元素;
箭头方向不代表电子转移方向,仅表示电子转移前后的变化
【巩固练习】
1.已知铜在常温下能被稀硝酸溶解,其反应的化学方程式如下:
3Cu+8HNO3(稀)===3Cu(NO3)2+2NO↑+4H2O
(1)被氧化的元素是____________,被还原的元素是____________,发生氧化反应的物质是______________,发生还原反应的物质是________________。
(2)用双线桥法表示反应电子得失的方向和数目:____________________________。
(3)用单线桥法表示反应电子得失的方向和数目:______________________。
【答案】(1)Cu N Cu HNO3
【解析】由方程式可知:铜元素化合价升高,从0价变为+2价,被氧化;氮元素化合价降低,从+5价变为+2价,被还原;故Cu发生氧化反应,HNO3发生还原反应。
知识点三 常见的氧化剂和还原剂
1.常见的氧化剂
2.常见的还原剂
①活泼的金属单质,如Na、Mg、Al、Fe等。
某些活泼的非金属单质,如H2、C、Si等。
③元素处于低化合价时的物质,如CO、Fe2+、S2-、I-等。
3.具有中间价态的物质既有氧化性又有还原性
【易错警示】
①氧化还原反应中,可能是一种元素被氧化另一种元素被还原,也可能是被氧化和被还原的元素是同一种元素,如H2O2分解时,被氧化和被还原的元素都是氧;
②氧化还原反应中,可能是一种反应物被氧化另外一种物质被还原,也可能是同一种物质既被氧化也被还原,如H2O2、KMnO4分解时,H2O2、KMnO4既被氧化也被还原。
【巩固练习】
1.下列物质在化学反应中常用作还原剂的一组是( )
A.HNO3、Cl2、FeCl3、KMnO4
B.Al、CO、O2、H2
C.Zn、C、H2、CO
D.KClO3、MnO2、C、Fe
答案:C
2.ClO2是高效消毒灭菌剂,制备反应2NaClO3+SO2+H2SO4===2ClO2+2NaHSO4,该反应中( )
A.Cl元素被氧化 B.H2SO4是氧化剂
C.SO2是还原剂 D.NaClO3是还原剂
答案:C
知识点四 氧化性、还原性强弱的判断方法
1.依据反应原理判断
氧化性:氧化剂 > 氧化产物;还原性:还原剂 > 还原产物。
【易错警示】氧化性、还原性强弱判断的“三个误区”
(1)误认为得、失电子越多,物质的氧化性、还原性越强;
(2)误认为具有氧化性的物质一定是氧化剂,具有还原性的物质一定是还原剂,应视具体反应而定;
(3)误认为所含元素处于最高价态的物质一定具有强氧化性,所含元素处于最低价态的物质一定具有强还原性。
2.根据金属的活动性顺序判断
【易错警示】氧化性强弱:Ag+ > Fe3+ > Cu2+
3.根据非金属的活动性顺序判断
4.根据反应的条件判断
不同的氧化剂(还原剂)与同一还原剂(氧化剂)反应时,反应易进行,则对应的氧化剂(还原剂)的氧化性(还原性)越强,反之越弱(若反应需要加热、催化剂、高压、通电等条件下磁能发生,泽反应较难进行)。例如:MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O,2KMnO4+16HCl(浓)===2KCl+2MnCl2+5Cl2↑+8H2O。从反应条件可以看出氧化性:KMnO4>MnO2。
5.根据变价元素被氧化或被还原的程度判断
不同氧化剂与相同还原剂作用时,还原剂化合价升高的数值越大,氧化剂的氧化性越强。例如:
【易错警示】
①氧化性、还原性的强弱与得失电子数目无关,如还原性:Na>Al;
②一般来说,化合价越高,氧化性越强,如浓硫酸 > 亚硫酸 > 氢硫酸,但存在反常情况,如次氯酸 > 高氯酸。
知识点五 氧化还原反应的基本规律及应用
1.守恒规律
(1)质量守恒:反应前后元素的种类、原子的数目和质量不变。
(2)电子守恒:氧化还原反应中,氧化剂得到的电子总数等于还原剂失去的电子总数,表现为化合价升高的总数等于化合价降低的总数。
(3)电荷守恒:离子方程式中反应物中各离子的电荷总数与产物中各离子的电荷总数相等。
2.价态规律
3.先后规律
在浓度相差不大的溶液中:
(1)同时含有几种还原剂时eq \(―――――→,\s\up7(加入氧化剂),\s\d5( ))将按照还原性由强到弱的顺序依次反应。
如向FeBr2溶液中通入少量Cl2时,因为还原性Fe2+>Br-,所以Fe2+先与Cl2反应。
(2)同时含有几种氧化剂时eq \(―――――→,\s\up7(加入还原剂),\s\d5( ))将按照氧化性由强到弱的顺序依次反应。
如在含有Fe3+、Cu2+的溶液中加入铁粉,因为氧化性Fe3+>Cu2+,所以铁粉先与Fe3+反应,再与Cu2+反应。
4.归中规律
同种元素不同价态之间发生氧化还原反应时可总结为:价态相邻能共存,价态相间能归中;归中价态不交叉,价升价降只靠拢。
例如,不同价态硫之间可以发生的氧化还原反应是
5.歧化规律:
“中间价→高价+低价”。具有多种价态的元素(如氯、硫、氮和磷元素等)均可发生歧化反应,如:Cl2+2NaOH===NaCl+NaClO+H2O。
【效果验证】
1.氧化还原反应的实质是( )
A.元素化合价发生变化
B.反应中有氧原子的得失
C.反应中有电子得失或电子偏移
D.反应后生成新物质
答案:C
2.下列反应中,不属于四种基本反应类型,也不属于氧化还原反应的是( )
A.2Na+2H2O===2NaOH+H2↑
B.CO2+Ca(OH)2===CaCO3↓+H2O
C.2H2O2===2H2O+O2↑
D.CaCO3+2HCl===CaCl2+H2O+CO2↑
答案:B
3.下列反应中属于氧化还原反应,但不属于四种基本反应类型的是( )
A.CuO+H2eq \(=====,\s\up15(△))Cu+H2O
B.Fe2O3+3COeq \(=====,\s\up15(△))2Fe+3CO2
C.2KMnO4eq \(=====,\s\up15(△))K2MnO4+MnO2+O2↑
D.NaOH+HCl===NaCl+H2O
答案:B
4.下列反应中属于氧化还原反应的是( )
A.2NaHCO3eq \(=====,\s\up15(△))Na2CO3+H2O+CO2↑
B.Na2O+H2O===2NaOH
C.2KI+Br2===2KBr+I2
D.MgO+2HCl===MgCl2+H2O
答案:C
5.戴维在研究气体对人体的作用时发现了“笑气”(N2O),N2O中氮元素的化合价为( )
A.0 B.-1
C.+1 D.+2
答案:C
6.NH4HP2O4可用作木材阻燃剂和森林灭火剂,其中P元素的化合价为( )
A.+2 B.+3
C.+4 D.+5
答案:B
7.磷单质在反应4P+3KOH+3H2O===3KH2PO2+PH3中的变化是( )
A.被氧化
B.被还原
C.既被氧化又被还原
D.既未被氧化又未被还原
答案:C
8.下列反应既是离子反应,又是氧化还原反应的是( )
A.氯化钠溶液中滴入硝酸银溶液
B.铁片置于硫酸铜溶液中
C.铁在氧气中燃烧
D.二氧化碳通入澄清石灰水中
答案:B
9.下列反应中,电子转移方向和数目正确的是( )
答案:D
10.氢化钙可以作为生氢剂(其中CaH2中氢元素为-1价),反应方程式如下:CaH2+2H2O===Ca(OH)2+2H2↑,其中水的作用是( )
A.既不是氧化剂也不是还原剂
B.是氧化剂
C.是还原剂
D.既是氧化剂又是还原剂
答案:B
11.歌曲《青花瓷》唱道:“帘外芭蕉惹骤雨,门环惹铜绿”,其中的“铜绿”即是铜锈,它的化学成分是Cu2(OH)2CO3(碱式碳酸铜)。铜在潮湿的空气中生锈的化学反应为2Cu+O2+CO2+H2O===Cu2(OH)2CO3。下列有关该反应的说法正确的是( )
A.该反应不属于氧化还原反应
B.该反应中氧元素和碳元素化合价发生变化
C.该反应中铜是氧化剂
D.该反应是氧化还原反应,化合价发生改变的只有两种元素
答案:D
12.实验室制取少量的氮气,常利用的反应是NaNO2+NH4Cleq \(=====,\s\up7(△))NaCl+N2↑+2H2O。关于该反应说法正确的是( )
A.NaNO2是还原剂
B.N2只是氧化产物
C.NH4Cl中的氮元素被氧化
D.N2既是氧化剂又是还原剂
答案:C
13.下列化学变化中,需加入氧化剂才能实现的是( )
A.C→CO2 B.CO2→CO
C.CuO→Cu D.H2SO4→BaSO4
答案:A
14.海水提溴过程中,将溴吹入吸收塔,使溴蒸气和吸收剂二氧化硫发生作用以达到富集的目的,化学反应为Br2+SO2+2H2O===2HBr+H2SO4。下列说法正确的是( )
A.溴发生了还原反应
B.二氧化硫在反应中被还原
C.溴在反应中失去电子
D.该反应既是化合反应又是氧化还原反应
答案:A
15.根据反应:8NH3+3Cl2===6NH4Cl+N2,回答下列问题。
(1)氧化剂是__________,还原剂是____________。
(2)氧化剂与还原剂的物质的量之比:__________。
(3)用单线桥的方法表示该反应的电子转移情况:_____________
_______________________________________________________
_____________________________________________________。
(4)用双线桥的方法表示该反应的电子转移情况:___________。
答案:(1)Cl2 NH3
(2)3∶2
物质类型
举例
对应还原产物
活泼的非金属单质
X2(卤素)
X-
O2
H2O、OH-
元素处于高化合价时的化合物或离子
氧化物
MnO2
Mn2+
含氧酸
浓硫酸
SO2
HNO3
NO、NO2
盐
KMnO4
Mn2+
Fe3+
Fe2+、Fe
过氧化物
Na2O2、H2O2
H2O
具有中间价态的物质
还原产物
氧化产物
Fe2+
Fe
Fe3+
SOeq \\al(2-,3)
S
SOeq \\al(2-,4)
H2O2
H2O
O2
专题2 离子反应-高中化学学业水平考试学考复习专题(广东专用): 这是一份专题2 离子反应-高中化学学业水平考试学考复习专题(广东专用),文件包含02离子反应解析版docx、02离子反应学生版docx等2份试卷配套教学资源,其中试卷共21页, 欢迎下载使用。
专题 1 物质的分类及转化-高中化学学业水平考试学考复习专题(广东专用): 这是一份专题 1 物质的分类及转化-高中化学学业水平考试学考复习专题(广东专用),文件包含01物质的分类及转化解析版docx、01物质的分类及转化学生版docx等2份试卷配套教学资源,其中试卷共28页, 欢迎下载使用。
【学考复习】2024年高中化学学业水平考试(新教材专用)第06讲 物质的量-复习讲义: 这是一份【学考复习】2024年高中化学学业水平考试(新教材专用)第06讲 物质的量-复习讲义,文件包含知识梳理2024年高中化学学业水平考试新教材专用第06讲物质的量-讲义原卷版docx、知识梳理2024年高中化学学业水平考试新教材专用第06讲物质的量-讲义解析版docx等2份试卷配套教学资源,其中试卷共33页, 欢迎下载使用。












