



所属成套资源:2024年高中化学同步精品讲义(人教版选择性必修一)
人教版 (2019)选择性必修1第三节 盐类的水解精品导学案
展开
这是一份人教版 (2019)选择性必修1第三节 盐类的水解精品导学案,文件包含第13讲34盐类的水解教师版-2024年高中化学同步精品讲义选择性必修一docx、第13讲34盐类的水解学生版-2024年高中化学同步精品讲义选择性必修一docx等2份学案配套教学资源,其中学案共29页, 欢迎下载使用。
02
预习导学
自主梳理
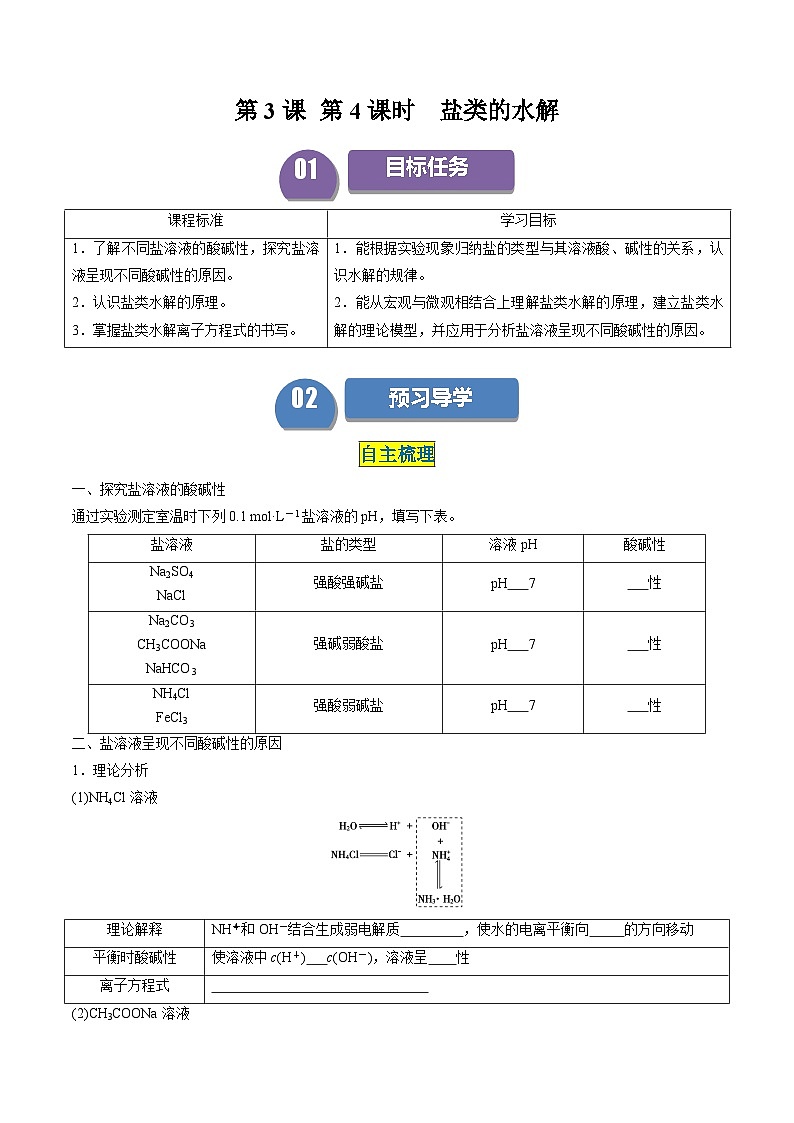
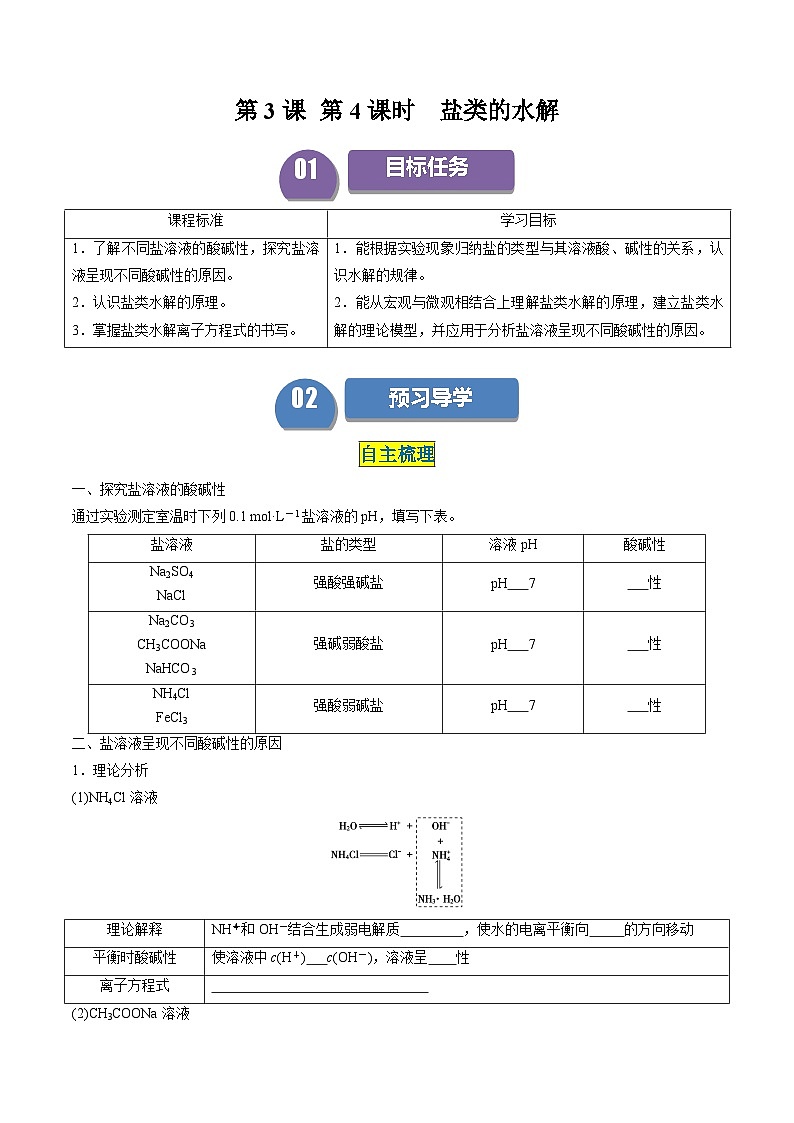
一、探究盐溶液的酸碱性
通过实验测定室温时下列0.1 ml·L-1盐溶液的pH,填写下表。
二、盐溶液呈现不同酸碱性的原因
1.理论分析
(1)NH4Cl溶液
(2)CH3COONa溶液
(3)NaCl溶液
H2OOH-+H+,NaCl===Na++Cl-,溶液中盐电离的离子不能与H2O电离出的H+或OH-生成 。c(H+) c(OH-),呈 。
2.盐类水解的定义
盐溶于水,电离出的 或 结合水电离出的 或 生成 的反应称为盐的水解。
预习检测
1.下列溶液因盐的水解而呈酸性的是
A.溶液B.溶液C.溶液D.溶液
2.常温下,某溶液中由水电离产生的,该溶液的溶质可能是
A.B.C.D.
3.下列事实与盐类水解无关的是
A.水溶液呈酸性B.加热能使纯碱溶液去污能力增强
C.配制溶液,需用盐酸溶解固体D.溶液不能用玻璃瓶盛放
4.下列离子方程式中,属于水解反应的是
A.
B.
C.
D.
5.下列有关问题,与盐的水解有关的是
①实验室盛放Na2CO3溶液的试剂瓶不能用磨口玻璃塞
②用NaHCO3与Al2(SO4)3两种溶液可作泡沫灭火剂
③加热蒸干CuCl2溶液得到Cu(OH)2固体
④Al2S3不能通过溶液中的反应制取
⑤加热蒸干AlCl3溶液得到Al(OH)3固体
⑥铁在潮湿环境中生锈
A.①②③⑥B.②③④⑥C.①④⑤⑥D.①②③④⑤
6.NH4Cl溶液中离子浓度的大小关系正确的是
A.
B.
C.
D.
探究提升
03
►环节一 盐类水解的类型和规律
【情境材料】
海洋面积约占地球表面积的71%。海水中主要含有Na+、K+、Ca2+、Mg2+、Cl-、SOeq \\al(2-,4)、Br-、HCOeq \\al(-,3)、COeq \\al(2-,3)等离子。海水呈弱碱性(pH约为8.1),海水的弱碱性有利于海洋生物利用碳酸钙形成介壳。
【问题探究】
1.请从化学的角度分析海水呈碱性的原因是什么?
2.在预测NaHCO3溶液的酸碱性时,甲同学认为NaHCO3为酸式盐,应呈酸性;乙同学认为HCOeq \\al(-,3)会水解,溶液应呈碱性;丙同学认为HCOeq \\al(-,3)既会发生电离又会发生水解,溶液的酸碱性取决于电离程度、水解程度的相对大小。上述三位同学的观点哪个是正确的?
3.NaHCO3、Na2CO3同样为碳酸盐,试分析同浓度二者的碱性强弱。
要点归纳
1.实质
盐电离―→eq \b\lc\{\rc\}(\a\vs4\al\c1(弱酸的阴离子―→结合H+,弱碱的阳离子―→结合OH-))―→
破坏了水电离平衡―→水的电离程度增大―→c(H+)≠c(OH-)―→溶液呈碱性或酸性。
2.规律
(1)“有弱才水解,无弱不水解”——盐中有弱酸阴离子或弱碱阳离子才水解,若没有,则是强酸强碱盐,不发生水解反应。
(2)“越弱越水解”——弱酸阴离子对应的酸越弱,水解程度越大;弱碱阳离子对应的碱越弱,其水解程度越大。
(3)“都弱都水解”——弱酸弱碱盐电离出的弱酸阴离子和弱碱阳离子都发生水解,且相互促进。
(4)“谁强显谁性”——当盐中的阴离子对应的酸比阳离子对应的碱更容易电离时,水解后盐溶液呈酸性,反之,呈碱性,即强酸弱碱盐显酸性,强碱弱酸盐显碱性。
3.特征
(1)常见的“弱”离子
弱碱阳离子:NH eq \\al(\s\up1(+),\s\d1(4)) 、Al3+、Fe3+、Cu2+等;
弱酸酸根离子:CO eq \\al(\s\up1(2-),\s\d1(3)) 、HCO eq \\al(\s\up1(-),\s\d1(3)) 、AlO eq \\al(\s\up1(-),\s\d1(2)) 、SO eq \\al(\s\up1(2-),\s\d1(3)) 、S2-、HS-、ClO-、CH3COO-、F-等。
(2)酸式盐溶液酸碱性的判断
①多元弱酸的酸式盐:因弱酸的酸式酸根离子既可以发生电离,又可以发生水解,故盐溶液的酸碱性取决于对应酸式酸根离子的电离程度与水解程度的相对大小。如NaHCO3溶液中,HCO eq \\al(\s\up1(-),\s\d1(3)) 的水解程度大于电离程度,溶液显碱性;NaHSO3溶液中,HSO eq \\al(\s\up1(-),\s\d1(3)) 的电离程度大于水解程度,溶液显酸性。
②强酸的酸式盐:强酸的酸式酸根离子在溶液中完全电离,故盐溶液显酸性。如NaHSO4溶液显酸性。
典例精讲
【例1】(2022秋·江西抚州·高二校考期末)下列关于盐溶液呈酸碱性的说法错误的是
A.盐溶液呈酸碱性的原因是破坏了水的电离平衡
B.NH4Cl溶液呈酸性是由于溶液中c(H+)>c((OH-)
C.在CH3COONa溶液中,由水电离的c(H+)≠c((OH-)
D.水电离出的H+或OH-与盐电离出的弱酸阴离子或弱碱阳离子结合,引起盐溶液呈酸碱性
【例2】(2021春·广西南宁·高二南宁三中校考期末)下列说法正确的是
A.Na2C2O4溶液中离子浓度关系:c(C2O)+c(HC2O)+c(H2C2O4)=c(Na+)
B.能水解的盐溶液可能呈酸性或碱性,也有可能呈中性
C.配制FeSO4溶液时要加入铁粉防止Fe2+水解
D.将Al2(SO4)3水溶液蒸干得到Al(OH)3固体
【例3】(2023春·重庆沙坪坝·高二重庆一中校考期中)常温下,下列有关水溶液叙述正确的是
A.向的氨水中加入少量硫酸铵固体,则溶液中增大
B.pH均为11的溶液和NaOH溶液,则由水电离的之比为
C.向NaOH溶液中逐滴加入溶液,直到溶液呈中性,有
D.下列4种pH相同的溶液:①;②;③;④NaOH中的大小顺序是①>②>③>④
►环节二 盐类水解离子方程式的书写【情境材料】
硫化钠又称臭碱、臭苏打、黄碱、硫化碱。染料工业中用于生产硫化染料,是硫化青和硫化蓝的原料。印染工业用作溶解硫化染料的助染剂。制革工业中用于水解使生皮脱毛,还用以配制多硫化钠以加速干皮浸水助软。
【问题探究】
1.请分析在Na2S溶液中,是否发生水解反应,如果反应,哪种离子发生了水解反应,水溶液显什么性?
2.请判断AlCl3溶液中哪种离子发生了水解反应,溶液显什么性?
3.COeq \\al(2-,3)对应的酸是H2CO3,所以其水解离子方程式为COeq \\al(2-,3)+2H2OH2CO3+2OH-,对吗?
要点归纳
1.水解离子方程式的一般模式及特点
阴(阳)离子+H2O弱酸(或弱碱)+OH-(或H+)。
(1)一般盐类水解程度很小,水解产物很少,通常不生成沉淀和气体,也不发生分解,因此盐类水解的离子方程式中不标“↓”或“↑”,也不把生成物(如NH3·H2O、H2CO3等)写成其分解产物的形式。
(2)盐类水解是可逆反应,是中和反应的逆反应,而中和反应是趋于完全的反应,所以盐的水解反应是微弱的,盐类水解的离子方程式一般不写“===”而写“”。
2.不同类型盐水解的离子方程式
(1)一元弱酸强碱盐,以CH3COONa为例:CH3COO-+H2OCH3COOH+OH-。
(2)一元弱碱强酸盐,以NH4Cl为例: NHeq \\al(+,4)+H2ONH3·H2O+H+。
(3)多元弱酸强碱盐(正盐):多元弱酸强碱盐水解是分步进行的,应分步书写。水解程度主要取决于第一步反应,以Na2CO3为例:COeq \\al(2-,3)+H2OHCOeq \\al(-,3)+OH-,HCOeq \\al(-,3)+H2OH2CO3+OH-。
(4)多元弱碱强酸盐:多元弱碱强酸盐水解也是分步的,由于中间过程复杂,中学阶段写成一步,以CuCl2为例:Cu2++2H2OCu(OH)2+2H+。
(5)多元弱酸的酸式盐,以NaHCO3为例: HCOeq \\al(-,3)+H2OH2CO3+OH-。
(6)弱酸弱碱盐中阴、阳离子水解相互促进
①NHeq \\al(+,4)与HCOeq \\al(-,3)、COeq \\al(2-,3)、CH3COO-等构成的盐,虽然水解相互促进,但水解程度较小,仍是部分水解。如NHeq \\al(+,4)+CH3COO-+H2OCH3COOH+NH3·H2O。
②Al3+和COeq \\al(2-,3)或HCOeq \\al(-,3)等构成的盐,水解相互促进非常彻底,生成气体和沉淀。如Al3++3HCOeq \\al(-,3)
(1)误把电离方程式看成水解方程式,如HS-+H2OS2-+H3O+,此方程式为HS-的电离方程式,不是HS-的水解方程式,因为其化简可写为HS-S2-+H+。HS-的水解方程式应为HS-+H2OH2S+OH-。
(2)书写盐类水解方程式常见错误
①把“”误写为“===”。如Fe3++3H2O===Fe(OH)3+3H+是错误的,正确的为Fe3++3H2OFe(OH)3+3H+。
②水解产物量很小时,标上“↑”或“↓”。如Al3++3H2OAl(OH)3↓+3H+是错误的,正确的为Al3++3H2OAl(OH)3+3H+。
典例精讲
【例4】(2023秋·辽宁·高二沈阳市第一二〇中学校联考期末)下列叙述正确的是
A.明矾可以用于净水是因为:
B.小苏打能中和胃酸是因为:
C.溶液显酸性的原因:
D.溶液的水解方程式:
【例5】(2023·全国·高二假期作业)下列电离或水解方程式书写正确的是
A.水溶液呈碱性:
B.溶解于重水中:
C.在水溶液中的电离:
D.常温下,0.1ml/L溶液约为3:
04
课堂总结
05
强化训练探究提升
一、单选题
1.(2023春·浙江杭州·高二校联考期中)下列盐类能抑制水的电离的是
A.B.C.D.
2.(2023秋·浙江·高二期末)下列物质中能促进水的电离,且水溶液呈酸性的是
A.AlCl3B.NH3C.CH3COOHD.CH3CH2ONa
3.(2023秋·河南许昌·高二统考期末)下列方程式中,属于水解反应且书写正确的是
A.B.
C.D.
4.(2021秋·广东茂名·高二统考期末)已知相同物质的量浓度的NaCN和NaClO溶液相比,NaCN溶液的pH较大,则关于同温度同体积同浓度的HCN和HClO溶液的下列说法中,不正确的是
A.电离程度:
B.pH:HCN溶液溶液
C.与NaOH溶液恰好完全反应时,消耗NaOH的物质的量:
D.两种溶液中离子浓度:
5.(2023春·陕西安康·高二统考期末)时,下列各组离子能大量共存的是
A.的水溶液中:
B.能使紫色石蕊试剂变红的水溶液中:
C.水电离出的的水溶液中:
D.的水溶液中:
6.(2023春·浙江衢州·高二统考期末)对溶液进行一系列的实验,根据现象得出的结论不正确的是
A.AB.BC.CD.D
7.(2022春·广西南宁·高二南宁三中校考期中)常温下,下列溶液中微粒的物质的量浓度关系正确的是
A.pH=8的CH3COONa溶液和pH=8的NaOH溶液,由水电离产生的OH-浓度相等
B.0.01ml/LNaOH溶液与等体积pH=2醋酸混合后的溶液:c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
C.0.2ml/LNH3•H2O溶液与0.1ml/LHCl溶液等体积混合:c(Cl-)+c(H+)>c(NH3•H2O)+c(OH-)
D.向氨水中加入氯化铵固体,溶液中比值变小
8.(2023春·四川绵阳·高二三台中学校考阶段练习)25℃时,在20 mL 0.1 ml·L-1NaOH溶液中逐滴加入0.2 ml·L-1醋酸溶液,曲线如图所示,有关粒子浓度关系的比较中,不正确的是
A.在A点:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
B.在B点:c(OH-)=c(H+),c(Na+)=c(CH3COO-)
C.在C点:c(CH3COO-)>c(H+)>c(Na+)>c(OH-)
D.在C点:c(CH3COO-)+c(CH3COOH)=2c(Na+)
9.(2023春·内蒙古赤峰·高二赤峰二中校考阶段练习)25℃时,向溶液中逐滴加入浓度为的盐酸,溶液中与、加入盐酸的体积的变化关系如图所示。下列说法正确的是
A.的水解平衡常数的数量级为
B.溶液中水的电离程度:a点
相关学案
这是一份化学选择性必修1第四节 化学反应的调控精品导学案,文件包含第09讲26化学反应的调控教师版-2024年高中化学同步精品讲义选择性必修一docx、第09讲26化学反应的调控学生版-2024年高中化学同步精品讲义选择性必修一docx等2份学案配套教学资源,其中学案共38页, 欢迎下载使用。
这是一份人教版 (2019)选择性必修1第二节 反应热的计算优质学案设计,文件包含第03讲13反应热的计算教师版-2024年高中化学同步精品讲义选择性必修一docx、第03讲13反应热的计算学生版-2024年高中化学同步精品讲义选择性必修一docx等2份学案配套教学资源,其中学案共36页, 欢迎下载使用。
这是一份高中人教版 (2019)第一节 反应热优秀导学案,文件包含第01讲11反应热焓变教师版-2024年高中化学同步精品讲义选择性必修一docx、第01讲11反应热焓变学生版-2024年高中化学同步精品讲义选择性必修一docx等2份学案配套教学资源,其中学案共35页, 欢迎下载使用。










