

所属成套资源:2025届高中化学全程复习学案
2025届高中化学全程复习学案全套41反应历程与化学反应速率
展开
这是一份2025届高中化学全程复习学案全套41反应历程与化学反应速率,共9页。学案主要包含了教考衔接,对点演练等内容,欢迎下载使用。
1.了解基元反应、过渡态理论,了解速率方程和速率常数。
2.掌握多因素对化学反应速率影响的分析方法。
考点一 基元反应 过渡态理论
1.基元反应
(1)概念:大多数化学反应都是分几步完成的,其中的每一步反应都称为基元反应。
(2)速率方程:对于基元反应aA+bB===gG+hH,其速率方程可写为v=____________(其中k称为速率常数,恒温下,k不因反应物浓度的改变而变化)。
2.过渡态理论
如图所示是两步完成的化学反应,分析并回答下列问题。
(1)该反应的反应物为A、B,中间体为C,生成物为D。
(2)由A、B生成C的反应为吸热反应,由C生成D的反应为____热反应,总反应为放热反应。
(3)第一步为____(填“快”或“慢”,下同)反应,第二步为____反应,决定总反应快慢的是慢反应。
3.催化剂与活化能
(1)催化剂的催化机理
催化剂参与化学反应,生成能量更低的中间产物,降低了达到过渡态所需要的活化能,使反应速率加快。
反应A+B→AB的活化能为________。
加入催化剂K后,反应分两步进行:
①A+K→AK 活化能为Ea1(慢反应)
②AK+B→AB+K 活化能为Ea2(快反应)
总反应方程式:A+B K AB,反应活化能(能垒)为________。
(2)活化能与化学反应速率的关系
①加入催化剂后,两步基元反应的活化能Ea1和Ea2均小于原反应的活化能Ea,因此反应速率加快。
②两步基元反应由于Ea1>Ea2,第1步反应是慢反应,决定整个反应的快慢。
【教考衔接】
典例[2023·全国甲卷,28(3)]MO+分别与CH4、CD4反应,体系的能量随反应进程的变化如下图所示(两者历程相似,图中以CH4示例)。
(ⅰ)步骤Ⅰ和Ⅱ中涉及氢原子成键变化的是________(填“Ⅰ”或“Ⅱ”)。
(ⅱ)直接参与化学键变化的元素被替换为更重的同位素时,反应速率会变慢,则MO+与CD4反应的能量变化应为图中曲线________(填“c”或“d”)。
(ⅲ)MO+与CH2D2反应,氘代甲醇的产量CH2DOD________CHD2OH(填“>”“<”或“=”)。若MO+与CHD3反应,生成的氘代甲醇有________种。
听课笔记
【对点演练】
考向一 反应机理——快反应与慢反应
1.已知反应:2NO(g)+Br2(g)⇌2NOBr(g) ΔH=-a kJ·ml-1(a>0),其反应机理如下:
①NO(g)+Br2(g)⇌NOBr2(g) 快
②NO(g)+NOBr2(g)⇌2NOBr(g) 慢
下列有关该反应的说法正确的是( )
A.该反应的速率主要取决于①的快慢
B.NOBr2是该反应的催化剂
C.正反应的活化能比逆反应的活化能小a kJ·ml-1
D.增大Br2(g)浓度能增大活化分子百分数,加快反应速率
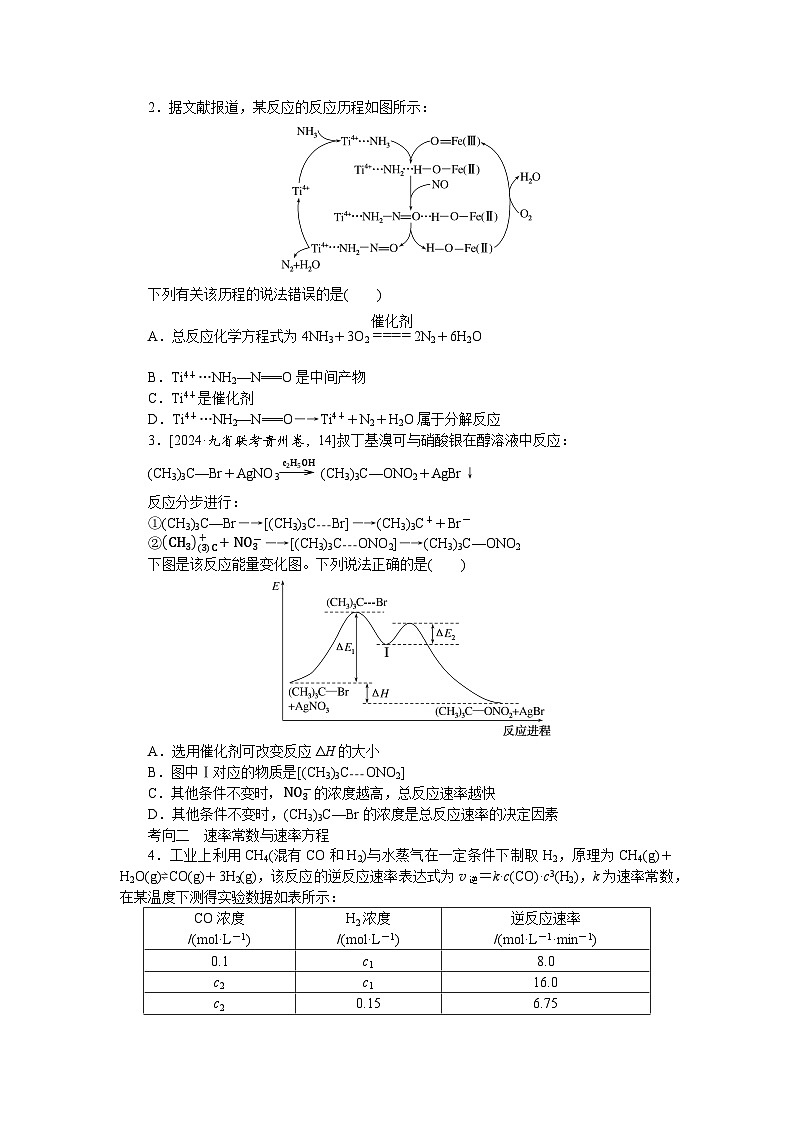
2.据文献报道,某反应的反应历程如图所示:
下列有关该历程的说法错误的是( )
A.总反应化学方程式为4NH3+3O2催化剂==== 2N2+6H2O
B.Ti4+…NH2—N===O是中间产物
C.Ti4+是催化剂
D.Ti4+…NH2—N===O―→Ti4++N2+H2O属于分解反应
3.[2024·九省联考贵州卷,14]叔丁基溴可与硝酸银在醇溶液中反应:
(CH3)3C—Br+AgNO3 c2H5OH (CH3)3C—ONO2+AgBr↓
反应分步进行:
①(CH3)3C—Br―→[(CH3)3CBr]―→(CH3)3C++Br-
②CH33C++NO3-―→[(CH3)3CONO2]―→(CH3)3C—ONO2
下图是该反应能量变化图。下列说法正确的是( )
A.选用催化剂可改变反应ΔH的大小
B.图中Ⅰ对应的物质是[(CH3)3CONO2]
C.其他条件不变时,NO3-的浓度越高,总反应速率越快
D.其他条件不变时,(CH3)3C—Br的浓度是总反应速率的决定因素
考向二 速率常数与速率方程
4.工业上利用CH4(混有CO和H2)与水蒸气在一定条件下制取H2,原理为CH4(g)+H2O(g)⇌CO(g)+3H2(g),该反应的逆反应速率表达式为v逆=k·c(CO)·c3(H2),k为速率常数,在某温度下测得实验数据如表所示:
由上述数据可得该温度下,c2=________,该反应的逆反应速率常数k=________ L3·ml-3·min-1。
5.300 ℃时,2NO(g)+Cl2(g)⇌2ClNO(g)的正反应速率表达式为v正=k·cn(ClNO),测得正反应速率和浓度的关系如下表:
n=________;k=________。
6.已知2N2O5(g)⇌2N2O4(g)+O2(g),起始时N2O5(g)为35.8 kPa,分解的反应速率v=2×10-3×pN2O5(kPa·min-1)。t=62 min时,测得体系中pO2=2.9 kPa,则此时的pN2O5=________kPa,v=________kPa·min-1。
考点二 反应历程图像分析
1.常考影响化学反应速率的因素:浓度、温度、压强、催化剂的活性、接触面积、原电池原理、副反应等。
2.随着时间的推移,反应物浓度减小,反应速率减小。
3.绝大多数催化剂都有活性温度范围,温度太低时,催化剂的活性太小,反应速率太慢;随温度升高,反应速率逐渐增大,物质转化率增大,温度过高又会破坏催化剂的活性。
4.速率图像分析的一般方法
(1)看清关键点:起点、终点和变化点。
(2)看清变化趋势。
(3)综合分析反应原理,如有的反应放热造成温度升高,反应速率加快;有的反应生成的金属与原金属形成原电池,反应速率加快;有的反应物浓度减小,反应速率减慢;有的反应生成物中有催化剂,反应速率加快;有的反应温度过高,造成催化剂失去活性,反应速率减慢等。
【教考衔接】
典例1 [2023·新课标卷,29(2)]研究表明,合成氨反应在Fe催化剂上可能通过图2机理进行(*表示催化剂表面吸附位,N2*表示被吸附于催化剂表面的N2)。判断上述反应机理中,速率控制步骤(即速率最慢步骤)为________(填步骤前的标号),理由是________________。
听课笔记
典例2 [2023·辽宁卷,18(3)(ⅱ)]接触法制硫酸的关键反应为SO2的催化氧化:
SO2(g)+12O2(g)⇌SO3(g) ΔH=-98.9 kJ·ml-1
为提高钒催化剂的综合性能,我国科学家对其进行了改良。不同催化剂下,温度和转化率关系如下图所示,催化性能最佳的是________(填标号)。
听课笔记
【对点演练】
考向一 浓度与温度对化学反应速率的影响
1.把在空气中久置的铝片5.0 g投入盛有500 mL 0.5 ml·L-1盐酸的烧杯中,该铝片与盐酸反应生成氢气的速率v与反应时间t可用如图的坐标曲线来表示。
回答下列问题:
(1)O→a段不生成氢气的原因是___________________________________________。
(2)b→c段生成氢气的速率增加较快的主要原因可能是_____________________________。
(3)t>c时生成氢气的速率降低的主要原因是______________________。
考向二 温度与选择性的双重影响
2.汽车排气管装有三元催化剂装置,在催化剂表面通过发生吸附、解吸消除CO、NO等污染物。反应机理如下[Pt(s)表示催化剂,右上角带“*”表示吸附状态]:
Ⅰ.NO+Pt(s)===NO*
Ⅱ.CO+Pt(s)===CO*
Ⅲ.NO*===N*+O*
Ⅳ.CO*+O*===CO2+Pt(s)
Ⅴ.N*+ N*===N2+Pt(s)
Ⅵ.NO*+N*===N2O+Pt(s)
经测定汽车尾气中反应物浓度及生成物浓度随温度T变化关系如图1和图2所示。
(1)图1中温度从Ta升至Tb的过程中,反应物浓度急剧减小的主要原因是________________________________________________________________________。
(2)图2中T2 ℃时反应Ⅴ的活化能________(填“”或“=”)反应Ⅵ的活化能;T3 ℃时发生的主要反应为________(填“Ⅳ”“Ⅴ”或“Ⅵ”)。
3.NOx(主要指NO和NO2)是大气主要污染物之一。有效去除大气中的NOx是环境保护的重要课题。在有氧条件下,新型催化剂M能催化NH3与NOx反应生成N2。将一定比例的O2、NH3和NOx的混合气体,匀速通入装有催化剂M的反应器中反应(装置见图1)。
反应相同时间NOx的去除率随反应温度的变化曲线如图2所示,在50~250 ℃范围内随着温度的升高,NOx的去除率先迅速上升后上升缓慢的主要原因是________________________________________________________________________
________________________________________________________________________
________________________________________________________________________;
当反应温度高于380 ℃时,NOx的去除率迅速下降的原因可能是________________________________________________________________________
________________________________________________________________________。
温馨提示:请完成课时作业41
第41讲 反应历程与化学反应速率
考点一
夯实·必备知识
1.(2)k·ca(A)·cb(B)
2.(2)放 (3)慢 快
3.(1)Ea Ea1
突破·关键能力
教考衔接
典例 解析:(ⅰ)步骤Ⅰ涉及的是碳氢键的断裂和氢氧键的形成,步骤Ⅱ中涉及碳氧键形成,所以符合题意的是步骤Ⅰ;
(ⅱ)直接参与化学键变化的元素被替换为更重的同位素时,反应速率会变慢,则此时正反应活化能会增大,根据图示可知,MO+与CD4反应的能量变化应为图中曲线c;
(ⅲ)MO+与CH2D2反应时,因直接参与化学键变化的元素被替换为更重的同位素时,反应速率会变慢,则单位时间内产量会下降,则氘代甲醇的产量CH2DOD<CHD2OH;根据反应机理可知,若MO+与CHD3反应,生成的氘代甲醇可能为CHD2OD和CD3OH,共2种。
答案:(ⅰ)Ⅰ (ⅱ)c (ⅲ)< 2
对点演练
1.解析:反应速率主要取决于慢的一步,所以该反应的速率主要取决于②的快慢,故A错误;NOBr2是反应过程中的中间产物,不是该反应的催化剂,故B错误;由于该反应为放热反应,说明反应物的总能量高于生成物的总能量,所以正反应的活化能比逆反应的活化能小a kJ·ml-1,故C正确;增大Br2(g)浓度,活化分子百分数不变,但单位体积内的活化分子数目增多,所以能加快反应速率,故D错误。
答案:C
2.解析:根据反应历程,参加反应的物质有NH3、NO、O2,生成物有N2和H2O,因此总反应化学方程式为4NH3+2NO+2O2 eq \(=====,\s\up7(催化剂)) 3N2+6H2O,故A错误;根据题中信息得到Ti4+…NH2—N===O是中间产物,故B正确;Ti4+在整个反应过程中参与了反应,但反应前后质量和化学性质未变,因此Ti4+是催化剂,故C正确;分解反应是一种物质反应生成两种或两种以上新物质,因此Ti4+…NH2—N===O―→Ti4++N2+H2O属于分解反应,故D正确。
答案:A
3.答案:D
4.解析:根据v逆=k·c(CO)·c3(H2),由表中数据可得:(c1 ml·L-1)3= eq \f(8.0 ml·L-1·min-1,0.1 ml·L-1×k) ,c2 ml·L-1= eq \f(6.75 ml·L-1· min-1,(0.15 ml·L-1)3×k) ,所以有k× eq \f(8.0 ml· L-1·min-1,0.1 ml·L-1×k) × eq \f(6.75 ml·L-1·min-1,(0.15 ml·L-1)3×k) =16.0 ml·L-1·min-1,解得k=1.0×104 L3·ml-3·min-1,代入c2的等式可得c2=0.2。
答案:0.2 1.0×104
5.解析:根据表格①②中的数据,代入正反应速率表达式然后做比值:3.60×10-91.44×10-8=k×0.30nk×0.60n,解得n=2,将n和①或②或③中数据代入正反应速率表达式得k=4.0×10-8 L·ml-1·s-1。
答案:2 4.0×10-8 L·ml-1·s-1
6.解析: 2N2O5(g)===2N2O4(g)+O2(g)
起始/kPa 35.8 0 0
变化/kPa 2.9×2 2.9×2 2.9
62 min时/kPa 30.0 5.8 2.9
v=2×10-3×30.0 kPa·min-1=6.0×10-2 kPa·min-1。
答案:30.0 6.0×10-2
考点二
突破·关键能力
教考衔接
典例1 解析:由图1中信息可知,12N2(g)===N(g)的ΔH=+473 kJ·ml-1,则N≡N的键能为946 kJ·ml-1;32H2(g)===3H(g)的ΔH=+654 kJ·ml-1,则H—H键的键能为436 kJ·ml-1。在化学反应中,最大的能垒为速率控制步骤,而断开化学键的步骤都属于能垒,由于N≡N的键能比H—H键的大很多,因此,在上述反应机理中,速率控制步骤为(ⅱ)。
答案:(ⅱ) 在化学反应中,最大的能垒为速率控制步骤,而断开化学键的步骤都属于能垒,由于N≡N的键能比H—H键的大很多,因此,在上述反应机理中,速率控制步骤为(ⅱ)
典例2 解析:为了提高催化剂的综合性能,科学家对催化剂进行了改良,从图中可以看出标号为d的催化剂VKCsCe对SO2的转化率最好,产率最佳,故答案选d。
答案:d
对点演练
1.答案:(1)铝的表面有一层致密的Al2O3薄膜,能与H+反应得到盐和水,无氢气放出
(2)反应放热,溶液温度升高,反应速率加快(或反应产生的铝离子是该反应的催化剂)
(3)随着反应的进行,溶液中氢离子的浓度逐渐降低
2.解析:(1)由图1可知,温度升高,反应物的消耗量增大,说明催化剂的活性增强,反应速率加快。
(2)由图2可知,T2 ℃时,N2的浓度小于N2O的浓度,说明反应Ⅴ的反应速率小于反应Ⅵ的反应速率,则反应Ⅴ的活化能大于反应Ⅵ的活化能;T3 ℃时,生成物二氧化碳的浓度最大,说明发生的主要反应为反应Ⅳ。
答案:(1)温度升高,催化剂活性增强,反应速率加快 (2)> Ⅳ
3.答案:迅速上升段是催化剂活性随温度升高而增大,与温度升高共同使 NOx 去除反应速率迅速增大;上升缓慢段主要是温度升高,催化剂活性下降,反应速率上升较慢 催化剂活性下降;NH3 与 O2 反应生成了 NO
CO浓度
/(ml·L-1)
H2浓度
/(ml·L-1)
逆反应速率
/(ml·L-1·min-1)
0.1
c1
8.0
c2
c1
16.0
c2
0.15
6.75
序号
c(ClNO)/(ml·L-1)
v正/(ml·L-1·s-1)
①
0.30
3.60×10-9
②
0.60
1.44×10-8
③
0.90
3.24×10-8
相关学案
这是一份2025届高中化学全程复习学案全套09化学计算的常用方法,共8页。学案主要包含了教考衔接,对点演练等内容,欢迎下载使用。
这是一份2025届高中化学全程复习学案全套10钠及其氧化物,共9页。学案主要包含了师说·助学,易错诊断,教考衔接,师说·延伸,对点演练等内容,欢迎下载使用。
这是一份2025届高中化学全程复习学案全套12铁及其化合物,共13页。学案主要包含了师说·助学,易错诊断,教考衔接,师说·延伸,对点演练等内容,欢迎下载使用。









