
2025届高中化学全程复习学案全套32晶胞及其相关计算
展开1.掌握均摊法计算的一般方法,能根据晶胞中微粒的位置计算晶胞的化学式。
2.掌握晶体密度与晶胞参数计算的一般步骤。
考点一 晶胞中微粒数的计算方法——均摊法
1.晶胞
(1)概念:描述晶体结构的基本单元。
(2)晶体中晶胞的排列——无隙并置
①无隙:相邻晶胞之间没有任何间隙。
②并置:所有晶胞平行排列、取向相同。
感悟:
2.晶胞中微粒数的计算方法——均摊法
(1)长方体(包括立方体)晶胞中不同位置的粒子数的计算
如某个粒子为N个晶胞所共有,则该粒子有1N属于这个晶胞。中学中常见的晶胞为立方晶胞,立方晶胞中微粒数的计算方法如图1。
(2)非长方体晶胞
在六棱柱(如图2)中,顶角上的原子有16属于此晶胞,面上的原子有12属于此晶胞,因此六棱柱中镁原子个数为12×16+2×12=3,硼原子个数为6。
【师说·助学】 计算晶胞中微粒数的关键:确定一个粒子为几个晶胞所共有。
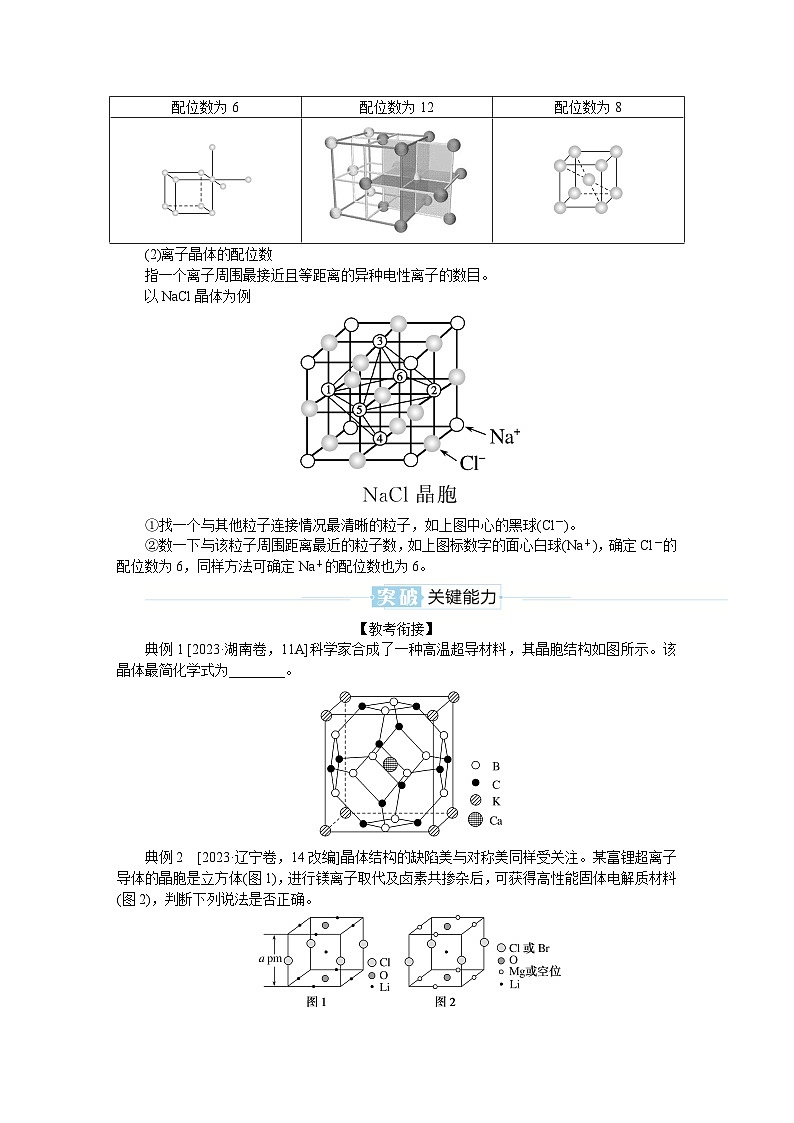
3.晶胞微粒配位数的计算
(1)晶体中原子(或分子)的配位数
若晶体微粒为同种原子或同种分子,则某原子(或分子)的配位数指的是距该原子(或分子)最接近且等距离的原子(或分子)的数目,常见晶胞的配位数如下:
(2)离子晶体的配位数
指一个离子周围最接近且等距离的异种电性离子的数目。
以NaCl晶体为例
①找一个与其他粒子连接情况最清晰的粒子,如上图中心的黑球(Cl-)。
②数一下与该粒子周围距离最近的粒子数,如上图标数字的面心白球(Na+),确定Cl-的配位数为6,同样方法可确定Na+的配位数也为6。
【教考衔接】
典例1 [2023·湖南卷,11A]科学家合成了一种高温超导材料,其晶胞结构如图所示。该晶体最简化学式为________。
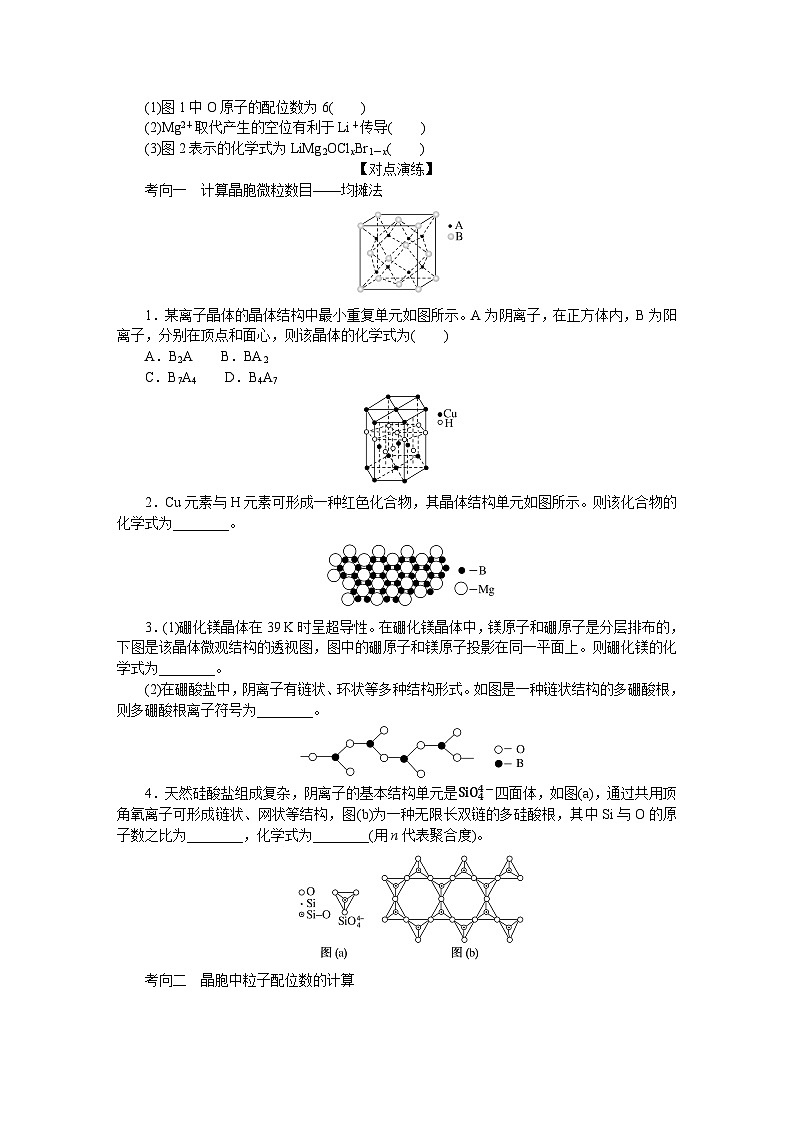
典例2 [2023·辽宁卷,14改编]晶体结构的缺陷美与对称美同样受关注。某富锂超离子导体的晶胞是立方体(图1),进行镁离子取代及卤素共掺杂后,可获得高性能固体电解质材料(图2),判断下列说法是否正确。
(1)图1中O原子的配位数为6( )
(2)Mg2+取代产生的空位有利于Li+传导( )
(3)图2表示的化学式为LiMg2OClxBr1-x( )
【对点演练】
考向一 计算晶胞微粒数目——均摊法
1.某离子晶体的晶体结构中最小重复单元如图所示。A为阴离子,在正方体内,B为阳离子,分别在顶点和面心,则该晶体的化学式为( )
A.B2A B.BA2
C.B7A4 D.B4A7
2.Cu元素与H元素可形成一种红色化合物,其晶体结构单元如图所示。则该化合物的化学式为________。
3.(1)硼化镁晶体在39 K时呈超导性。在硼化镁晶体中,镁原子和硼原子是分层排布的,下图是该晶体微观结构的透视图,图中的硼原子和镁原子投影在同一平面上。则硼化镁的化学式为________。
(2)在硼酸盐中,阴离子有链状、环状等多种结构形式。如图是一种链状结构的多硼酸根,则多硼酸根离子符号为________。
4.天然硅酸盐组成复杂,阴离子的基本结构单元是SiO44-四面体,如图(a),通过共用顶角氧离子可形成链状、网状等结构,图(b)为一种无限长双链的多硅酸根,其中Si与O的原子数之比为________,化学式为________(用n代表聚合度)。
考向二 晶胞中粒子配位数的计算
5.硅化镁是一种窄带隙n型半导体材料,在光电子器件、能源器件、激光、半导体制造等领域具有重要应用前景。硅化镁的晶胞参数a=0.639 1 nm,属于面心立方晶胞,结构如图所示。Si原子的配位数为________。
6.如图是一种由Y(与Sc同族)、Fe、Ba、O组成的晶体,晶胞棱上的球代表Ba,顶点的球代表Y,四方锥中心和八面体中心的球代表Fe,其余小球代表O。
(1)该晶体的化学式为________。
(2)其中Y的配位数为________。
考点二 晶胞参数计算
1.晶胞参数
晶胞的形状和大小可以用6个参数来表示,包括晶胞的3组棱长a、b、c和3组棱相互间的夹角α、β、γ,即晶格特征参数,简称晶胞参数。
2.晶体结构的相关计算
(1)空间利用率=晶胞占有的微粒体积晶胞体积×100%。
(2)金属晶体中体心立方堆积、面心立方堆积中的几组计算公式(设棱长为a)
①面对角线长=2a。
②体对角线长=3a。
③体心立方堆积________r=3a(r为原子半径)。
④面心立方堆积________r=2a(r为原子半径)。
3.宏观晶体密度与微观晶胞参数的关系
【教考衔接】
典例 [2023·辽宁卷,14A改编]某富锂超离子导体的晶胞是立方体,如下图:
计算该晶体的密度________________。
【师说·延伸】 由晶胞参数计算晶体密度的思路
晶胞的质量晶胞的体积 由ρ=mV 晶胞的密度
【对点演练】
1.[2024·九省联考吉林卷,10]镍酸镧电催化剂立方晶胞如图所示,晶胞参数为a,具有催化活性的是Ni,图①和图②是晶胞的不同切面。下列说法错误的是( )
A.催化活性:①>②
B.镍酸镧晶体的化学式为LaNiO3
C.La周围紧邻的O有4个
D.La和Ni的最短距离为32a
2.如图是Fe单质的晶胞模型。已知晶体密度为d g·cm-3,铁原子的半径为________ nm(用含有d、NA的代数式表示)。
3.立方氮化硼的硬度仅次于金刚石,但热稳定性远高于金刚石,其晶胞结构如图所示。立方氮化硼属于________晶体,其中硼原子的配位数为________。已知:立方氮化硼的密度为d g·cm-3,B原子半径为x pm,N原子半径为y pm,阿伏加德罗常数的值为NA,则该晶胞中原子的空间利用率为________________(列出化简后的计算式)。
4.氮化硼是一种性能优异的新型材料,主要结构有六方氮化硼(图1)和立方氮化硼(图2)。前者与石墨结构类似。
(1)50.0 g六方氮化硼晶体中含有六元环的数目为________。
(2)立方氮化硼中N的配位数为________。已知立方氮化硼密度为d g·cm-3,NA代表阿伏加德罗常数的值,立方氮化硼晶胞中面心上6个N原子相连构成正八面体,该正八面体的边长为________ pm(列式即可)。
微专题11 晶胞中原子分数坐标与投影图
【要点归纳】
1.原子分数坐标
(1)概念
以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子分数坐标。
(2)原子分数坐标的表示方法
晶胞中的任意一个原子的中心位置均可用3个分别小于1的数在立体坐标系中表示出来。
2.常见典型晶胞的投影图
3.典型晶胞结构模型的原子坐标参数与投影图
(1)简单立方体模型粒子坐标与投影图
①粒子坐标:若1(0,0,0),2(0,1,0),则确定3(1,1,0),7(1,1,1)
②x、y平面上的投影图:________________
(2)体心晶胞结构模型的原子坐标与投影图
①粒子坐标:若1(0,0,0),3(1,1,0),5(0,0,1),则6(0,1,1),7(1,1,1),912,12,12
②x、y平面上的投影图:________________
(3)面心立方晶胞结构模型的原子坐标和投影图
①粒子坐标:若10(0,0,0),1312,12,0,121,12,12,则1512,1,12,1112,12,1
②x、y平面上的投影图:________________
(4)金刚石晶胞结构模型的原子坐标参数和投影图
①若a原子为坐标原点,晶胞边长的单位为1,则原子1、2、3、4的坐标分别为14,14,14、14,34,34、34,14,34、34,34,14。
②x、y平面上的投影图:________
【典题示例】
典例1
[2021·山东卷,16(4)]XeF2晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为90°,该晶胞中有________个XeF2分子。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标,如A点原子的分数坐标为12,12,12。已知Xe—F键长为r pm,则B点原子的分数坐标为________;晶胞中A、B间距离d=________pm。
听课笔记
典例2 [2022·湖南卷,18(4)]钾、铁、硒可以形成一种超导材料,其晶胞在xz、yz和xy平面投影分别如图所示:
①该超导材料的最简化学式为________。
②Fe原子的配位数为________。
③该晶胞参数a=b=0.4 nm、c=1.4 nm。阿伏加德罗常数的值为NA,则该晶体的密度为________g·cm-3(列出计算式)。
【对点演练】
考向一 原子分数坐标
1.
以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。如图中原子1的坐标为12,12,12,则原子2和3的坐标中正确的是( )
A.原子2为12,0,12
B.原子2为0,12,12
C.原子3为1,0,12
D.原子3为0,0,12
2.以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如,图中原子1的坐标为12,12,0,则原子2和3的坐标分别为________、________。
3.汞钡铜氧晶体的晶胞如图所示。图中钡离子的分数坐标为12,12,1+x2和________。
4.铜与氧元素形成的晶胞如图所示:
晶胞中Cu均匀地分散在立方体内部,a、b的坐标参数依次为(0,0,0)、12,12,12,则d的坐标参数为________,已知该晶体的密度为ρ g·cm-3,NA是阿伏加德罗常数的值,则晶胞参数为________cm(列出计算式即可)。
考向二 晶胞投影图
5.分别用○、●表示H2PO4-和K+,KH2PO4晶体的四方晶胞如图(a)所示,图(b)、图(c)分别显示的是H2PO4-、K+在晶胞xz面、yz面上的位置:
晶胞在x轴方向的投影图为________(填标号)。
6.AgN5的晶体结构与AgI相似。AgI的结构分为α-AgI和γ-AgI,γ-AgI立方晶胞的示意图见图1,图2是晶胞正上方的俯视投影图,图中黑球(实心球)表示I-,请在图2中用白球(空心球)表示出Ag+的位置。
7.[2022·广东卷,20节选]我国科学家发展了一种理论计算方法,可利用材料的晶体结构数据预测其热电性能,该方法有助于加速新型热电材料的研发进程。化合物X是通过该方法筛选出的潜在热电材料之一,其晶胞结构如图1,沿x、y、z轴方向的投影均为图2。
(1)X的化学式为________。
(2)设X的最简式的式量为Mr,晶体密度为ρ g·cm-3,则X中相邻K之间的最短距离为________________nm(列出计算式,NA为阿伏加德罗常数的值)。
温馨提示:请完成课时作业32
第32讲 晶胞及其相关计算
考点一
突破·关键能力
教考衔接
典例1 解析:根据晶胞结构可知,其中K个数:8×18=1,Ca个数:1,B个数:12×12=6,C个数:12×12=6,故其最简化学式为KCaB6C6。
答案:KCaB6C6
典例2 解析:(1)图1晶胞中,O位于面心,与O等距离最近的Li有6个,O原子的配位数为6,正确;
(2)进行镁离子取代及卤素共掺杂后,可获得高性能固体电解质材料,说明Mg2+取代产生的空位有利于Li+的传导,正确。
(3)图2中Li:1,Mg或空位为8×14=2。O:2×12=1,Cl或Br:4×14=1,Mg的个数小于2,根据正负化合价的代数和为0,图2的化学式为LiMgOClxBr1-x,错误。
答案:(1)√ (2)√ (3)×
对点演练
1.解析:A的个数:8,B的个数:8×18+6×12=4。
答案:B
2.解析:根据晶胞结构可以判断:Cu:2×12+12×16+3=6;H:6×13+1+3=6,所以化学式为CuH。
答案:CuH
3.解析:(1)每个Mg周围有6个B,而每个B周围有3个Mg,所以其化学式为MgB2。解析:(2)从图可看出,每个单元中,都有一个B和一个O完全属于这个单元,剩余的2个O分别被两个结构单元共用,所以B∶O=1∶(1+2×12)=1∶2,化学式为BO2-。
答案:(1)MgB2 2BO2-
4.解析:n个SiO2通过共用顶点氧离子可形成双链结构,找出重复的结构单元,如图:,由于是双链,其中顶点氧占12,Si原子数为4,O原子数为4×12+6×12+4+2=11,其中Si与O的原子数之比为2∶5.5,化学式为Si4O11n6n-。
答案:2∶5.5 Si4O11n6n-
5.解析:根据晶胞结构,以面心Si原子为基准,同一晶胞内等距离且最近的Mg原子有4个,紧邻晶胞还有4个Mg原子,共8个,故Si原子的配位数为8。
答案:8
6.解析:(1)由晶胞结构可知,Y位于顶点,原子数为18×8=1;Ba位于棱上,原子数为14×8=2;O原子有12个位于面上,2个位于晶胞内,原子数为12×12+2=8;3个Fe原子位于晶胞内,该晶体的化学式为YBa2Fe3O8。(2)从晶胞结构知Y位于晶胞顶点,距离Y最近的原子共有8个,即Y的配位数为8。
答案:(1)YBa2Fe3O8 (2)8
考点二
夯实·必备知识
2.(2)③4 ④4
突破·关键能力
教考衔接
典例 解析:晶胞中含Li:8×14+1=3,O:2×12=1,Cl:4×14=1,1个晶胞的质量为3×7+16+35.5NA g=72.5NA g,晶胞的体积为(a×10-10 cm)3=a3×10-30 cm3,则晶体的密度为72.5NA g÷(a3×10-30 cm3)=72.5NA×a3×10-30 g·cm-3。
答案:72.5NA×a3×10-30 g·cm-3
对点演练
1.答案:C
2.解析:由Fe单质的晶胞图可知,晶胞中含铁原子个数为2,晶胞的质量为2×56NA g,晶胞体积为112d·NA cm3,则晶胞边长为 3112d·NA cm,设Fe原子的半径为r,则4r=3× 3112d·NA cm,r=34× 3112d·NA×107 nm。
答案:34× 3112d·NA×107
3.解析:立方氮化硼的硬度仅次于金刚石,晶体类型类似于金刚石,是共价晶体;晶胞中每个N原子连接4个B原子,氮化硼的化学式为BN,所以晶胞中每个B原子也连接4个N原子,即硼原子的配位数为4;晶胞中N原子数为4,B原子数为8×18+6×12=4,晶胞的质量m=25×4NA g,晶胞的体积V=mρ=100NAd cm3=100dNA cm3,B、N原子总体积V′=4×4πx×10-1033+4πy×10-1033=16π3×(x3+y3)×10-30 cm3,晶胞中原子的空间利用率为V'V×100%=16π3×x3+y3×10-30100dNA×100%=4πx3+y3dNA75×1030×100%。
答案:共价 4 4πx3+y3dNA75×1030×100%
4.解析:(1)根据均摊法,一个六方氮化硼晶体的六元环含有一个N、一个B,50.0 g六方氮化硼晶体中含有六元环的数目为50.014+11×NA=2NA。
(2)由图2可知,立方氮化硼中N的配位数为4;面心上6个N原子构成正八面体,该正八面体的边长等于面对角线的一半,设BN晶胞边长为a cm,1个晶胞中含有4个B原子,含有N原子数为8×18+6×12=4,则1个晶胞中含有4个BN,所以d=4×25a3NA,解得a= 3100dNA,故正八面体的边长为22× 3100dNA×1010 pm。
答案:(1)2NA (2)4 22× 3100dNA×1010
微专题11
要点归纳
3.(1)② (2)②
(3)② (4)②
典题示例
典例1 解析:图中大球的个数为8×18+1=2,小球的个数为8×14+2=4,根据XeF2的原子个数比可知大球是Xe原子,小球是F原子,该晶胞中有2个XeF2分子;由A点坐标知该原子位于晶胞的中心,且每个坐标系的单位长度都记为1,B点在棱的rc处,其坐标为0,0,rc;图中y是底面对角线的一半,y=22a pm,x=c2-rpm,所以d=x2+y2= 12a2+c2-r2 pm。
答案:20,0,rc 12a2+c2-r2
典例2 解析:①由平面投影图可知,晶胞中位于顶点和体心的钾原子个数为8×18+1=2,均位于棱上和体内的硒原子的个数为8×14+2=4,均位于面上的铁原子个数为8×12=4,该物质的晶胞结构如图所示:,则超导材料最简化学式为KFe2Se2。②由平面投影图可知,铁原子的配位数为4。③设晶体的密度为d g·cm-3,由晶胞的质量公式可得:2×39+56×2+79×2NA g=abc×10-21×d g,解得d=2×39+56×2+79×2NA×0.4×0.4×1.4×10-21。
答案:①KFe2Se2 ②4 ③2×39+56×2+79×2NA×0.4×0.4×1.4×10-21
对点演练
1.解析:原子1的坐标为12,12,12,则坐标系为,原子2在晶胞底面的中心,原子2的坐标为12,12,0;原子3在坐标系z轴所在棱的一半,原子3的坐标为0,0,12,故选D。
答案:D
2.解析:图中原子1的坐标为12,12,0,则坐标系是。从晶胞内的2、3点分别向x、y、z轴上作垂线,即可得出2、3两点的原子分数坐标分别为34,14,14、14,14,34。
答案:34,14,14、14,14,34
3.答案:12,12,1-x2
4.解析:由晶胞示意图可知,位于顶角的a和体心的b的坐标参数依次为(0,0,0)、12,12,12,d位于体对角线的14处,则d的坐标参数为34,34,14;晶胞中Cu原子的个数为4,O原子的个数为8×18+1=2,则化学式为Cu2O,Cu2O的摩尔质量为144 g·ml-1,设晶胞的参数为a cm,晶胞的质量为a3ρ=2NA×144,则a=3288ρNA。
答案:34,34,14 3288ρNA
5.答案:B
6.解析:(1)根据γ-AgI立方晶胞的示意图,可以理解为有八个小立方体,银离子在其中四个小立方体体心位置,根据从上方的俯视图得出银离子在每个小正方形的中心位置,即白球(空心球)表示出Ag+的位置。
答案:
7.解析:(1)根据晶胞结构得到K有8个,有8×18+6×12=4,则X的化学式为K2SeBr6。(2)设X的最简式的式量为Mr,晶体密度为ρ g·cm-3,设晶胞参数为a nm,得到ρ=mV=Mr g·ml-1NA ml-1×4a×10-7 cm3=ρ g·cm-3,解得a=34MrNAρ×107 nm,X中相邻K之间的最短距离为晶胞参数的一半即12× 34MrNAρ×107 nm。
答案:(1)K2SeBr6 (2)12× 34MrNAρ×107
简单立方:
配位数为6
面心立方:
配位数为12
体心立方:
配位数为8
晶胞
类型
三维图
二维图
正视图
沿体对角线切开的剖面图
沿体对角线的投影
简单立方堆积
体心立方堆积
面心立方堆积
CaF2晶胞
金刚石晶胞
NaCl晶胞
2025届高中化学全程复习学案全套04氧化还原反应的相关概念: 这是一份2025届高中化学全程复习学案全套04氧化还原反应的相关概念,共11页。学案主要包含了师说·助学,易错诊断,教考衔接,师说·延伸,对点演练,要点归纳,典题示例等内容,欢迎下载使用。
2025届高中化学全程复习学案全套05氧化还原反应的配平与计算: 这是一份2025届高中化学全程复习学案全套05氧化还原反应的配平与计算,共10页。学案主要包含了教考衔接,师说·延伸,对点演练,典题示例,模型构建等内容,欢迎下载使用。
2025届高中化学全程复习学案全套09化学计算的常用方法: 这是一份2025届高中化学全程复习学案全套09化学计算的常用方法,共8页。学案主要包含了教考衔接,对点演练等内容,欢迎下载使用。












