

2025届高中化学全程复习学案全套25原子结构 核外电子排布
展开1.掌握原子结构中微粒数目的关系。
2.了解原子核外电子的运动状态、能级分布和排布原理。
3.能正确书写1~36号元素原子核外电子排布式、价层电子排布式和轨道表示式。
考点一 原子结构、核素、同位素
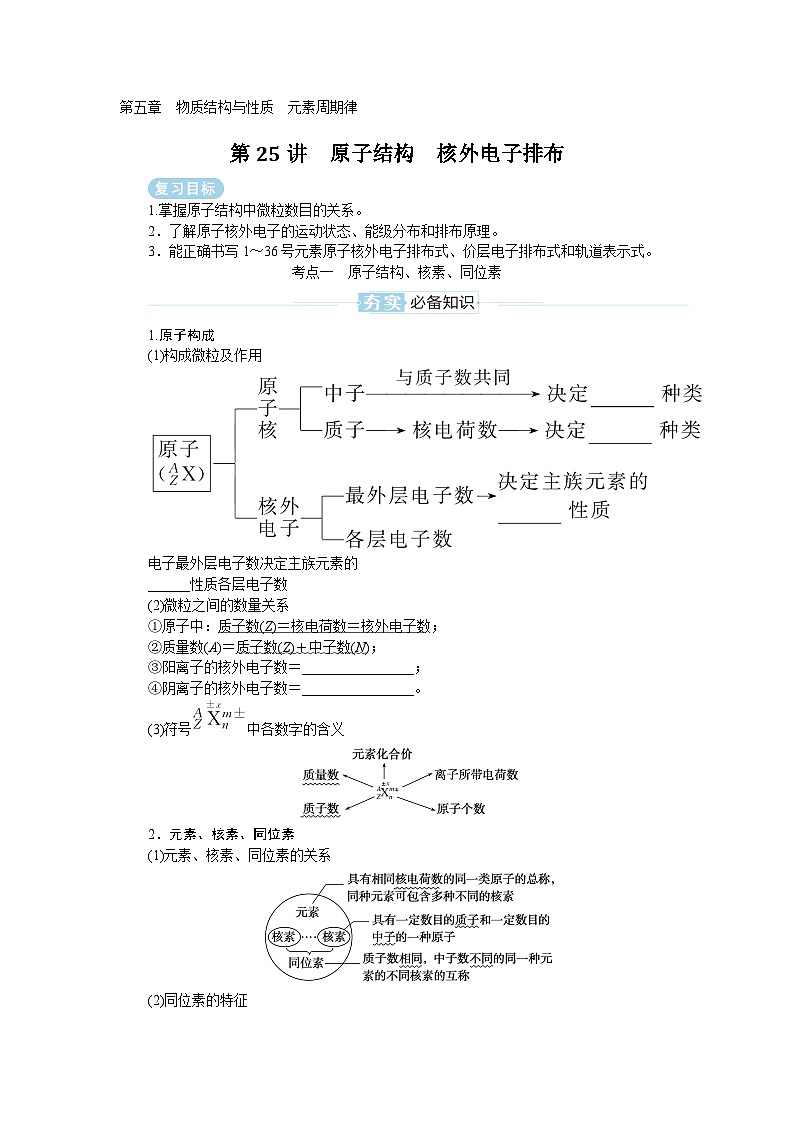
1.原子构成
(1)构成微粒及作用
电子最外层电子数决定主族元素的
______性质各层电子数
(2)微粒之间的数量关系
①原子中:质子数(Z)=核电荷数=核外电子数;
②质量数(A)=质子数(Z)+中子数(N);
③阳离子的核外电子数=________________;
④阴离子的核外电子数=________________。
(3)符号中各数字的含义
2.元素、核素、同位素
(1)元素、核素、同位素的关系
(2)同位素的特征
①相同存在形态的同位素,化学性质几乎完全相同,物理性质不同。
②天然存在的同一元素各核素所占的原子百分数一般不变。
(3)氢元素的三种核素
11H:名称为________,不含中子;
21H:用字母________表示,名称为________或重氢;
31H:用字母________表示,名称为________或超重氢。
【师说·助学】 原子中不一定都含有中子,如11H中没有中子。
(4)几种重要的核素
3.两种相对原子质量
(1)原子(即核素)的相对原子质量:一个原子(即核素)的质量与________________的比值。
(2)元素的相对原子质量:是按该元素各种天然同位素原子所占的原子百分比算出的平均值。如:Ar(Cl)=Ar(35Cl)×a%+Ar(37Cl)×b%。
【易错诊断】 判断正误,错误的说明理由。
1.一种元素可以有多种核素,也可能只有一种核素,有多少种核素就有多少种原子:________________________________________________________________________
________________________________________________________________________。
2.核聚变如21H+31H―→42He+10n,因为有新微粒生成,所以该变化是化学变化:________________________________________________________________________
________________________________________________________________________
________________________________________________________________________。
3.中子数不同而质子数相同的微粒一定互为同位素:________________________________________________________________________
________________________________________________________________________。
4.3517Cl与3717Cl得电子能力几乎相同:________________________________________________________________________
________________________________________________________________________。
【教考衔接】
典例1 [2021·北京卷,2]下列有关放射性核素氚(31H)的表述不正确的是( )
A. 31H原子核外电子数为1
B. 31H原子核内中子数为3
C. 31H2与H2化学性质基本相同
D. 31H2O具有放射性
典例2 汤姆孙()和阿斯通()在1913年发现了(_10^22)Ne。下列有关说法正确的是( )
A. 2210Ne和2010Ne属于同素异形体
B. 2210Ne和2010Ne属于不同的核素
C. 2210Ne和2010Ne的中子数相同
D. 2210Ne转变为2010Ne为化学变化
【对点演练】
考向一 微粒中“粒子数”的确定
1.月球上的每百吨32He聚变所释放出的能量相当于目前人类一年消耗的能量,地球上氦元素主要以 42He的形式存在。已知一个 12C原子的质量为a g,一个32He原子的质量为b g,NA为阿伏加德罗常数。下列说法正确的是( )
A. 32He比42He多一个中子
B.氦元素的近似相对原子质量为3.5
C. 32He的相对原子质量为12ba
D. 32He的摩尔质量为bNA
考向二 元素、核素、同位素的概念辨析
2.现有下列9种微粒: 11H、21H、136C、146C、147N、 5626Fe2+、5626Fe3+、168O2、168O3。按要求完成以下各题:
(1) 11H、21H分别是氢元素的一种________,它们互称为________。
(2)互为同素异形体的微粒是________。
(3) 5626Fe2+的中子数为________,核外电子数为________。
(4)上述9种微粒中有________种核素,含有________种元素。
考点二 核外电子运动状态与排布原理
1.核外电子运动状态
核外电子按能量不同分成能层,同一能层的电子,还被分成不同能级。量子力学把电子在原子核外的一个空间运动状态称为一个原子轨道。
(1)原子核外能层、能级、原子轨道之间的关系。
(2)能量关系
①同一能层各能级能量顺序:E(ns)<E(np)<E(nd)<E(nf)。
②形状相同的原子轨道能量的高低:E(1s)<E(2s)<E(3s)<E(4s)……
③同一能层内形状相同而伸展方向不同的原子轨道的能量________。
(3)电子云:s电子云轮廓图呈________形;p电子云轮廓图呈________形,p电子云有________种伸展方向。
2.基态与激发态 原子光谱
(1)基态原子:处于最低能量状态的原子。
激发态原子:基态原子吸收能量,它的电子会跃迁到较高能级,变为激发态原子。
(2)原子光谱:不同元素原子的电子发生跃迁时会吸收或释放不同的光,用光谱仪记录下来便得到原子光谱。利用原子光谱上的特征谱线可以鉴定元素,称为光谱分析。
3.基态原子核外电子排布依据
(1)排布原理
①能量最低原理:在构建基态原子时,电子将尽可能地占据能量最低的原子轨道,使整个原子的能量最低。
②泡利原理:在一个原子轨道里,最多只能容纳2个电子,它们的自旋相反。
③洪特规则:基态原子中,填入简并轨道的电子总是先单独分占,且自旋平行。 如2p3的电子排布为,不能表示为
【师说·助学】 当能量相同的原子轨道在全充满(p6、d10、f14)、半充满(p3、d5、f7)和全空(p0、d0、f0)状态时,体系的能量最低。
(2)填充顺序——构造原理
(3)基态原子核外电子排布表示方法(以硫原子为例)
【易错诊断】 判断正误,错误的说明理由。
1.p能级能量不一定比s能级的能量高:________________________________________________________________________
________________________________________________________________________。
2.22Ti的电子排布式1s22s22p63s23p10违反了能量最低原理:________________________________________________________________________
________________________________________________________________________。
3. 表示的原子能量处于最低状态:_______________________________________。
4.1s22s12p1表示的是激发态原子的电子排布:_________________________________________________。
【教考衔接】
典例1 [2023·浙江1月,17改编]由硅原子形成的三种微粒,电子排布式分别为:①[Ne]3s23p2、②[Ne]3s23p1、③[Ne]3s23p14s1,其中属于基态粒子的是________,属于激发态粒子的是________。
典例2 [2021·河北卷,17节选](1)在KH2PO4的四种组成元素各自所能形成的简单离子中,核外电子排布相同的是________(填离子符号)。
(2)原子中运动的电子有两种相反的自旋状态,若一种自旋状态用+12表示,与之相反的用-12表示,称为电子的自旋磁量子数。对于基态的磷原子,其价电子自旋磁量子数的代数和为________。
【师说·延伸】 (1)符合核外电子排布原理的粒子均为基态粒子,否则为激发态粒子。
(2)电子的运动状态与原子核外电子数目相等;空间运动状态与核外电子填充原子轨道的数目相等。
【对点演练】
考向一 基态原子核外电子排布表示方法
1.下列Li原子轨道表示式表示的状态中,能量最低和最高的分别为________、________(填字母)。
2.(1)A元素基态原子的最外层有3个未成对电子,次外层有2个电子,其元素符号为__________;其基态原子价层电子的轨道表示式为________________。
(2)E元素基态原子的M层全充满,N层没有成对电子且只有一个未成对电子,E的元素符号为________,其基态原子的核外电子排布式为________。
(3)元素D的正三价离子的3d能级为半充满,D的元素符号为________,其基态原子的核外电子排布式为________。
核外电子排布常见错误
(1)在书写基态原子的轨道表示式时,常出现以下错误:
(2)当出现d轨道时,虽然电子按ns、(n-1)d、np的顺序填充,但在书写电子排布式时,仍把(n-1)d放在ns前,如Fe:1s22s22p63s23p63d64s2,而失电子时,却先失4s轨道上的电子,如Fe3+:1s22s22p63s23p63d5。
考向二 判断电子的运动状态
3.(1)铜或铜盐的焰色试验为绿色,该光谱是________(填“吸收光谱”或“发射光谱”)。
(2)钾发生焰色试验的原因是________________________________________________。
4.(1)基态F原子核外电子的运动状态有______种。
(2)基态钛原子的价层电子排布式为________,其原子核外电子的空间运动状态有________种,共有________种运动状态不同的电子。
(3)基态Si原子价层电子的运动状态有________种,若其电子排布式表示为[Ne]3s23p2x违背了________。
(4)基态Cu原子核外电子的空间运动状态有________种。
考向三 判断原子中未成对电子数目
5.按要求填空:
(1)基态Ti3+中未成对电子数有________个;与Ti同族相邻的元素Zr的基态原子价层电子排布式为________。与钛同周期元素的基态原子中,未成对电子数与钛相同的元素有________种。
(2)血红蛋白中的铁处于基态时,其最高能级中的单电子数为________。
(3)Cr与Ni的基态原子核外未成对电子数之比为________。
(4)第四周期中未成对电子数最多的基态原子的价层电子轨道表示式为________________。
(5)氨硼烷(NH3BH3)的制备是当今科学研究的重要课题,可用反应B(OCH3)3+NH4Cl+LiAlH4===NH3BH3+Al(OCH3)3+LiCl+H2↑进行制备。反应中涉及元素的基态原子中含1个未成对电子的有________种。
第四周期元素原子未成对电子数归纳
▭〖温馨提示:请完成课时作业25〗
第五章 物质结构与性质 元素周期律
第25讲 原子结构 核外电子排布
考点一
夯实·必备知识
1.(1)核素 元素 化学 (2)③质子数-电荷数 ④质子数+电荷数
2.(3)氕 D 氘 T 氚
3.(1)12C质量的1/12
易错诊断
1.正确。
2.错误。化学变化是原子的重新组合,原子是化学变化的最小微粒; 核聚变中原子发生了变化,故核聚变不属于化学变化。
3.错误。11H与12H二者属于同位素;OH-与Na+二者不属于同位素。中子数不同而质子数相同的原子一定互为同位素。
4.正确。
突破·关键能力
教考衔接
典例1 答案:B
典例2 解析:1022Ne和1020Ne的质子数相同,中子数不同,属于不同的核素,互为同位素,不互为同素异形体,A、C项错误,B项正确;1022Ne转变为1020Ne,没有新物质生成,不是化学变化,D项错误。
答案:B
对点演练
1.解析:23He比24He少一个中子,A错误;不能确定核素的原子百分含量,因此不能计算氦元素的近似相对原子质量,B错误;一个原子的真实质量与一个612C原子质量的112的比值是该核素的相对原子质量,因此23He的相对原子质量为12ba,C正确;23He的摩尔质量为bNA g·ml-1,D错误。
答案:C
2.解析:111H、12H分别是氢元素的一种核素;11H、12H是质子数相同而中子数不同的氢元素的不同原子,它们互称为同位素。
(2)168O2和168O3是同种元素组成的不同单质,互为同素异形体。
32656Fe2+的中子数为56-26=30,核外电子数为26-2=24。
答案:(1)核素 同位素 (2)168O2、168O3
(3)30 24 (4)7 5
考点二
夯实·必备知识
1.(1)K L M N 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f 1 1 3 1 3 5 1 3 5 7 1 4 9 16 2 8 18 32 (2)③相等 (3)球 哑铃 3
2.(2)吸收 发射
3.(3)1s22s22p63s23p4 [Ne]3s23p4 3s23p4
易错诊断
1.正确。
2.错误。违反的是泡利不相容原理。
3.错误。根据洪特规则,基态原子应为,此状态的原子能量才处于最低状态。
4.正确。
突破·关键能力
教考衔接
典例1 解析:电子排布式分别为:①[Ne]3s23p2、②[Ne]3s23p1、③[Ne]3s23p14s1,可推知分别为基态Si原子、Si+离子、激发态Si原子。
答案:①② ③
典例2 解析:(1)在KH2PO4的四种组成元素各自所能形成的简单离子分别为H+(或H-)、O2-、K+和P3-,其中核外电子排布相同的是K+和P3-。
(2)对于基态的磷原子,其价电子排布式为3s23p3,其中3s轨道的2个电子自旋状态相反,自旋磁量子数的代数和为0;根据洪特规则可知,其3p轨道的3个电子的自旋状态相同,因此,基态磷原子的价电子的自旋磁量子数的代数和为+32或-32。
答案:(1)K+和P3- (2)+32或-32
对点演练
1.解析:根据核外电子排布规律可知Li的基态原子核外电子排布式为1s22s1,则④中能量最低;选项③中有2个电子处于2p能级上,能量最高。
答案:④ ③
2.答案:(1)N
(2)Cu 1s22s22p63s23p63d104s1(或[Ar]3d104s1)
(3)Fe 1s22s22p63s23p63d64s2(或[Ar]3d64s2)
3.答案:(1)发射光谱
(2)电子由较高能量的激发态跃迁到较低能量的激发态或基态时,以光的形式释放能量
4.解析:(1)基态F原子共有9个核外电子,则每个电子都有对应的轨道和自旋状态,所以核外电子的运动状态有9种。
(2)基态Ti原子核外电子排布式为1s22s22p63s23p63d24s2,价层电子排布式为3d24s2;s轨道有一种空间运动状态,p轨道有三种空间运动状态,d轨道有五种空间运动状态,3d轨道只有两个电子,有两种空间运动状态,因此基态Ti原子的核外电子的空间运动状态有12种;核外有22个电子,就有22种运动状态。
(4)基态Cu原子核外电子排布式为[Ar]3d104s1,基态Cu原子核外有几个轨道,其核外电子就有几种空间运动状态,则基态Cu原子核外电子的空间运动状态有1+1+3+1+3+5+1=15种。
答案:(1)9 (2)3d24s2 12 22 (3)4 洪特规则 (4)15
5.解析:(1)Ti位于第四周期,Ti基态原子未成对电子数是2,与钛同周期的所有元素的基态原子中,未成对电子数与钛相同的元素有Ni、Ge、Se。
(3)基态铬原子价层电子排布式为3d54s1,核外有6个未成对电子,基态镍原子价层电子排布式为3d84s2,核外有2个未成对电子,则铬与镍的基态原子核外未成对电子数之比为3∶1。
答案:(1)1 4d25s2 3 (2)4 (3)3∶1
(4) (5)5
核素
23592U
146C
21H
31H
188O
用途
核燃料
用于考古断代
制氢弹
示踪原子
能层(n)
一
二
三
四
能层符号
____
____
____
____
____
____
____
____
____
____
能级符号
____
____
____
____
____
____
____
____
____
____
各能级原
子轨道数
____
____
____
____
____
____
____
____
____
____
各能层原
子轨道数
____
____
____
____
最多容纳
电子数
____
____
____
____
电子排布式
________________
简化电子排布式
________________
价层电子排布式
________________
价层电子轨道表示式
(电子排布图)
________________
未成对电子数
1
2
3
4
5
6
元素
K、Sc、Cu、Ga、Br
Ti、Ni、Ge、Se
V、C、As
Fe
Mn
Cr
2025届高中化学全程复习学案全套60卤代烃 醇 酚: 这是一份2025届高中化学全程复习学案全套60卤代烃 醇 酚,共13页。学案主要包含了师说·助学,易错诊断,教考衔接,对点演练,师说·延伸等内容,欢迎下载使用。
2025届高中化学全程复习学案全套22氨和铵盐: 这是一份2025届高中化学全程复习学案全套22氨和铵盐,共13页。学案主要包含了师说·助学,易错诊断,教考衔接,师说·延伸,对点演练,要点归纳,典题示例等内容,欢迎下载使用。
2025届高中化学全程复习学案全套28化学键: 这是一份2025届高中化学全程复习学案全套28化学键,共6页。学案主要包含了教考衔接,师说·延伸,对点演练,易错诊断等内容,欢迎下载使用。












