

所属成套资源:2025届高中化学全程复习学案
2025届高中化学全程复习学案全套54难溶电解质的溶解平衡
展开
这是一份2025届高中化学全程复习学案全套54难溶电解质的溶解平衡,共11页。
2.理解溶度积(Ksp)的含义,能进行相关的计算。
3.了解沉淀的生成、溶解与转化,并能应用化学平衡原理解释。
考点一 沉淀溶解平衡
1.在20 ℃时,物质的溶解度与溶解性的关系
2.沉淀溶解平衡
(1)概念:在一定温度下,当难溶强电解质溶于水形成饱和溶液时,溶解速率和生成沉淀速率相等的状态。
(2)影响沉淀溶解平衡的因素
①内因:难溶电解质本身的性质。
②外因[以AgCl(s)⇌Ag+(aq)+Cl-(aq) ΔH>0为例]:
【易错诊断】 判断正误,错误的说明理由。
1.升高温度,沉淀溶解平衡一定正向移动:________________________________________________________________________
________________________________________________________________________。
2.相同温度下,AgCl在水中的溶解能力与在NaCl溶液中的相同:________________________________________________________________________
________________________________________________________________________。
3.难溶电解质达到沉淀溶解平衡时,增加难溶电解质的量,平衡向溶解方向移动:________________________________________________________________________
________________________________________________________________________。
4.为减少洗涤过程中固体的损耗,最好选用稀H2SO4代替H2O来洗涤BaSO4沉淀:________________________________________________________________________
________________________________________________________________________。
【教考衔接】
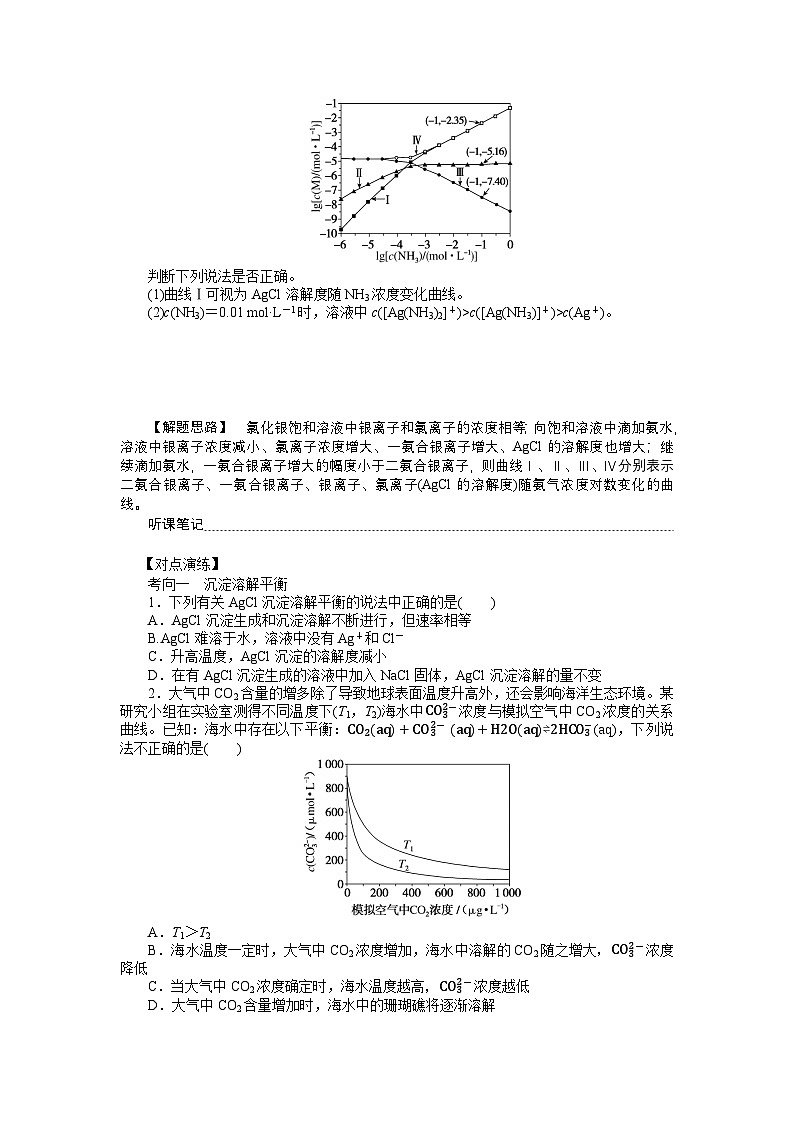
典例 [2023·新课标卷,13A、D改编]向AgCl饱和溶液(有足量AgCl固体)中滴加氨水,发生反应Ag++NH3⇌[Ag(NH3)]+和[Ag(NH3)]++NH3⇌[Ag(NH3)2]+,lg[c(M)/(ml·L-1)]与lg[c(NH3)/(ml·L-1)]的关系如图所示(其中M代表Ag+、Cl-、AgNH3+或[Ag(NH3)2]+)。
判断下列说法是否正确。
(1)曲线Ⅰ可视为AgCl溶解度随NH3浓度变化曲线。
(2)c(NH3)=0.01 ml·L-1时,溶液中c([Ag(NH3)2]+)>c([Ag(NH3)]+)>c(Ag+)。
【解题思路】 氯化银饱和溶液中银离子和氯离子的浓度相等;向饱和溶液中滴加氨水,溶液中银离子浓度减小、氯离子浓度增大、一氨合银离子增大、AgCl的溶解度也增大;继续滴加氨水,一氨合银离子增大的幅度小于二氨合银离子,则曲线Ⅰ、Ⅱ、Ⅲ、Ⅳ分别表示二氨合银离子、一氨合银离子、银离子、氯离子(AgCl的溶解度)随氨气浓度对数变化的曲线。
听课笔记
【对点演练】
考向一 沉淀溶解平衡
1.下列有关AgCl沉淀溶解平衡的说法中正确的是( )
A.AgCl沉淀生成和沉淀溶解不断进行,但速率相等
B.AgCl难溶于水,溶液中没有Ag+和Cl-
C.升高温度,AgCl沉淀的溶解度减小
D.在有AgCl沉淀生成的溶液中加入NaCl固体,AgCl沉淀溶解的量不变
2.大气中CO2含量的增多除了导致地球表面温度升高外,还会影响海洋生态环境。某研究小组在实验室测得不同温度下(T1,T2)海水中CO32-浓度与模拟空气中CO2浓度的关系曲线。已知:海水中存在以下平衡:CO2aq+CO32- aq+H2Oaq⇌2HCO3-(aq),下列说法不正确的是( )
A.T1>T2
B.海水温度一定时,大气中CO2浓度增加,海水中溶解的CO2随之增大,CO32-浓度降低
C.当大气中CO2浓度确定时,海水温度越高,CO32-浓度越低
D.大气中CO2含量增加时,海水中的珊瑚礁将逐渐溶解
考向二 沉淀溶解平衡的实验探究
3.为研究沉淀的生成及转化,某小组进行如下实验。关于该实验的分析不正确的是( )
A.①浊液中存在平衡:
AgSCN(s)⇌Ag+(aq)+SCN-(aq)
B.②中颜色变化说明上层清液中含有SCN-
C.③中颜色变化说明有AgI生成
D.该实验可以证明AgI比AgSCN更难溶
考点二 溶度积常数及其应用
1.溶度积和离子积
(1)以AmBn(s)⇌mAn+(aq)+nBm-(aq)为例。
(2)应用:在一定条件下,判断沉淀能否生成或溶解。
①Q>Ksp:溶液过饱和,有________析出;
②Q=Ksp:溶液饱和,处于________状态;
③Qc(Ag+),故正确。
答案:(1)错误 (2)正确
对点演练
1.解析:A项:沉淀溶解平衡是动态平衡,A项正确;B项:AgCl在水中存在溶解平衡,溶液中有极少量的Ag+和Cl-,B项错误;C项:通常固体的溶解度随温度的升高而增大(氢氧化钙等除外),C项错误;D项:加入NaCl固体,增大Cl-浓度,使AgCl(s)⇌Ag+(aq)+Cl-(aq)的平衡左移,析出氯化银沉淀,因此AgCl沉淀溶解的量减少,D项错误。
答案:A
2.解析:升高温度可以使HCO eq \\al(\s\up1(-),\s\d1(3)) 分解,海水中的CO eq \\al(\s\up1(2-),\s\d1(3)) 浓度增加;当CO2浓度一定时,T1温度下的海水中CO eq \\al(\s\up1(2-),\s\d1(3)) 浓度更高,因而T1>T2,A正确、C错误;观察图像可知,随CO2浓度增加,海水中的CO eq \\al(\s\up1(2-),\s\d1(3)) 浓度下降,B正确;珊瑚礁的主要成分是CaCO3,CaCO3的沉淀溶解平衡方程式为CaCO3(s)⇌Ca2+(aq)+CO eq \\al(\s\up1(2-),\s\d1(3)) (aq),若海水中的CO eq \\al(\s\up1(2-),\s\d1(3)) 浓度下降,会导致平衡正向移动,珊瑚礁会逐渐溶解,D正确。
答案:C
3.解析:A项,根据信息,白色沉淀是AgSCN,存在沉淀溶解平衡:AgSCN(s)⇌Ag+(aq)+SCN-(aq),故说法正确;B项,取上层清液,加入Fe3+出现红色溶液,说明生成Fe(SCN)3,说明溶液中含有SCN-,故说法正确;C项,AgI是黄色沉淀,现象是产生黄色沉淀,说明有AgI产生,故说法正确;D项,可能是c(I-)·c(Ag+)>Ksp,出现沉淀,故说法错误。
答案:D
考点二
夯实·必备知识
1.(2)①沉淀 ②平衡
易错诊断
1.错误。AB2与CD的离子个数比不同,不能直接用沉淀溶度积常数比较它们的溶解度。
2.正确。
3.正确。
4.错误。温度升高,有的溶度积常数Ksp增大,有的减小。
突破·关键能力
教考衔接
典例 解析:(1)由题图可知,c(NH3)=10-1ml·L-1时,c(Cl-)=10-2.35ml·L-1, c(Ag+)=10-7.40ml·L-1,则氯化银的溶度积为10-2.35×10-7.40=10-9.75。
(2)由题图可知,氨分子浓度对数为-1时,溶液中二氨合银离子和一氨合银离子的浓度分别为10-2.35ml·L-1和10-5.16ml·L-1,则[Ag(NH3)]++NH3⇌[Ag(NH3)2]+的平衡常数K= eq \f(c[Ag(NH3)2]+,c[Ag(NH3)]+·c(NH3)) = eq \f(10-2.35,10-5.16×10-1) =103.81。
答案:(1)10-9.75 (2)103.81
对点演练
1.解析:生成的硫化氢会与硝酸银溶液反应生成硫化银沉淀,没有沉淀的转化,无法判断Ksp(AgCl)、Ksp(Ag2S)的大小,A错误;AgNO3溶液过量,KI直接与AgNO3反应,无法判断Ksp(AgCl)与Ksp(AgI)的大小关系,B错误;溶度积常数大的物质能转化为溶度积常数小的物质,AgI悬浊液中滴入Na2S溶液,固体变黑,Ag2S与AgI虽属于不同类型的沉淀,但Ksp(Ag2S)与Ksp(AgI)相差较大,故可以直接比较大小,说明Ksp(Ag2S)<Ksp(AgI),C错误;难溶的物质先沉淀出来,说明Ksp(CuS)<Ksp(ZnS),D正确。
答案:D
2.答案:c(Ag+)= eq \f(0.03 ml·L-1×1.00 L,1.00 L+0.50 L) =0.02 ml·L-1,
c(Cl-)= eq \f(0.06 ml·L-1×2×0.50 L,1.00 L+0.50 L) =0.04 ml·L-1,
Q=c(Ag+)·c(Cl-)=0.02×0.04=8.0×10-4>Ksp,所以有AgCl沉淀生成。
3.解析:(1)根据题给信息,当c(Cu2+)·c2(OH-)=2×10-20时开始出现沉淀,则c(OH-)= eq \r(\f(2×10-20,0.02)) ml·L-1=10-9 ml·L-1,c(H+)=10-5 ml·L-1,pH=5,所以要生成Cu(OH)2沉淀,应调整pH>5。
(2)要使Cu2+浓度降至 eq \f(0.2 ml·L-1,1 000) =2×10-4 ml·L-1,c(OH-)= eq \r(\f(2×10-20,2×10-4)) ml·L-1=10-8 ml·L-1,c(H+)=10-6 ml·L-1,此时溶液的pH=6。
答案:(1)5 (2)6
4.答案:三种阴离子浓度均为0.01 ml·L-1时,分别产生AgCl、AgBr和Ag2CrO4沉淀,所需要Ag+浓度依次为
c1(Ag+)= eq \f(Ksp(AgCl),c(Cl-)) = eq \f(1.56×10-10,0.01) ml·L-1=1.56×10-8 ml·L-1,
c2(Ag+)= eq \f(Ksp(AgBr),c(Br-)) = eq \f(7.7×10-13,0.01) ml·L-1=7.7×10-11 ml·L-1,
c3(Ag+)= eq \r(\f(Ksp(Ag2CrO4),c(CrO eq \\al(\s\up1(2-),\s\d1(4)) ))) = eq \r(\f(9.0×10-12,0.01)) ml·L-1=3×10-5 ml·L-1,沉淀时Ag+浓度最小的优先沉淀,因而沉淀的顺序为Br-、Cl-、CrO eq \\al(\s\up1(2-),\s\d1(4)) 。
5.答案:在CaCO3的饱和溶液中c(Ca2+)= eq \r(Ksp(CaCO3)) = eq \r(2.8×10-9) ml·L-1≈5.3×10-5 ml·L-1,若向CaCO3饱和溶液中加入Na2SO4溶液,产生CaSO4(s)时SO eq \\al(\s\up1(2-),\s\d1(4)) 的最小浓度为c(SO eq \\al(\s\up1(2-),\s\d1(4)) )= eq \f(Ksp(CaSO4),c(Ca2+)) = eq \f(9.1×10-6,5.3×10-5) ≈0.17 ml·L-1,则当溶液中c(SO eq \\al(\s\up1(2-),\s\d1(4)) )大于0.17 ml·L-1时,CaCO3(s)可以转化为CaSO4(s)。
6.解析:同一溶液中c(Ag+)相等, eq \f(c(I-),c(Cl-)) = eq \f(c(I-)·c(Ag+),c(Cl-)·c(Ag+)) = eq \f(Ksp(AgI),Ksp(AgCl)) = eq \f(8×10-17,1.6×10-10) =5×10-7。
答案:5×10-7
7.解析:(1)若终点时c(CrO eq \\al(\s\up1(2-),\s\d1(4)) )=1.1×10-4ml·L-1,Ksp(Ag2CrO4)=c2(Ag+)·c(CrO eq \\al(\s\up1(2-),\s\d1(4)) )=1.1×10-12,c(Ag+)=10-4 ml·L-1,Ksp(AgCl)=c(Ag+)·c(Cl-)=1.8×10-10,c(Cl-)=1.8×10-6ml·L-1。
(2)n(AgNO3)=0.200 0 ml·L-1×0.021 L=0.004 2 ml,25.00 mL溶液中n(KCl)总=n(AgNO3)=0.004 2 ml,n(KClO4)+n(KCl)=0.004 2 ml,n(KClO4)×138.5 g·ml-1+n(KCl)×74.5 g·ml-1=0.568 90 g,解得n(KClO4)=0.004 0 ml,n(KClO4)总=0.004 0 ml× eq \f(250 mL,25.00 mL) =0.040 ml,其纯度为 eq \f(0.040 ml×138.5 g·ml-1,5.689 g) ×100%≈97.38%。
答案:(1)1.8×10-6
(2)97.38%,计算过程见解析
考点三
夯实·必备知识
1.(2)Cu(OH)2 CuCO3 Cu2(OH)2CO3 氨水 Na2S
2.(2)②Mg(OH)2+2NH eq \\al(\s\up1(+),\s\d1(4)) ===Mg2++2NH3·H2O
③3Ag2S+8HNO3(稀)===6AgNO3+2NO↑+3S+4H2O
④AgCl+2NH3·H2O===[Ag(NH3)2]++Cl-+2H2O
3.(2)①CaSO4(s)+CO eq \\al(\s\up1(2-),\s\d1(3)) (aq)⇌CaCO3(s)+SO eq \\al(\s\up1(2-),\s\d1(4)) (aq)
②ZnS(s)+Cu2+(aq)⇌CuS(s)+Zn2+(aq)
突破·关键能力
教考衔接
典例 解析:根据图像,由(1.7,5)可得到Ag2CrO4的溶度积Ksp(Ag2CrO4)=c2(Ag+)·c(CrO eq \\al(\s\up1(2-),\s\d1(4)) )=(1×10-5)2×1×10-1.7=10-11.7。由(4.8,5)可得到AgCl的溶度积Ksp(AgCl)=c(Ag+)·c(Cl-)=1×10-5×1×10-4.8=10-9.8,据此数据计算各选项结果。
假设a点坐标为(4,6.5),此时分别计算反应的浓度熵Q得,Q(AgCl)=10-10.5,Q(Ag2CrO4)=10-17,二者的浓度熵均小于其对应的溶度积Ksp,二者不会生成沉淀,A错误;Ksp为难溶物的溶度积,是一种平衡常数,平衡常数只与温度有关,与浓度无关,根据分析可知,二者的溶度积不相同,B错误;该反应的平衡常数表达式为K= eq \f(c(CrO eq \\al(\s\up1(2-),\s\d1(4)) ),c2(Cl-)) ,将表达式转化为与两种难溶物的溶度积有关的式子得K= eq \f(c(CrO eq \\al(\s\up1(2-),\s\d1(4)) ),c2(Cl-)) = eq \f(c(CrO eq \\al(\s\up1(2-),\s\d1(4)) )·c2(Ag+),c2(Cl-)·c2(Ag+)) = eq \f(Ksp(AgCrO4),K eq \\al(\s\up1(2),\s\d1(sp)) (AgCl)) = eq \f(1×10-11.7,(1×10-9.8)2) =1×107.9,C正确;向NaCl、Na2CrO4均为0.1 ml·L-1的混合溶液中滴加AgNO3,开始沉淀时所需要的c(Ag+)分别为10-8.8和10-5.35,说明此时沉淀Cl-需要的银离子浓度更低,在这种情况下,先沉淀的是AgCl,D错误;故答案选C。
答案:C
对点演练
1.解析:碳酸钡能与胃酸反应生成可溶性钡盐,钡离子有毒,所以不能用碳酸钡作为内服造影剂,A错误;用0.36 ml·L-1的Na2SO4溶液给钡离子中毒者洗胃,反应后c(Ba2+)= eq \f(1.1×10-10,0.36) ml·L-1≈3.1×10-10 ml·L-1< eq \r(1.1×10-10) ml·L-1,B正确;碳酸钡与胃酸反应转化为可溶性钡盐,起不到解毒的作用,C错误;饱和BaSO4溶液中c(Ba2+)= eq \r(Ksp(BaSO4)) = eq \r(1.1×10-10) ml·L-1>1.0×10-5 ml·L-1,所以误饮c(Ba2+)=1.0×10-5 ml·L-1的溶液时,不会引起钡离子中毒,D错误。
答案:B
2.答案:(1)已知:①Cu+Cu2+⇌2Cu+ K=7.6×10-7;②CuCl(s)===Cl-(aq)+Cu+(aq) Ksp=2.0×10-6;则①-2×②得:Cu+Cu2++2Cl-⇌2CuCl,此反应的平衡常数为 eq \f(K,[Ksp(CuCl)]2) = eq \f(7.6×10-7,4.0×10-12) =1.9×105,说明此反应进行程度很大,能够完全进行
(2)若pH过低,锌会与溶液中的氢离子反应
3.答案:(1)BaCO3(s)⇌Ba2+(aq)+CO eq \\al(\s\up1(2-),\s\d1(3)) (aq),HCl===H++Cl-,2H++CO eq \\al(\s\up1(2-),\s\d1(3)) ===H2O+CO2↑,胃酸中盐酸电离的H+与BaCO3产生的CO eq \\al(\s\up1(2-),\s\d1(3)) 结合生成CO2和H2O,破坏了BaCO3的溶解平衡,c(Ba2+)增大,引起人体中毒。
(2)用水洗涤AgCl,AgCl(s)⇌Ag+(aq)+Cl-(aq)平衡右移,AgCl的质量减少,用盐酸洗涤AgCl,稀释的同时HCl电离产生的Cl-会使平衡左移,AgCl减少的质量要小些。
外界条件
移动方向
平衡后c(Ag+)
平衡后c(Cl-)
Ksp
升高温度
____
____
____
____
加水稀释
____
____
____
____
加入少量AgNO3
____
____
____
____
通入HCl
____
____
____
____
通入H2S
____
____
____
____
溶度积
离子积
概念
沉淀溶解的平衡常数
溶液中有关离子浓度幂的乘积
符号
Ksp
Q
表达式
Ksp(AmBn)=cm(An+)·cn(Bm-),式中的浓度都是平衡浓度
Q(AmBn)=cm(An+)·cn(Bm-),式中的浓度都是任意浓度
选项
操作
现象
结论
A
将稀硫酸和Na2S反应生成的气体通入AgNO3与AgCl组成的悬浊液中
出现黑色沉淀
Ksp(AgCl)>Ksp(Ag2S)
B
向盛有2 mL 0.1 ml·L-1 AgNO3溶液的试管中滴加1 mL 0.1 ml·L-1 NaCl溶液,再向其中滴加4~5滴0.1 ml·L-1KI溶液
先有白色沉淀生成,后又产生黄色沉淀
Ksp(AgCl)>Ksp(AgI)
C
向AgI悬浊液中滴入Na2S溶液
固体变黑
Ksp(Ag2S)>Ksp(AgI)
D
将H2S气体通入浓度均为0.01 ml·L-1的ZnSO4和CuSO4溶液中
先出现CuS黑色沉淀
Ksp(CuS)
相关学案
这是一份2025届高中化学全程复习学案全套60卤代烃 醇 酚,共13页。学案主要包含了师说·助学,易错诊断,教考衔接,对点演练,师说·延伸等内容,欢迎下载使用。
这是一份2025届高中化学全程复习学案全套44化学平衡移动,共8页。学案主要包含了师说·助学,易错诊断,教考衔接,对点演练等内容,欢迎下载使用。
这是一份2025届高中化学全程复习学案全套51盐类的水解,共10页。学案主要包含了师说·助学,易错诊断,教考衔接,师说·延伸,对点演练,要点归纳,典题示例等内容,欢迎下载使用。









