




2025届高中化学全程复习构想课件全套48弱电解质的电离平衡
展开1. 理解弱电解质在水溶液中的电离平衡。2.理解电离常数的含义,掌握电离常数的应用并能进行相关计算。
考点一 弱电解质的电离平衡1.电离平衡在一定条件(如温度、浓度)下,当电离的速率和离子结合为分子的速率相等时,电离过程就达到了平衡状态。
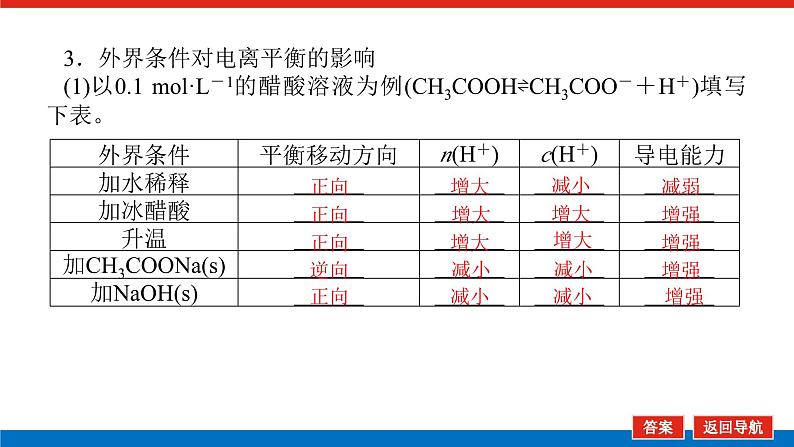
3.外界条件对电离平衡的影响(1)以0.1 ml·L-1的醋酸溶液为例(CH3COOH⇌CH3COO-+H+)填写下表。
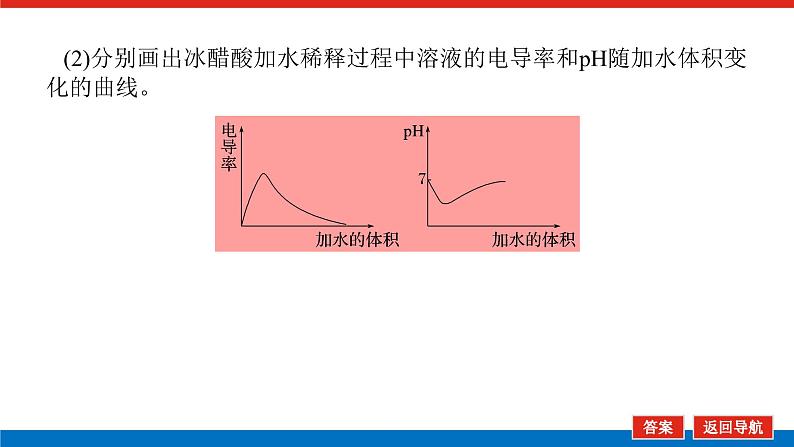
(2)分别画出冰醋酸加水稀释过程中溶液的电导率和pH随加水体积变化的曲线。
3.室温下,由0.1 ml·L-1一元碱BOH溶液的pH=10,可知溶液中存在BOH===B++OH-:________________________________________________________。4.稀释弱电解质溶液时,所有粒子浓度都一定会减小:________________________________________________________。
错误。若BOH为强碱,0.1 ml·L-1 BOH溶液的pH=13。pH=10说明BOH为弱碱,其电离方程式应为BOH⇌B++OH-。
错误。以醋酸溶液为例,稀释时c(H+)、c(CH3COO-)、c(CH3COOH) 减小, c(OH-)增大。
【教考衔接】典例[2023·浙江1月,13改编]甲酸(HCOOH)是重要的化工原料。工业废水中的甲酸及其盐,通过离子交换树脂(含固体活性成分R3N,R为烷基)因静电作用被吸附回收,其回收率(被吸附在树脂上甲酸根的物质的量分数)与废水初始pH关系如图(已知甲酸Ka=1.8×10-4)。
判断下列说法是否正确, 正确的打“√”,错误的打“×”。(1)活性成分R3N在水中存在平衡:R3N+H2O⇌R3NH++OH-( )(2)废水初始pH<2.4,随pH下降,甲酸的电离被抑制,与R3NH+作用的HCOO-数目减少( )(3)废水初始pH>5,离子交换树脂活性成分主要以R3NH+形态存在( )
解析:(1)由题意“因静电作用被吸附”及题图可知,R3N在溶液中的电离方程式为R3N+H2O⇌R3NH++OH-。(2)由题图可知,溶液pH为2.4时,废水中的甲酸及其盐回收率最高,当溶液中pH小于2.4时,随溶液pH下降,溶液中氢离子浓度增大,甲酸的电离被抑制,溶液中甲酸根离子浓度减小,与R3NH+作用的数目减小。(3)由题图可知,R3N溶液呈碱性,溶液中存在如下平衡R3N+H2O⇌R3NH++OH-,当废水初始pH大于5时,平衡向左移动,离子交换树脂活性成分主要以R3N形态存在。
【师说·延伸】 ①破解“因静电作用被吸附”是解答本题的灵魂:R3N在水中能产生阳离子,产生的阳离子静电吸附HCOO-。②联想水的电离“H2O+H2O⇌H3O++OH-”是解答本题的关键:通过推理并验证R3N在水溶液中的电离方程式R3N+H2O⇌R3NH++OH-。
【对点演练】1.H2S水溶液中存在电离平衡H2S⇌H++HS-和HS-⇌H++S2-。若对H2S溶液进行以下操作,说法正确的是( )A.加水,平衡向右移动,溶液中氢离子浓度增大B.通入过量SO2气体,平衡向左移动,溶液pH增大C.滴加新制氯水,平衡向左移动,溶液pH减小D.加入少量硫酸铜固体(忽略体积变化),溶液中所有离子浓度都减小
解析:加水促进H2S的电离,由于溶液体积增大,氢离子浓度减小,A项错误;通入SO2气体,发生反应:2H2S+SO2===3S↓+2H2O,pH增大;当SO2过量,溶液显酸性,因H2SO3酸性比H2S强,故pH减小,B项错误;滴加新制氯水,发生反应Cl2+H2S===2HCl+S↓,平衡向左移动,生成了强酸,溶液pH减小,C项正确;加入少量硫酸铜固体,发生反应H2S+Cu2+===CuS↓+2H+,H+浓度增大,D项错误。
2.能证明蚁酸(HCOOH)是弱酸的实验事实是( )A.HCOOH溶液与Zn反应放出H2B.0.1 ml·L-1 HCOOH溶液可使紫色石蕊溶液变红C.HCOOH溶液与Na2CO3反应生成CO2D.常温时0.1 ml·L-1 HCOOH溶液的pH=2.3
解析:A、B项,只能证明蚁酸具有酸性,不能证明其酸性强弱,错误;C项,只能证明蚁酸的酸性比碳酸强,错误;D项,溶液的pH=2.3,说明HCOOH未完全电离,正确。
3.常温下,①100 mL 0.01 ml·L-1的CH3COOH溶液,②10 mL 0.1 ml·L-1的CH3COOH溶液。用“>”“=”或“<”填写下列问题。(1)c(CH3COO-):①________②。(2)电离程度:①________②。(3)在上述两种溶液中加入足量锌片。开始时的反应速率:①________②,反应结束生成相同状况下H2的体积:①________②。(4)与同浓度的NaOH溶液完全反应消耗NaOH溶液的体积:①________②。
错误。对同一弱电解质溶液,稀释后电离度增大,但电离常数不变。
【教考衔接】典例1 [2023·浙江1月,13B改编]甲酸(HCOOH)是重要的化工原料。工业废水中的甲酸及其盐,通过离子交换树脂(含固体活性成分R3N,R为烷基)因静电作用被吸附回收,其回收率(被吸附在树脂上甲酸根的物质的量分数)与废水初始pH关系如图(已知甲酸Ka=1.8×10-4)。pH=5的废水中c(HCOO-)∶c(HCOOH)=____________。
1012·Ka1 1024·Ka1·Ka2
【对点演练】考向一 利用电离常数判断弱电解质(酸碱性)的相对强弱1.部分弱酸的电离平衡常数如下表:
HCOOH>H2CO3>H2S>HClO
确定微粒浓度比值变化情况的三种方法(1)“转化法”。将浓度之比转化为物质的量之比进行比较。(2)“假设法”。如上述问题(3),假设无限稀释,c(CH3COO-)趋近于0,c(H+)趋于10-7 ml·L-1,故比值变小。(3)“凑常数”。解题时将某些粒子的浓度比值乘以或除以某种粒子的浓度,转化为一个常数与某种粒子浓度的乘积或相除的关系。
【典题示例】典例1 已知饱和硫化氢的浓度为0.1 ml·L-1,硫化氢的电离常数为Ka1=1.0×10-7,Ka2=1.0×10-19。计算饱和硫化氢溶液中氢离子的浓度。
典例2 计算25 ℃时,2 ml·L-1氨水的电离度(已知25 ℃时,Kb=1.8×10-5)。
典例3 常温下,向20 mL 0.010 ml·L-1的HA溶液中逐滴加入0.010 ml·L-1的NaOH溶液,溶液中lg c(OH-)与所加NaOH溶液的体积(V)的关系如图。(1)判断HA为________(填“强”或“弱”)酸。(2)若HA为弱酸,请计算在P点的电离平衡常数。
【对点演练】1.已知25 ℃时,测得浓度为0.1 ml·L-1的BOH溶液中,c(OH-)=1×10-3 ml·L-1。(1)写出BOH的电离方程式:________________。(2)BOH的电离度α=______。(3)BOH的电离平衡常数Kb=________。
3.(1)常温下,向a ml·L-1 CH3COONa溶液中滴加等体积的b ml·L-1盐酸使溶液呈中性(不考虑盐酸和醋酸的挥发),则醋酸的电离常数Ka=______(用含a和b的代数式表示)。(2)常温下,将a ml·L-1的醋酸与b ml·L-1的Ba(OH)2溶液等体积混合,充分反应后,溶液中存在2c(Ba2+)=c(CH3COO-),则该混合溶液中醋酸的电离常数Ka=________(用含a和b的代数式表示)。
5.已知亚磷酸(H3PO3)为二元弱酸,常温下,向某浓度的亚磷酸溶液中逐滴加入一定物质的量浓度的KOH溶液,混合溶液的pH与离子浓度的关系如图所示。
化学选择性必修1第一单元 弱电解质的电离平衡课前预习ppt课件: 这是一份化学选择性必修1第一单元 弱电解质的电离平衡课前预习ppt课件,共12页。PPT课件主要包含了学习目标,交流讨论,电离平衡有哪些特征,课堂探究,课堂小结,课堂巩固,课堂练习等内容,欢迎下载使用。
高中化学选修三--全套课件: 这是一份高中化学选修三--全套课件,共60页。PPT课件主要包含了原子的诞生,地球中的元素,原子的认识过程,能层与能级,注意问题,构造原理,电子排布式,电子云,原子轨道,泡利原理等内容,欢迎下载使用。
2023届高中化学一轮复习课件:弱电解质的电离平衡: 这是一份2023届高中化学一轮复习课件:弱电解质的电离平衡,共40页。PPT课件主要包含了离子结合成分子,结合成弱电解质分子,考点电离平衡常数,构建核心价值等内容,欢迎下载使用。












