





2025届高中化学全程复习构想课件全套47实际工业生产中图像问题分类突破
展开认识化学反应速率和化学平衡的综合调控在生产、生活和科学研究中的重要作用。
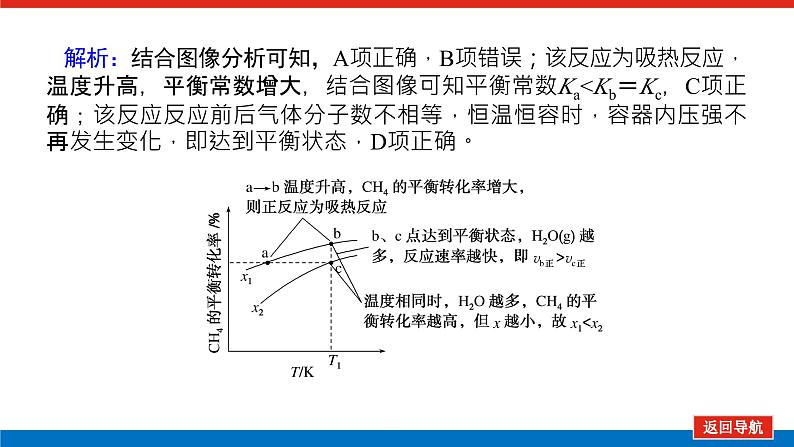
解析:结合图像分析可知,A项正确,B项错误;该反应为吸热反应,温度升高,平衡常数增大,结合图像可知平衡常数Ka
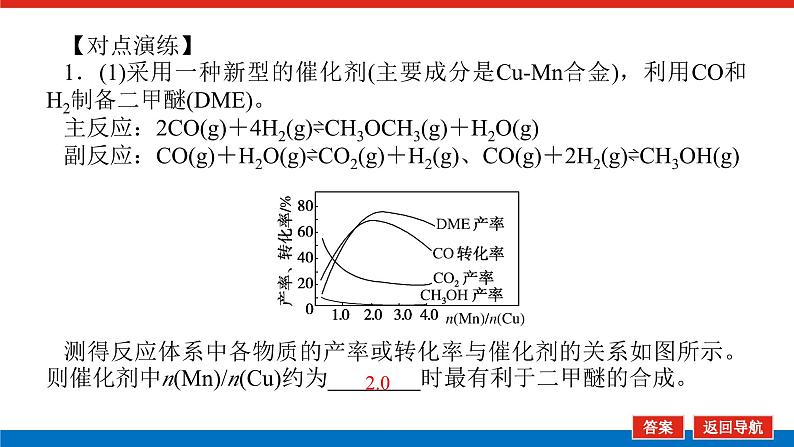
【对点演练】1.(1)采用一种新型的催化剂(主要成分是CuMn合金),利用CO和H2制备二甲醚(DME)。主反应:2CO(g)+4H2(g)⇌CH3OCH3(g)+H2O(g)副反应:CO(g)+H2O(g)⇌CO2(g)+H2(g)、CO(g)+2H2(g)⇌CH3OH(g)测得反应体系中各物质的产率或转化率与催化剂的关系如图所示。则催化剂中n(Mn)/n(Cu)约为________时最有利于二甲醚的合成。
(1)图中m1、m2、m3的大小顺序为________。反应的化学平衡常数Kp表达式为______________(用平衡分压代替平衡浓度表示)。(2)图中A点原料气的成分:n(SO2)=10 ml,n(O2)=24.4 ml,n(N2)=70 ml,达平衡时SO2的分压p(SO2)为________ Pa(分压=总压×物质的量分数)。
类型二 选择性—温度图像【典题示例】典例1 [2023·湖南卷,16(3)]在913 K、100 kPa下,以水蒸气作稀释气。Fe2O3作催化剂,除乙苯脱氢生成苯乙烯外[④C6H5C2H5(g)⇌C6H5CH===CH2(g)+H2(g)],还会发生如下两个副反应:⑤C6H5C2H5(g)⇌C6H6(g)+CH2===CH2(g)⑥C6H5C2H5(g)+H2(g)⇌C6H5CH3(g)+CH4(g)
反应④为主反应,反应⑤⑥为副反应,苯乙烯的选择性最大;在恒温恒压下,随乙苯转化率的增大,反应⑤正向移动,反应⑥不移动,则曲线b代表产物苯
解析:曲线a芳香烃产物的选择性大于曲线b、c芳香烃产物的选择性,反应④为主反应,反应⑤⑥为副反应,则曲线a代表产物苯乙烯的选择性;反应④⑤的正反应为气体分子数增大的反应,反应⑥的正反应是气体分子数不变的反应;在913 K、100 kPa(即恒温恒压)下以水蒸气作稀释气,乙苯的转化率增大,即减小压强,反应④⑤都向正反应方向移动,反应⑥平衡不移动,故曲线b代表的产物是苯。
典例2 [2022·江苏卷,13]乙醇—水催化重整可获得H2。其主要反应为C2H5OH(g)+3H2O(g)===2CO2(g)+6H2(g) ΔH=+173.3 kJ·ml-1,CO2(g)+H2(g)===CO(g)+H2O(g)ΔH=+41.2 kJ·ml-1,在1.0×105 Pa、n始(C2H5OH)∶n始(H2O)=1∶3时,若仅考虑上述反应,平衡时CO2和CO的选择性及H2的产率随温度的变化如图所示。
解析:根据已知反应①C2H5OH(g)+3H2O(g)===2CO2(g)+6H2(g) ΔH=+173.3 kJ·ml-1,反应②CO2(g)+H2(g)===CO(g)+H2O(g) ΔH=+41.2 kJ·ml-1,且反应①的热效应更大,故温度升高对反应①影响更大一些,即CO2选择性增大,同时CO的选择性减小,根据CO的选择性的定义可知③代表CO2的选择性,①代表CO的选择性,②代表H2的产率,A、B错误;两种物质参加反应增大一种物质的浓度,会降低该物质的平衡转化率,C错误;加入CaO(s)与水反应放热,对反应①影响较大,可以增大H2产率,或者选用对反应①影响较大的高效催化剂,也可以增大H2产率,D正确。
下列说法不正确的是( )A.反应2CO(g)+4H2(g)⇌CH3OCH3(g)+H2O(g)的焓变为ΔH2-2ΔH1B.根据图像推测ΔH1>0C.其他条件不变时,温度越高,CO2主要还原产物中碳元素的价态越低D.其他条件不变时,增大体系压强可以提高A点CH3OCH3的选择性
解析:由盖斯定律可知,反应2CO(g)+4H2(g)⇌CH3OCH3(g)+H2O(g)可由Ⅱ-2×Ⅰ得到,其焓变为ΔH2-2ΔH1,A正确;反应Ⅱ为放热反应,升高温度平衡逆向移动,由图可知随着温度的升高,二氧化碳的平衡转化率下降速率小于二甲醚的选择性下降速率,且高于300 ℃时二氧化碳的平衡转化率升高,说明反应Ⅰ正向进行,正反应为吸热反应,ΔH1>0,B正确;由B分析可知,其他条件不变时,温度越高,反应Ⅰ占据主导地位,CO2主要还原产物为CO,CO中碳元素的价态较高,C错误;反应Ⅰ为气体分子数不变的反应,反应Ⅱ为气体分子数减小的反应,其他条件不变时,增大体系压强,导致反应Ⅱ平衡正向移动,可以提高A点CH3OCH3的选择性,D正确。
下列说法正确的是( )A.CO(g)+2H2(g)⇌CH3OH(g)ΔH=+99.8 kJ·ml-1B.曲线a表示CH3OH的选择性随温度的变化C.图中所示270 ℃时,对应CO2的转化率为21%D.在210~250 ℃之间,CH3OH的收率增大是由于CH3OH的选择性增大导致
3.丙烯是制造一次性医用口罩的重要原料。丙烷催化脱氢法是工业生产丙烯的重要途径,丙烷催化脱氢技术主要分为氧化脱氢和直接脱氢两种。回答下列问题:(1)丙烷催化氧化脱氢法制备丙烯的主要反应如下:2C3H8(g)+O2(g) 催化剂2C3H6(g)+2H2O(g) ΔH1=-236 kJ·ml-1(ⅰ)反应过程中消耗的C3H8和 生成的C3H6 的物质的量随温度的变化关系见下表。
升高温度,反应ⅰ的化学平衡逆向移动
(2)丙烷催化直接脱氢反应: C3H8(g)⇌C3H6(g)+H2(g)ΔH2=+124.3 kJ·ml -1(ⅱ) 副反应:C3H8 (g)⇌C2H4 (g)+CH4(g) ΔH3(ⅲ)
温度控制在650 ℃ ,丙烯选择性高,反应速率快,平衡常数较大
下列措施既能提高反应物的平衡转化率,又能增大生成C40H10的反应速率的是________(填标号)。a.升高温度 b.增大压强 c.加入催化剂
解析:由反应历程可知,该反应为吸热反应,升温,反应正向进行,提高了平衡转化率,反应速率也加快,a符合题意;由化学方程式可知,该反应为正向体积增大的反应,加压,反应逆向进行,降低了平衡转化率,b不符合题意;加入催化剂,平衡不移动,不能提高平衡转化率,c不符合题意。
典例2 [2023·浙江1月,19(4)]“碳达峰·碳中和”是我国社会发展重大战略之一,CH4还原CO2是实现“双碳”经济的有效途径之一,相关的主要反应有:Ⅰ:CH4(g)+CO2(g)⇌2CO(g)+2H2(g) ΔH1=+247 kJ·ml-1,K1Ⅱ:CO2(g)+H2(g)⇌CO(g)+H2O(g) ΔH2=+41 kJ·ml-1,K2CH4还原能力(R)可衡量CO2转化效率,R=Δn(CO2)/Δn(CH4)(同一时段内CO2与CH4的物质的量变化量之比)。催化剂X可提高R值,一时段内CH4转化率、R值随温度变化如下表:
下列说法不正确的是________。A.R值提高是由于催化剂X选择性地提高反应Ⅱ的速率B.温度越低,含氢产物中H2O占比越高C.温度升高,CH4转化率增加,CO2转化率降低,R值减小D.改变催化剂提高CH4转化率,R值不一定增大
解析:R值提高是由于催化剂X选择性地提高反应Ⅱ的速率,使单位时间内反应Ⅱ中CO2的转化率增大,Δn(CO2)增大的倍数比Δn(CH4)大,则R提高,选项A正确;根据表中数据可知,温度越低,CH4转化率越小,而R越大,Δn(CO2)增大的倍数比Δn(CH4)大,含氢产物中H2O占比越高,选项B正确;温度升高,CH4转化率增加,CO2转化率也增大,且两个反应中的CO2转化率均增大,增大倍数多,故R值增大,选项C不正确;改变催化剂使反应有选择性按反应Ⅰ进行而提高CH4转化率,若CO2转化率减小,则R值不一定增大,选项D正确。
氨氮物质的量之比为1,温度为400 ℃
在400 ℃时催化剂的活性最好,催化效率最高,同时400 ℃温度较高,反应速率较快
(2)目前,科学家正在研究一种以乙烯作为还原剂的脱硝(NO)原理,其脱硝机理示意图如图2,脱硝率与温度、负载率(分子筛中催化剂的质量分数)的关系如图3所示。①写出该脱硝原理总反应的化学方程式:_______________________________________________________。②为达到最佳脱硝效果,应采取的条件是________________。
350 ℃、负载率3.0%
2025届高中化学全程复习构想课件全套48弱电解质的电离平衡: 这是一份2025届高中化学全程复习构想课件全套48弱电解质的电离平衡,共49页。PPT课件主要包含了考点一,考点二,电离平衡的特征,答案C,答案D,或18∶1,①②④,0×10-6,BOH⇌B++OH-,×10-5等内容,欢迎下载使用。
2025届高中化学全程复习构想课件全套50酸碱中和滴定及拓展应用: 这是一份2025届高中化学全程复习构想课件全套50酸碱中和滴定及拓展应用,共45页。PPT课件主要包含了考点一,考点二,酸式滴定管,碱式滴定管,锥形瓶,粉红色,控制滴定管活塞,摇动锥形瓶,锥形瓶中溶液颜色变化,答案C等内容,欢迎下载使用。
2025届高中化学全程复习构想课件全套51盐类的水解: 这是一份2025届高中化学全程复习构想课件全套51盐类的水解,共54页。PPT课件主要包含了考点一,考点二,答案A,答案B,颜色变深,颜色变浅,盐类水解的应用,HCl气流,答案C,答案BD等内容,欢迎下载使用。












