





2025届高中化学全程复习构想课件全套13铁及其化合物的转化
展开1. 基于价类二维图理解铁及其化合物的转化关系。2.能通过实验探究掌握Fe2+与Fe3+的相互转化。
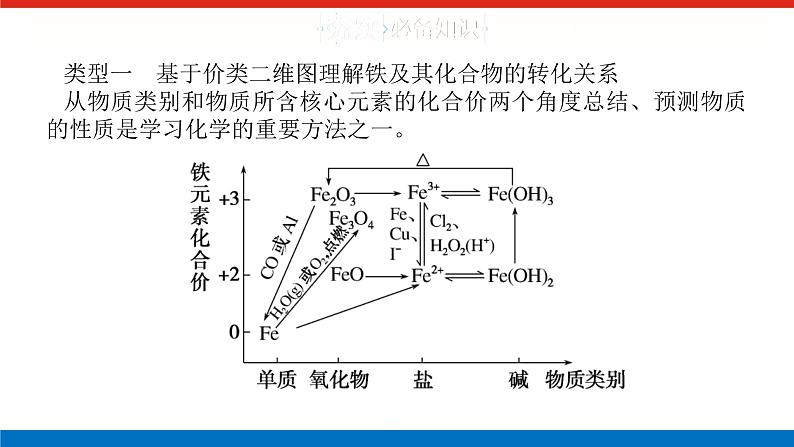
类型一 基于价类二维图理解铁及其化合物的转化关系从物质类别和物质所含核心元素的化合价两个角度总结、预测物质的性质是学习化学的重要方法之一。
(1)横向变化体现了同价态不同物质类别(氧化物、盐、碱)之间的转化①碱性氧化物(Fe2O3、FeO)都能溶于酸(H+)转化为盐;②Fe2+、Fe3+与碱(OH-)反应生成对应的碱;③难溶性的碱易分解生成对应的氧化物,但难溶性的碱性氧化物一般不与水反应生成对应的碱。(2)纵向变化体现不同价态同物质类别之间的转化,主要体现物质的氧化性或还原性。(3)斜向变化体现不同价态、不同物质类别之间的转化,主要体现物质的氧化性和还原性。
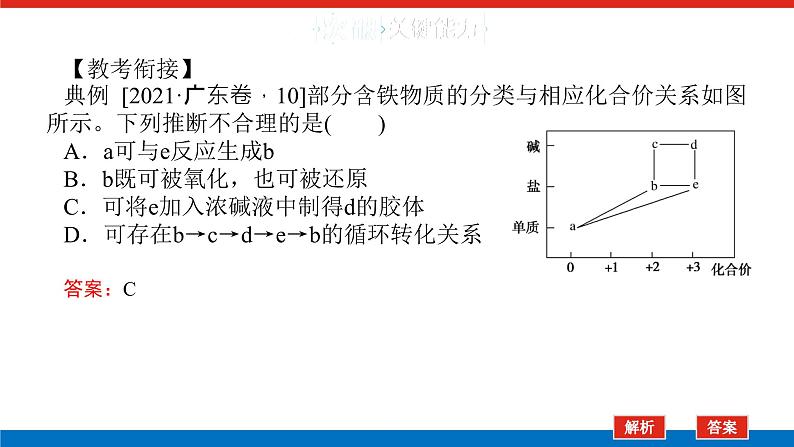
【教考衔接】典例 [2021·广东卷,10]部分含铁物质的分类与相应化合价关系如图所示。下列推断不合理的是( )A.a可与e反应生成bB.b既可被氧化,也可被还原C.可将e加入浓碱液中制得d的胶体D.可存在b→c→d→e→b的循环转化关系
2.铁及其重要化合物在日常生活中应用广泛,其之间的部分转化关系如下图所示。
(1)M的化学式为________,物质类别________。(2)实现①的转化,可选用足量的________(填“稀盐酸”或“NaOH溶液”)。(3)实现③的转化,可选用下列试剂中的________A.O2 B.H2 C.H2SO4 D.HNO3(4)电子工业中,人们常用FeCl3溶液腐蚀覆在绝缘体上的铜箔(Cu)制造印刷电路板。腐蚀后溶液中的阳离子有H+、Fe3+、________、________。确认腐蚀后溶液中存在Fe3+,可选用的试剂为________溶液。
解析:(1)M的化学式为Fe(OH)3,物质类别是碱;(2)铁与稀盐酸反应可生成亚铁离子,该转化的离子反应方程式为:Fe+2H+===Fe2++H2↑;(3)氢氧化亚铁到氢氧化铁需要氧化剂,可选氧气,稀硝酸也有氧化性,但是氢氧化铁与稀硝酸反应,故选A;(4)FeCl3溶液腐蚀覆在绝缘体上的铜箔反应的化学反应方程式为: Cu+2FeCl3===CuCl2+2FeCl2,腐蚀后溶液中的阳离子有H+、Fe3+、Cu2+、Fe2+,为了验证有铁离子存在,可选用试剂为KSCN溶液。
类型二 基于 Fe2+、Fe3+相互转化的实验探究Fe2+与Fe3+相互转化关系如下:
写出下列反应的离子方程式。(1)将H2S气体通入FeCl3溶液中产生淡黄色沉淀:2Fe3++H2S===S↓+2Fe2++2H+。(2)将FeCl3溶液滴入淀粉-KI溶液,溶液变蓝:2Fe3++2I-===I2+2Fe2+。(3)用FeCl3溶液腐蚀废旧线路板上的铜箔:Cu+2Fe3+===2Fe2++Cu2+。(4)将H2O2滴入酸性FeCl2溶液:______________________________。(5)将FeCl2溶液滴入HNO3溶液中,有无色气体放出:_____________________________________。
2Fe2++H2O2+2H+===2Fe3++2H2O
【教考衔接】典例 [2024·北京房山区练习]某同学在实验室进行铁盐与亚铁盐相互转化实验。实验Ⅰ:将Fe3+转化为Fe2+
(1)探究白色沉淀产生的原因,请填写实验方案:查阅资料:已知:①SCN-的化学性质与I-相似;②2Cu2++4I-===2CuI↓+I2。Cu2+与SCN-反应的离子方程式为______________________________________。
4 mL 0.2 ml·L-1 FeSO4溶液
向其中滴加3滴0.1 ml·L-1 KSCN溶液
2Cu2++4SCN-===2CuSCN↓+(SCN)2
解析:(1)由反应2Fe3++Cu===2Fe2++Cu2+,铜粉过量,可知得到的溶液中Fe2+浓度为0.2 ml·L-1,Cu2+为0.1 ml·L-1,分别取相同浓度的硫酸铜溶液、硫酸亚铁溶液,滴入KSCN溶液,验证白色沉淀是由Cu2+还是由Fe2+和SCN-反应生成的;由已知:①SCN-的化学性质与I-相似;②2Cu2++4I-===2CuI↓+I2可知,Cu2+与SCN-反应生成CuSCN沉淀,同时生成(SCN)2,反应的离子方程式为:2Cu2++4SCN-===2CuSCN↓+(SCN)2。
实验Ⅱ:将Fe2+转化为Fe3+(2)用离子方程式解释NO产生的原因_____________________________________。
①分别取三组实验反应后的溶液于三支试管中,____________________________________(填操作步骤及现象),证明生成了Fe2+;分析三组实验结果,实验中均发生的反应的离子方程式为________________________。②对比三组实验,说明加入蒸馏水后沉淀的产生与____________________有关。③向丙组实验后的溶液中加入饱和NaCl溶液可能出现的现象为________________。④丙组在检验反应后的溶液中是否存在Fe3+时,取反应后的上层清液于试管中,滴加3滴KSCN溶液,结果出现白色沉淀,查阅资料:ⅰ.SCN-的化学性质与I-相似,CuSCN为白色固体;ⅱ.2Cu2++4I-===2CuI(白色)↓+I2,写出该实验中出现白色沉淀的离子方程式:__________________________________________。
加入几滴K3[Fe(CN)6]溶液,均出现蓝色沉淀
2Fe3++Cu===Cu2++2Fe2+
铜粉的量、阴离子的种类
2Cu2++4SCN-===2CuSCN(白色)↓+(SCN)2
解析:(1)①检验Fe2+的方法为取少量反应后的溶液于试管中,加入几滴K3[Fe(CN)6]溶液,若出现蓝色沉淀,则证明存在Fe2+;三组实验中铜粉均溶解,溶液黄色变浅或褪去,均发生反应:2Fe3++Cu===Cu2++2Fe2+。②对比三组实验发现乙组相比甲组铜粉过量,乙组相比丙组阴离子不同,乙组加入蒸馏水后出现白色沉淀,说明加入蒸馏水后沉淀的产生与铜粉的量和阴离子的种类有关。③加入饱和NaCl溶液引入Cl-,产生与乙组相同的阴离子,可能出现白色沉淀。④由已知信息,SCN-与Cu2+的反应类比I-与Cu2+的反应,可得离子方程式为2Cu2++4SCN-===2CuSCN(白色)↓+(SCN)2。
(2)实验Ⅱ:Fe2+转化为Fe3+实验步骤及现象:向3 mL 0.1 ml·L-1 FeSO4溶液中加入稍过量稀硝酸,溶液变为棕色,放置一段时间后,棕色消失,溶液变为黄色,已知Fe2++NO―→Fe(NO)2+(棕色)。①使用的FeSO4溶液中存在少量铁屑,其目的是______________。②实验中产生NO的原因为___________________________________(用离子方程式表示)。
(3)实验Ⅲ:Fe2+与Fe3+相互转化实验步骤及现象:将SO2通入足量Fe(NO3)3溶液中,溶液由棕黄色变为浅绿色,但立即又变为棕黄色,此时若滴入BaCl2溶液,则会产生白色沉淀。将产生的白色沉淀经过滤、洗涤、干燥后称量其质量为6.99 g,则整个实验中产生的气体(假设只生成一种气体,该气体遇空气变为红棕色)在标准状况下的体积为________。
2.[2024·深圳南山区调研]硫酸亚铁(FeSO4)和硫酸亚铁铵[(NH4)2Fe(SO4)2]都是在生产、生活中有重要用途的亚铁盐,探究其饱和溶液稳定性的实验如下:先分别配制FeSO4、(NH4)2Fe(SO4)2饱和溶液,测定pH分别为4.46、4.22,后续实验如图所示。
实验结果如表:回答下列问题:(1)由该实验可以得出两种饱和溶液的稳定性:FeSO4________(NH4)2Fe(SO4)2(填“大于”“小于”或“等于”,下同),物质的量浓度:FeSO4________(NH4)2Fe(SO4)2。(2)FeSO4饱和溶液需要新配制,若久置会发黄、变浑浊,且pH减小,发生反应的离子方程式为___________________________________。
4Fe2++O2+10H2O===4Fe(OH)3↓+8H+
解析:(1)由对该实验进行的分析可以得出,FeSO4先变色,则表明稳定性差,所以两种饱和溶液的稳定性:FeSO4小于(NH4)2Fe(SO4)2;由溶液的颜色可以看出,物质的量浓度:FeSO4大于(NH4)2Fe(SO4)2。(2)FeSO4饱和溶液需要新配制,若久置会发黄、变浑浊,表明生成Fe(OH)3沉淀,pH减小,表明生成H+,所以发生反应的离子方程式为4Fe2++O2+10H2O===4Fe(OH)3↓+8H+。
不合理,硫酸亚铁溶液易被氧化变质,硫酸铵溶液则不易被氧化,铵离子的还原性弱,不能保护亚铁离子
2025届高中化学全程复习构想课件全套23氮及其化合物的转化 环境保护: 这是一份2025届高中化学全程复习构想课件全套23氮及其化合物的转化 环境保护,共43页。PPT课件主要包含了考点一,答案C,红棕色气体慢慢变浅,答案B,答案D,答案A等内容,欢迎下载使用。
2025届高中化学全程复习构想课件全套09化学计算的常用方法: 这是一份2025届高中化学全程复习构想课件全套09化学计算的常用方法,共32页。PPT课件主要包含了考点一,考点二,考点三,05mol,答案D等内容,欢迎下载使用。
2025届高中化学全程复习构想课件全套28化学键: 这是一份2025届高中化学全程复习构想课件全套28化学键,共26页。PPT课件主要包含了考点一,考点二,阳离子,非金属之间,不同种,最外层电子,⑥⑦⑧,⑤⑥⑦⑧,答案A,极性键等内容,欢迎下载使用。












