

广西玉林市2023-2024学年高二上学期九月统考化学试题
展开考试时间:75分钟,全卷100分
注意事项:
1.答题前,考生先将自己的姓名、准考证号码填写在答题卡上,将条形码准确粘贴在条形码区域内。
2.回答选择题时,选出每小题答案后,用2B铅笔把答题卡上对应题目的答案标号框涂黑。如需改动,用橡皮擦干净后,再选涂其它答案标号框。回答非选择题时,将答案写在答题卡答题区域,写在本试卷及草稿纸上无效。
3.考试结束后,将答题卡交回。
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 S 32 Cl 35.5 K 39 Fe 56
第 I 卷 (共48分)
选择题(16小题,每小题3分,共48分,每小题只有一个正确答案)
化学反应速率在工农业生产和日常生活中都有重要作用,下列说法正确的是( )
将肉类食品进行低温冷藏,能使其永远不会腐败变质
B. 在化学工业中,使用催化剂一定能提高反应物的转化率
C. 夏天面粉的发酵速率与冬天面粉的发酵速率相差不大
D. 茶叶等包装袋中加入还原性铁粉,能显著延长茶叶的储存时间
2.实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置)。仅用此装置和表中提供的物质完成相关实验,最合理的选项是( )
3.铝元素的多种化合物间存在下列转化关系,有关过程描述正确的是( )
实现过程①可通入过量CO2
B.实现过程②可加入过量NaOH溶液
C.实现过程③可加入过量NaOH溶液
D.实现过程④可通入过量NH3
4.下列物质的用途或者制备中所涉及到的离子方程式书写正确的是( )
下列由实验得出的结论正确的是( )
选项
a中的物质
b中的物质
c中收集的气体
d中的物质
A
浓氨水
CaO
NH3
H2O
B
浓硫酸
Na2SO3
SO2
NaOH溶液
C
稀硝酸
Cu
NO2
H2O
D
浓盐酸
MnO2
Cl2
NaOH溶液
选项
用途或者制备
离子方程式
A
用稀硫酸清洗铁锈
Fe2O3+6H+=2Fe2++3H2O
B
实验室用大理石与稀盐酸反应制备二氧化碳
CO32-+2H+ =H2O+CO2↑
C
用氢氧化钠溶液吸收氯气
Cl2 + 2OH- = Cl-+ClO-+H2O
D
用氯化铁溶液刻蚀铜板
Fe3+ + Cu =Fe2++Cu2+
下列根据实验操作和现象所得出的结论正确的是( )
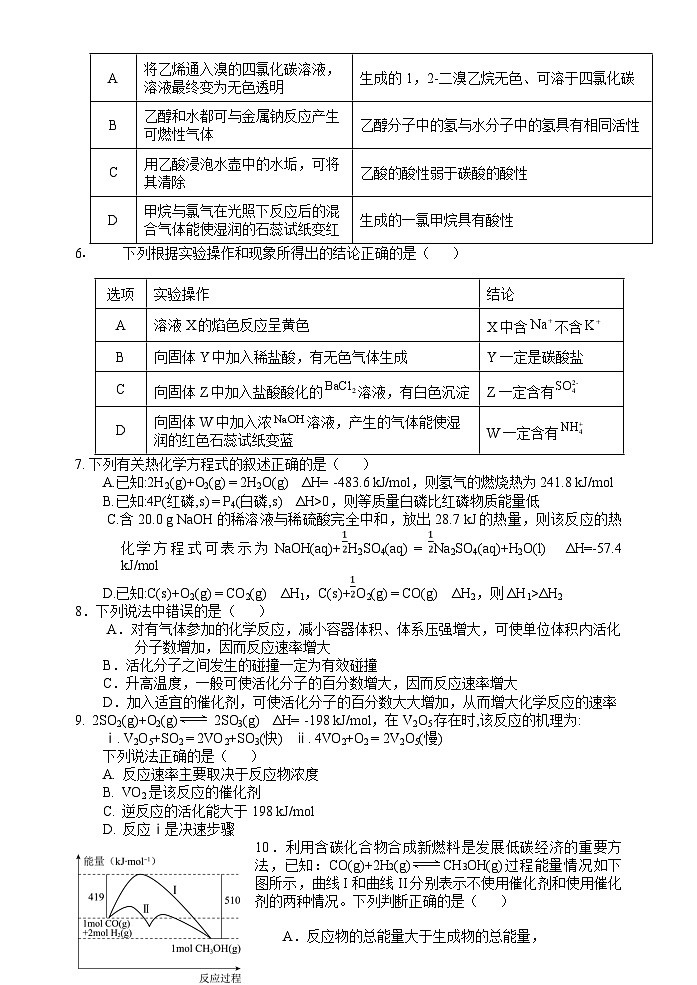
7. 下列有关热化学方程式的叙述正确的是( )
A.已知:2H2(g)+O2(g) = 2H2O(g) ΔH= -483.6 kJ/ml,则氢气的燃烧热为241.8 kJ/ml
B.已知:4P(红磷,s) = P4(白磷,s) ΔH>0,则等质量白磷比红磷物质能量低
C.含20.0 g NaOH的稀溶液与稀硫酸完全中和,放出28.7 kJ的热量,则该反应的热化学方程式可表示为NaOH(aq)+H2SO4(aq) = Na2SO4(aq)+H2O(l) ΔH=-57.4 kJ/ml
D.已知:C(s)+O2(g) = CO2(g) ΔH1,C(s)+O2(g) = CO(g) ΔH2,则ΔH1>ΔH2
8.下列说法中错误的是( )
A.对有气体参加的化学反应,减小容器体积、体系压强增大,可使单位体积内活化分子数增加,因而反应速率增大
B.活化分子之间发生的碰撞一定为有效碰撞
C.升高温度,一般可使活化分子的百分数增大,因而反应速率增大
D.加入适宜的催化剂,可使活化分子的百分数大大增加,从而增大化学反应的速率
9. 2SO2(g)+O2(g) 2SO3(g) ΔH= -198 kJ/ml,在V2O5存在时,该反应的机理为:
ⅰ. V2O5+SO2 = 2VO2+SO3(快) ⅱ. 4VO2+O2 = 2V2O5(慢)
下列说法正确的是( )
反应速率主要取决于反应物浓度
VO2是该反应的催化剂
逆反应的活化能大于198 kJ/ml
反应ⅰ是决速步骤
10.利用含碳化合物合成新燃料是发展低碳经济的重要方法,已知:CO(g)+2H2(g)CH3OH(g)过程能量情况如下图所示,曲线I和曲线II分别表示不使用催化剂和使用催化剂的两种情况。下列判断正确的是( )
选项
实验
结论
A
将乙烯通入溴的四氯化碳溶液,溶液最终变为无色透明
生成的1,2-二溴乙烷无色、可溶于四氯化碳
B
乙醇和水都可与金属钠反应产生可燃性气体
乙醇分子中的氢与水分子中的氢具有相同活性
C
用乙酸浸泡水壶中的水垢,可将其清除
乙酸的酸性弱于碳酸的酸性
D
甲烷与氯气在光照下反应后的混合气体能使湿润的石蕊试纸变红
生成的一氯甲烷具有酸性
选项
实验操作
结论
A
溶液X的焰色反应呈黄色
X中含不含
B
向固体Y中加入稀盐酸,有无色气体生成
Y一定是碳酸盐
C
向固体Z中加入盐酸酸化的溶液,有白色沉淀
Z一定含有
D
向固体W中加入浓溶液,产生的气体能使湿润的红色石蕊试纸变蓝
W一定含有
A.反应物的总能量大于生成物的总能量,
且加入催化剂降低了该反应的活化能
B.该反应的ΔH=+91kJ·ml-1
C.加入催化剂,该反应的ΔH变小
D.如果该反应生成液态CH3OH,则ΔH增大
11.某温度下,在2 L的恒容密闭容器中充入气体A和气体B发生反应生成气体C,反应过程中各组分的物质的量随反应时间的变化如图所示。下列说法正确的是( )
A.t1时刻反应达到平衡状态
B.B的平衡转化率为10%
C.该反应的化学方程式可表示为:A+3B2C
D.该温度下,反应的平衡常数为300
一定条件下,在体积为10 L的密闭容器中充入1ml X和1 ml Y进行反应:2X(g)+Y(g)Z(g),60s后反应达到平衡,生成Z的物质的量为0.3 ml。下列说法正确的是( )
A.X的平衡转化率为50%
B.若将容器体积变为5L,则Z的平衡浓度大于原来的2倍
C.若增大压强,则Y的平衡转化率减小
D.若升高温度,X的体积分数增大,则该反应的ΔH>0
13.某密闭容器中发生如下反应:X(g)+3Y(g) 2Z(g) ΔH<0。如图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法中正确的是( )
A.t2时加入催化剂B.t3时降低了温度
C.t5时增大了压强D.t4~t5与t6 时X的转化率相同
14.已知某可逆反应mA(g)+nB(g) pC(g)在密闭容器中进行,如图表示在不同反应时间(t)时,温度(T)和压强(p)与反应物B在混合气体中的体积分数[φ(B)]的关系曲线,由曲线分析,下列判断正确的是( )
A.T1
B.T1>T2,p1
C.T1
C的百分含量(C%)与温度(T)和压强(p)的关系如图所示,下列叙述正确的是( )
达到平衡后,加入催化剂,C%增大
B.达到平衡后,若升温,平衡向左移动
C.化学方程式中n<p+q
D.达到平衡后,增加A的量有利于平衡向右移动
16.在固定容积的密闭容器中,发生反应:2X(g)+Y(s) Z(g)+W(g),其化学平衡常数与温度的关系如表:
对该反应而言,下列说法正确的是( )
A.增大压强,平衡向正反应方向移动
B.温度不变,增加X的量,K增大
C.达平衡后,加入催化剂,反应物转化率增大
D.该反应的正反应为吸热反应
第 II 卷 (非选择题 共 52分)
非选择题(4大题,共52分)
(12分)某兴趣小组用Fe2(SO4)3溶液吸收含SO2的尾气(SO2的体积分数约10%,其余为空
气),实验装置如图所示:
装置A中SO2与Fe2(SO4)3溶液反应生成FeSO4,写出该反应的离子反应方程式
: 。
(2)反应后,若要检验装置A中Fe3+是否过量,可用试剂为 ;若要检验SO2是否过量,可用试剂为 。
(3)装置B中所用X溶液为 ,作用是 。
(4)若实验测得反应后的装置A中不含有SO2,为测定其中所含FeSO4的物质的量浓度,现进行如下实验:取20.00 mL装置A中溶液,向其中逐滴加入0.1000 ml·L-1 Ce(SO4)2溶液,发生反应Fe2++Ce4+=Ce3++Fe3+,当反应恰好完全时,共消耗Ce(SO4)2溶液18.00 mL。FeSO4的物质的量浓度为 ml·L-1。
T/℃
700
800
900
1000
1200
K
0.4
0.7
1.3
1.8
2.7
18.(14分)完成下列问题
(1)1m1石墨转化为1ml金刚石要吸收能量,则石墨比金刚石_______ (填“稳定”或“不稳定”)。
(2)25℃和101 kPa下, H2(g) +Cl2(g) =2HCl (g)能量变化如图,根据图示回答下列问题:
图示中,431 kJ·ml -1表示的含义是_________________________________________________; 反应H2(g) +Cl2(g) = 2HC1(g)的焓变 ΔH= _______kJ/ml 。
(3)已知:①H2O(g)=H2(g)+O2(g) ΔH= +241. 8 kJ/ml;
②H2O(g)=H2O(1) ΔH = -44. 0 kJ/ml;
③C(s)+O2(g) =CO(g) ΔH = -110. 5 kJ/ml;
④C(s)+ O2(g)=CO2(g) ΔH = -393.5 kJ/ml。
碳的燃烧热(取正值)是_______ kJ/ml; 10g H2完全燃烧生成液态水,放出的热量
为_______kJ;写出CO燃烧热的热化学方程式 。
(4)50 mL 0. 50 ml·L-1盐酸与50 mL 0. 55 ml·L-1NaOH溶液在如图所示的装置中进行中和反应,通过实验可测定中和反应过程中放出的热量。回答下列问题:
①实验装置上看,尚缺少一种玻璃仪器,该仪器的名称是_____________。
②实验中,NaOH 溶液过量的目的是_________________________。
③若操作时忘记盖上杯盖,测得的中和反应热的数值(绝对值)
_________(填“偏大”“偏小”或“无影响”,下同)。用相同浓度和体积的氨
水代替NaOH溶液进行上述实验,测得的中和反应热的数值(绝对值)会_________。
(已知:通常弱酸或弱碱电离会吸热)
19.(12分) 某小组拟用酸性KMnO4溶液与弱酸H2C2O4溶液的反应(此反应为放热反应)来探究“条件对化学反应速率的影响”,并设计了如下的方案记录实验结果(忽略溶液混合体积变化)。限选试剂和仪器:0.20 ml/L H2C2O4溶液、0.010 ml/L KMnO4溶液(酸性)、蒸馏水、试管、量筒、秒表、恒温水浴槽。
已知:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O,回答下列问题:
(1)KMnO4溶液用___________酸化(填名称);写出上述已知反应的离子方程式
: ;
(2)上述实验①②是探究___________对化学反应速率的影响;上述实验②④是探究___________对化学反应速率的影响。
(3)若上述实验②③是探究浓度对化学反应速率的影响,则a为___________;表格中的“乙”填写t/s,其测量的是__________________________________。
(14分)在密闭容器中发生反应CO2(g)+H2(g) CO(g)+H2O(g),其平衡常数(K)和温度(T)
的关系如表所示。
(1)该反应的平衡常数表达式为K= ;由上表可知该反应的正反应为 反应(填“吸热”或“放热”)。
(2)830 ℃时,向容器中充入2 ml CO2、8 ml H2,保持温度不变,反应达到平衡后,
其平衡常数 1.0(填“大于”“小于”或“等于”),此时CO2的物质的量为 。
(3)下列有利于提高平衡时CO2转化率的措施有 (填字母)。
a. 使用催化剂 b. 升温 c. 增大CO2和H2的投料比
(4) 1 200 ℃时,在某时刻反应混合物中CO2、H2、CO、H2O的浓度分别为2 ml/L、2 ml/L、4 ml/L、4 ml/L,则此时平衡 (填“正向移动”“逆向移动”或“不移动”)。
(5)实验发现,其他条件不变,在相同时间内,向上述反应体系中投入一定量的CaO,H2的体积分数增大,实验结果如图所示。
已知:1微米=10-6米,1纳米=10-9米。
投入纳米CaO与投入微米CaO相比,H2的体积分数更高的原因是
。
实验
编号
V(0.20ml/L
H2C2O4溶液)/mL
V(蒸馏水)/mL
V(0.010ml/L酸性KMnO4溶液)/mL
m(MnSO4)/g
T/℃
乙
①
2.0
0
4.0
0
50
②
2.0
0
4.0
0
25
③
1.5
a
4.0
0
25
④
2.0
0
4.0
0.1
25
T/℃
700
800
830
1 000
1 200
K
0.6
0.9
1.0
1.7
2.6
广西玉林市2023-2024学年高一上学期期末考试化学试题: 这是一份广西玉林市2023-2024学年高一上学期期末考试化学试题,共11页。试卷主要包含了下列有关物质的分类正确的是,下列离子方程式书写正确的是,下列实验装置能达到实验目的的是,下列有关化学用语的说法正确的是,已知① ②,等内容,欢迎下载使用。
广西玉林市2023-2024学年高一上学期期末教学质量监测化学试题(含解析): 这是一份广西玉林市2023-2024学年高一上学期期末教学质量监测化学试题(含解析),共11页。试卷主要包含了下列有关物质的分类正确的是,下列离子方程式书写正确的是,下列实验装置能达到实验目的的是,下列有关化学用语的说法正确的是,已知① ②,等内容,欢迎下载使用。
广西玉林市2023-2024学年高一上学期期末考试化学试题: 这是一份广西玉林市2023-2024学年高一上学期期末考试化学试题,共6页。












