

所属成套资源:全套苏教版高中化学选择性必修1专题复习提升练+拔高练+整合练+强化练+检测含含答案
苏教版 (2019)选择性必修1第一单元 化学反应速率课堂检测
展开
这是一份苏教版 (2019)选择性必修1第一单元 化学反应速率课堂检测,共10页。试卷主要包含了全卷满分100分,可能用到的相对原子质量等内容,欢迎下载使用。
1.全卷满分100分。考试用时75分钟。
2.可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 S 32 Cl 35.5 Mn 55。
一、选择题(本题共15小题,每小题3分,共45分。在每小题给出的四个选项中,只有一项是符合题目要求的)
1.下列过程属于非自发过程的是( )
A.气体从高密度处向低密度处扩散 B.水由高处向低处流
C.煤气的燃烧 D.室温下水结成冰
2.根据化学反应速率或平衡理论,联系生产实际,下列说法错误的是( )
A.供热公司为了节能减排,将煤块粉碎,让煤充分燃烧
B.啤酒瓶开启后,马上泛起大量泡沫,可用勒夏特列原理解释
C.将一氧化碳中毒者放入高压氧舱,增大氧气浓度,利用平衡移动原理缓解病情
D.使用高效催化剂是大大提高原料平衡转化率的有效方法
3.镁可由碳真空热还原MgO制得,主要反应为C(s)+MgO(s) Mg(s)+CO(g)。下列说法错误的是( )
A.该反应的平衡常数K=c(CO)
B.将容器容积压缩为原来的一半,当体系再次达到平衡时,CO的浓度增大
C.一定温度下,减小CO浓度,平衡正向移动,平衡常数不变
D.如图,当温度升高时,该反应的化学平衡常数K增大
4.实验室配制碘水时,通常将I2溶于KI溶液:I2(aq)+I-(aq) I3-(aq)。关于该溶液,下列说法正确的是( )
A.加入苯,平衡逆向移动 B.滴入淀粉溶液,溶液不变蓝
C.加水稀释,平衡正向移动 D.加少量AgNO3固体,平衡正向移动
5.化学反应进行的方向是一个比较复杂的问题。下列有关说法正确的是( )
A.反应2NO(g)+O2(g) 2NO2(g)的ΔS>0
B.ΔH0的反应一定能自发进行
C.1 ml H2O在不同状态时的熵值:S[H2O(g)]0能否自发进行与温度有关
6.工业上生产硝酸涉及氨的催化氧化,反应的热化学方程式为4NH3(g)+5O2(g) 4NO(g)+6H2O(g) ΔH=-904 kJ·ml-1,下列有关说法正确的是( )
A.该反应的ΔSv(d)
C.平衡常数:K(a)>K(c),K(b)=K(d)
D.平均摩尔质量:M(a)Kc>Kd
C.b点的逆反应速率和c点的正反应速率的大小关系为v逆b>v正c
D.达平衡时,b、c、d点对应温度下,CO2的转化率为b>d>c
15.T ℃时,某一气态平衡体系中含有X、Y、Z、W四种气体物质,此温度下发生反应的平衡常数的表达式为K=c(X)·c2(Y)c2(Z)·c2(W),有关该平衡体系的说法正确的是( )
A.升高温度,平衡常数K增大,则正反应为吸热反应
B.增大压强,W的质量分数增加
C.增大X的浓度,平衡向正反应方向移动
D.升高温度,若混合气体的平均相对分子质量变大,则正反应是放热反应
二、非选择题(本题共4小题,共55分)
16.(13分)某小组利用弱酸H2C2O4溶液和酸性KMnO4溶液(H2SO4酸化)反应来探究“外界条件对化学反应速率的影响”。该小组欲通过测定单位时间内生成CO2的体积来判断反应的快慢。设计实验方案如表:
(1)已知反应后H2C2O4转化为CO2,MnO4-转化为Mn2+,写出该反应的离子方程式 ;每消耗1 ml H2C2O4,则反应中转移 ml电子。
(2)探究浓度对化学反应速率影响的实验编号是 ,实验②③探究 对化学反应速率的影响。本实验还可通过测定 来比较化学反应速率。
(3)该小组同学发现反应速率总是如图,其中t1~t2时间段内速率增大的主要原因可能是:
a.该反应放热,使体系温度升高;
b. 。
17.(12分)CO2的资源化利用能有效减少CO2排放,充分利用碳资源。
已知:
反应Ⅰ:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH1=-49 kJ·ml-1
反应Ⅱ:CO2(g)+4H2(g) CH4(g)+2H2O(g) ΔH2=-165 kJ·ml-1
反应Ⅲ:CO2(g)+H2(g) CO(g)+H2O(g) ΔH3=+41 kJ·ml-1
(1)反应Ⅰ的化学平衡常数表达式K= 。反应CO(g)+2H2(g) CH3OH(g)的ΔH= 。
(2)以CO2、H2为原料制取CH3OH时发生反应Ⅰ和反应Ⅲ。在恒容、CO2和H2的起始量一定的条件下,CO2平衡转化率和平衡时CH3OH的选择性[n生成(CH3OH)n反应(CO2)×100%]随温度的变化如图1所示。平衡时CH3OH的选择性随温度升高而出现如图1所示变化的原因是 。
(3)CO2催化加氢合成CH4的过程中发生反应Ⅱ和反应Ⅲ。起始n(H2)∶n(CO2)=4时,CO2平衡转化率与温度和压强的关系如图2所示。800 ℃时,不同压强下的CO2平衡转化率趋于相等,其原因是 。
18.(14分)完成下列填空。
Ⅰ.二甲醚(CH3OCH3)是一种极具发展潜力的有机化工产品和洁净燃料。由合成气制备二甲醚的主要反应原理如下:
①CO(g)+2H2(g) CH3OH(g) ΔH1=a kJ·ml-1
②2CH3OH(g) CH3OCH3(g)+H2O(g) ΔH2=b kJ·ml-1
③CO(g)+H2O(g) CO2(g)+H2(g) ΔH3=c kJ·ml-1
(1)反应3H2(g)+3CO(g) CH3OCH3(g)+CO2(g)的ΔH= kJ·ml-1;若①、②、③平衡常数分别为K1、K2、K3,该反应的平衡常数K= (用含K1、K2、K3的式子表示)。
Ⅱ.600 ℃时,将0.6 ml CO和0.24 ml H2O通入2 L恒容密闭容器中,发生反应CO(g)+ H2O(g) CO2(g)+H2(g),5 min后达到化学平衡状态,平衡后测得氢气的浓度为0.06 ml·L-1。
(2)则0~5 min内v(H2O)= ,该反应的平衡常数K= 。
Ⅲ.甲醇(CH3OH)广泛用作燃料电池的燃料,工业上可由CO和H2来合成,化学方程式为CO(g)+2H2(g) CH3OH(g)。
(3)图甲是在不同温度下CO的转化率随时间变化的曲线。该反应的ΔH 0(填“>”“”“”“p2>p3
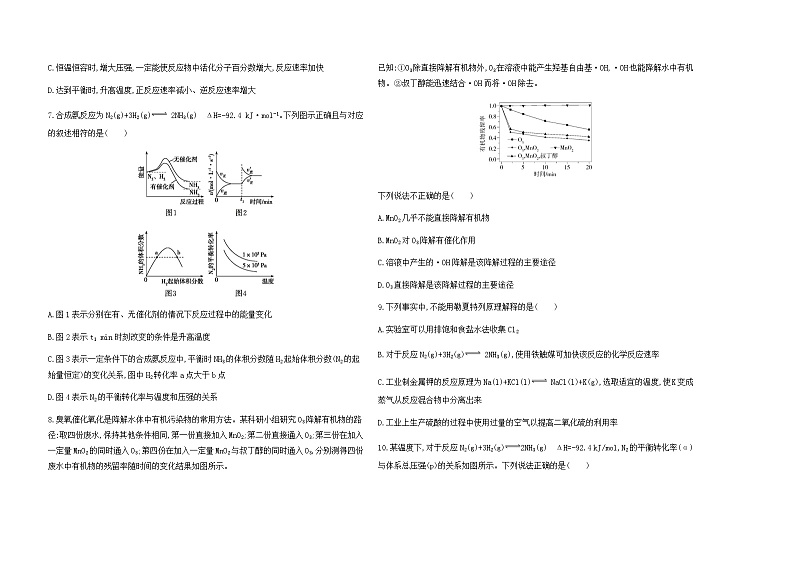
(3)k正k逆=K
解析 Ⅰ.已知:①Fe3O4(s)+4CO(g) 3Fe(s)+4CO2(g) ΔH1=a kJ/ml;②3Fe2O3(s)+CO(g) 2Fe3O4(s)+CO2(g) ΔH2=b kJ/ml;根据盖斯定律,2×①+②3可得Fe2O3(s)+3CO(g) 2Fe(s)+3CO2(g) ΔH3=2ΔH1+ΔH23=2a+b3 kJ/ml。
Ⅱ.(1)甲容器15 min后达到平衡,此时CO2的转化率为75%,则转化的CO2为8 ml×75%= 6 ml,列三段式:
CO2(g)+H2(g) CO(g)+H2O(g)
起始浓度/(ml/L) 4 8 0 0
转化浓度/(ml/L) 3 3 3 3
平衡浓度/(ml/L) 1 5 3 3
则0~15 min内平均反应速率v(CO2)=3ml/L15min=0.2 ml/(L·min);此条件下该反应的平衡常数 K=c(CO)·c(H2O)c(CO2)·c(H2)=3×31×5=1.8;欲使平衡后乙与甲中相同气体的体积分数相等,则将乙中CO和H2O全部转化为CO2和H2,故y=z,可认为乙中气体为(w+y)ml CO2和(x+y)ml H2,同时n(CO2)∶n(H2)=8∶16=1∶2,则有(w+y)∶(x+y)=1∶2,解得y=x-2w。
(2)温度升高,有利于反应向吸热方向进行,根据题图可知,一定压强下,温度升高,乙苯的平衡转化率增大,正反应为吸热反应,故反应的ΔH>0;又反应C6H5CH2CH3(乙苯,g)+CO2(g) +CO(g)+H2O(g)为反应前后气体分子数增大的反应,故压强增大,平衡向逆反应方向移动,乙苯的平衡转化率减小,故p1>p2>p3。
(3)CO可被NO2氧化:CO(g)+NO2(g) CO2(g)+NO(g)。当温度高于225 ℃时,v正=k正· c(CO)·c(NO2)、v逆=k逆·c(CO2)·c(NO),平衡时v正=v逆,故k正·c(CO)·c(NO2)=k逆· c(CO2)·c(NO),k正k逆=c(CO2)·c(NO)c(CO)·c(NO2)=K。
编号
H2C2O4溶液
酸性KMnO4溶液
温度/℃
浓度/(ml·L-1)
体积/mL
浓度/(ml·L-1)
体积/mL
①
0.10
20
0.10
30
25
②
0.20
20
0.10
30
25
③
0.20
20
0.10
30
50
容器
投入物质
甲
8 ml CO2(g)、16 ml H2(g)
乙
w ml CO2(g)、x ml H2(g)、y ml CO(g)、z ml H2O(g)
相关试卷
这是一份苏教版 (2019)选择性必修1第一单元 化学反应速率同步练习题,共5页。试卷主要包含了已知,已知A转化为C和D分步进行等内容,欢迎下载使用。
这是一份高中苏教版 (2019)第一单元 化学反应速率测试题,共35页。试卷主要包含了反应X2Z经历两步,88的曲线代表平衡转化率等内容,欢迎下载使用。
这是一份苏教版 (2019)选择性必修1第一单元 化学反应速率课时训练,共23页。试卷主要包含了已知某密闭容器中发生反应,4 kJ·ml-1,2 kJ·ml-1,6 kJ·ml-1等内容,欢迎下载使用。









