





高中化学苏教版 (2019)选择性必修1第三单元 金属的腐蚀与防护教学课件ppt
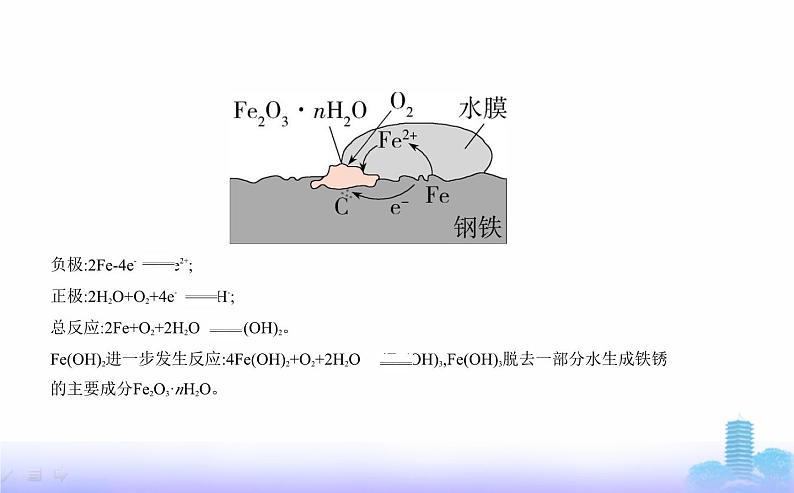
展开负极:2Fe-4e- 2Fe2+;正极:2H2O+O2+4e- 4OH-;总反应:2Fe+O2+2H2O 2Fe(OH)2。Fe(OH)2进一步发生反应:4Fe(OH)2+O2+2H2O 4Fe(OH)3,Fe(OH)3脱去一部分水生成铁锈的主要成分Fe2O3·nH2O。
(2)析氢腐蚀:金属表面的电解质溶液酸性较强时,易发生析氢腐蚀,腐蚀过程中不断有氢气放出。 负极:Fe-2e- Fe2+;正极:2H++2e- H2↑;总反应:Fe+2H+ Fe2++H2↑。
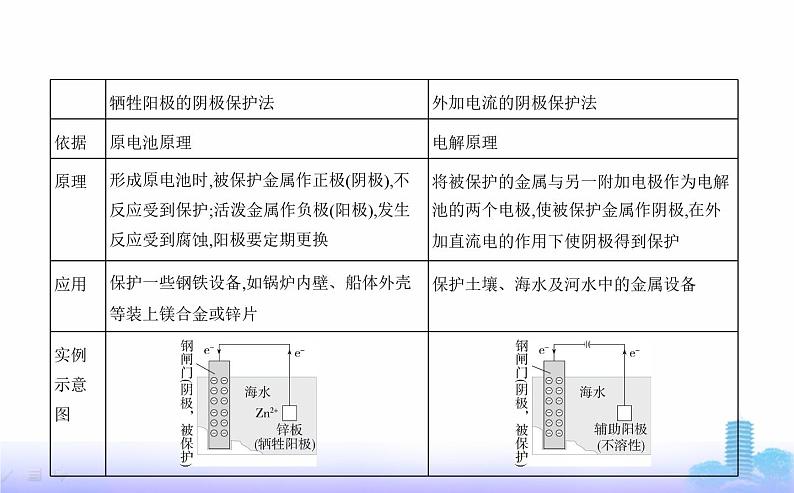
2.方法(1)改变金属内部结构:如制成合金等。(2)加防护层:如在金属表面涂油或油漆、覆盖塑料、镀不活泼金属等。(3)电化学防护
1.本质:阻止金属发生氧化反应。
知识辨析1.为使某些铁制品保持亮洁美观,经常在其表面镀上一层锡,当镀锡铁制品的镀层破损时,镀 层能对铁制品起保护作用。这种说法对吗?2.外加电流的阴极保护法即将需保护的金属与电源的负极相连。这种说法对吗?3.只有在金属活动顺序中位于氢前面的金属才可能发生析氢腐蚀。这种说法对吗?
一语破的1.不对。镀锡铁的镀层破损,形成原电池时铁是负极更易被腐蚀。2.对。将需保护的金属与电源的负极相连,金属不易失去电子,不易被氧化。3.对。在金属活动顺序中位于氢前面的金属可与非氧化性酸反应,发生析氢腐蚀,氢后面的金 属不能与酸反应生成H2,所以不能发生析氢腐蚀,只能发生吸氧腐蚀。
典例 用压强传感器探究生铁在pH=2和pH=4的醋酸溶液中发生腐蚀类型的装置及得到的图 像如下。
分析图像,以下结论错误的是 ( )A.两溶液中均有化学能转化为电能B.在酸性溶液中生铁可能发生吸氧腐蚀C.溶液pH≤2时,生铁发生析氢腐蚀D.两溶液中负极电极反应均为Fe-3e- Fe3+
思路点拨:根据锥形瓶中气体压强与时间关系图可知,pH=2时,生铁主要发生析氢腐蚀,pH= 4时,生铁主要发生吸氧腐蚀。
解析:两溶液中都发生电化学腐蚀,有化学能转化为电能,A项正确;醋酸溶液的pH=4时,锥形 瓶中压强随着反应的进行而逐渐减小,说明生铁发生了吸氧腐蚀,所以在酸性溶液中生铁也 可能发生吸氧腐蚀,B项正确;根据醋酸溶液的pH=2时,锥形瓶中压强与时间的关系知,随着反 应的进行压强逐渐增大,说明生铁发生了析氢腐蚀,则溶液pH≤2时,生铁发生析氢腐蚀,C项 正确;两溶液中铁均为负极,电极反应均为Fe-2e- Fe2+,D项错误。
1.影响金属腐蚀快慢的因素(1)与构成原电池的材料有关,两极材料的活泼性差别越大,氧化还原反应的速率越快,活泼金 属被腐蚀的速率就越快。(2)与金属所接触的介质有关。2.金属腐蚀快慢比较(1)按腐蚀类型:电解原理引起的腐蚀>原电池原理引起的腐蚀>化学腐蚀>有防护措施的腐蚀。(2)按电解质类型:金属在浓度相等的不同溶液中的腐蚀速率,强电解质溶液>弱电解质溶液> 非电解质溶液。(3)对同一种电解质溶液来说:一般电解质浓度越大,金属腐蚀得越快。
(4)根据金属活动性:形成原电池时,一般活动性差别越大,活泼金属腐蚀得越快。
典例 下列叙述错误的是 ( )A.生铁中含有碳,抗腐蚀能力比纯铁弱B.用锡焊接的铁质器件,焊接处易生锈C.在铁制品上镀铜时,镀件为阳极,铜盐溶液为电镀液D.铁管上镶嵌锌块,铁管不易被腐蚀
思路点拨:较活泼的金属中含不太活泼的金属或碳,一般较活泼的金属作原电池的负极,易 被腐蚀。
解析:生铁中含有碳,易形成原电池,铁被腐蚀速率加快,故抗腐蚀能力比纯铁弱,A正确;用锡 焊接的铁质器件,形成原电池时,铁作负极,被腐蚀,故焊接处易生锈,B正确;在铁制品上镀铜 时,镀件为阴极,铜盐溶液为电镀液,C错误;铁管上镶嵌锌块,形成原电池时,锌作负极被腐蚀, 铁作正极被保护,故铁管不易被腐蚀,D正确。
情境探究 最长跨海大桥“港珠澳大桥”全长50多公里,海中桥墩由钢管复合桩组成。在钢管复合 桩表面涂上环氧树脂涂料可以减缓钢管复合桩的腐蚀速率。将钢管复合桩与外加直流电源 的负极相连,可以减缓钢管复合桩的腐蚀速率。在钢管复合桩水下区域装上若干镁铝合金, 可以减缓钢管复合桩的腐蚀速率。
问题1 金属为什么容易被腐蚀?提示 金属原子最外层电子数一般较少,易失去电子被氧化,所以金属易被腐蚀。
问题2 以上材料中提到了哪几种防护方法?提示 ①在金属表面覆盖防护层;②外加电流的阴极保护法;③牺牲阳极的阴极保护法。
问题3 化学腐蚀与电化学腐蚀有什么不同?提示 化学腐蚀是金属与其他物质直接接触发生氧化还原反应;不纯的金属或合金与电解质 溶液接触,发生原电池反应,一般比较活泼的金属失去电子被氧化,这是电化学腐蚀。
讲解分析1.金属防护的原理从金属的组成、结构,金属腐蚀的化学反应原理和金属腐蚀的类型来考虑金属防护的方法。2.金属的防护方法
例1 用如图1所示装置及试剂进行铁的电化学腐蚀实验探究,测定具支锥形瓶中压强随时间 变化关系以及溶解氧随时间变化关系的曲线分别如图2、图3(忽略温度变化)。
下列说法不正确的是 ( )A.压强增大主要是因为产生了H2B.整个过程中,负极电极反应式为Fe-2e- Fe2+C.pH=4.0时,不发生析氢腐蚀,只发生吸氧腐蚀D.pH=2.0时,正极反应式为2H++2e- H2↑和O2+4e-+4H+ 2H2O
素养解读:本题为探究实验,通过化学仪器测得压强变化和溶解氧变化,探究金属腐蚀类型, 培养科学探究与创新意识、科学态度与社会责任的核心素养。
信息提取: Fe在酸性较强环境下主要发生析氢腐蚀,产生氢气;若介质的酸性很弱或呈中性, 并且有氧气参与,Fe主要发生吸氧腐蚀,吸收氧气。可根据图示中气体压强变化和氧气浓度 变化,判断金属腐蚀的类型。
解题思路: pH=2.0的溶液,酸性较强,因此锥形瓶中的Fe粉发生析氢腐蚀,产生氢气,导致锥形 瓶内压强增大,A项正确;锥形瓶中的Fe粉和C粉以及酸溶液构成了原电池,Fe粉作为原电池的 负极,B项正确;若pH=4.0时只发生吸氧腐蚀,那么锥形瓶内的压强会有下降,而图2中pH=4.0 时,锥形瓶内的压强几乎不变,说明除发生了吸氧腐蚀,还发生了析氢腐蚀,消耗氧气的同时也 产生了氢气,因此锥形瓶内压强几乎不变,C项错误;由图3可知,pH=2.0时,锥形瓶内的溶解氧 减少,说明有消耗氧气的吸氧腐蚀发生,同时锥形瓶内的气压增大,说明有产生氢气的析氢腐 蚀发生,因此正极反应式为2H++2e- H2↑和O2+4e-+4H+ 2H2O,D项正确。
例2 将金属M连接在钢铁设施表面,可减缓水体中钢铁设施的腐蚀。在题图所示的情境中,下 列有关说法正确的是 ( ) A.阴极的电极反应式为Fe-2e- Fe2+B.金属M的活动性比Fe的活动性弱C.钢铁设施表面因积累大量电子而被保护D.钢铁设施在河水中的腐蚀速率比在海水中的快
解题思路:A项,题图中金属的防护方法是牺牲阳极的阴极保护法,金属M失去电子被氧化, 钢铁设施被保护,错误;B项,金属M和钢铁设施构成原电池,金属M作负极,故金属M的活动性 比铁的活动性强,错误;C项,电子流向钢铁设施,钢铁设施表面积累大量电子而被保护,正确; D项,海水中含有大量电解质,故钢铁设施在河水中的腐蚀速率比在海水中的慢,错误。解题关键:题图中装置是利用原电池原理进行金属防护,要从氧化还原反应的本质出发,深 刻理解原电池的构成条件:(1)一般,两个活泼性不同的电极,较活泼金属失电子,作负极(阳极);(2)电解质溶液,作用是依靠离子的定向移动形成闭合回路。
高中化学苏教版 (2019)选择性必修1第三单元 金属的腐蚀与防护课前预习ppt课件: 这是一份高中化学苏教版 (2019)选择性必修1第三单元 金属的腐蚀与防护课前预习ppt课件,共21页。PPT课件主要包含了金属的防护,要点二金属的防护等内容,欢迎下载使用。
苏教版 (2019)选择性必修1专题1 化学反应与能量第三单元 金属的腐蚀与防护作业ppt课件: 这是一份苏教版 (2019)选择性必修1专题1 化学反应与能量第三单元 金属的腐蚀与防护作业ppt课件,共17页。
高中第三单元 金属的腐蚀与防护完整版ppt课件: 这是一份高中第三单元 金属的腐蚀与防护完整版ppt课件,共12页。PPT课件主要包含了金属的腐蚀,吸氧腐蚀,正极活泼性较弱金属,正极反应物氧气,中性或弱酸性,正极反应物氢离子,析氢腐蚀,酸性较强等内容,欢迎下载使用。













