






化学苏教版 (2019)专题2 化学反应速率与化学平衡第三单元 化学平衡的移动教学课件ppt
展开固体或纯液体浓度可视为定值,改变固体或纯液体用量,其浓度保持不变,化学平衡不移动。2.根据浓度商判断反应方向 对于可逆反应mA(g)+nB(g) pC(g)+qD(g),在一定温度下的任意时刻,反应物与生成物的浓度有如下关系。
适当增加相对廉价的反应物或及时分离出生成物,从而提高产物产量、降低成本。
1.其他条件不变时,在有气体参加的可逆反应中,增大压强,平衡向气体总体积减小的方向移 动;减小压强,平衡向气体总体积增大的方向移动。对反应前后气体体积不变的反应,改变容 器体积而改变压强,同等倍数地改变正、逆反应速率,但化学平衡不移动。2.恒温恒容时,充入与该反应无关的气体(如稀有气体),正、逆反应速率不变,平衡不移动;恒 温恒压条件下,充入稀有气体,相当于减小压强,平衡向气体总体积增大的方向移动。
在其他条件不变时,升高温度,平衡向吸热反应方向移动;降低温度,平衡向放热反应方向 移动。
1.平衡移动原理又叫勒夏特列原理:如果改变影响平衡的条件之一(如温度、压强,以及参加 反应的化学物质的浓度),平衡将向着能够减弱这种改变的方向移动。2.平衡移动的结果是“减弱”外界条件的影响,而不是“消除”外界条件的影响,更不是“扭 转”外界条件的影响。
知识辨析1.合成氨工业使用催化剂的目的是使平衡正向移动,提高产率。这种说法对吗?2.平衡正向移动,反应物的转化率一定增大。这种说法对吗?3.改变外界条件使平衡正向移动的原因是v正增大,v逆减小。这种说法对吗?4.反应2NO2(g) N2O4(g)达到平衡时,若缩小反应容器的容积,则c(NO2)减小。这种说法对吗?
一语破的1.不对。使用催化剂不能使平衡正向移动,不能提高产率,只能改变反应速率。2.不对。例如两种气体反应物,增加一种反应物浓度,平衡正向移动,该反应物的转化率减小, 另一种反应物的转化率增大。3.不对。平衡正向移动的原因是v正>v逆,v逆不一定减小。4.不对。缩小反应容器的容积,反应物、生成物的浓度都瞬间增大,然后平衡移动使c(NO2)再 稍减小,但不会比原平衡时小。
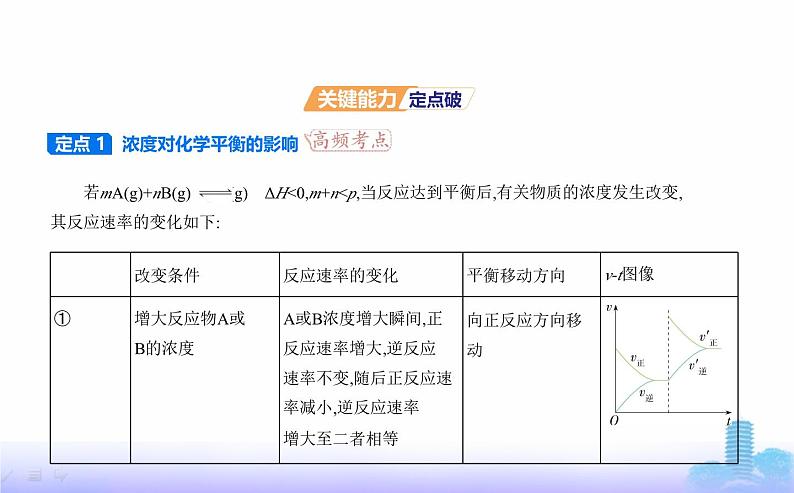
若mA(g)+nB(g) pC(g) ΔH<0,m+n
典例 某小组同学欲探究浓度对平衡的影响设计了如下实验[已知:Fe3++3SCN- Fe(SCN)3]。 (1)ⅰ中观察到的现象是 ,请结合化学用语用平衡移动原理进行解 释: 。
(2)ⅱ中观察到溶液血红色变浅,原因是铁粉参与了反应: ,减小了 c(Fe3+),使平衡向逆反应方向移动。(3)ⅲ中观察到溶液红色褪去,对此现象产生的原因进行探究:①甲同学查阅文献后推测:草酸根离子(C2 )具有还原性,可能与Fe3+反应,产生一种气体,该气体的化学式是 。②乙同学查阅文献后推测:Fe3+可能与C2 反应产生Fe(C2O4 (黄色)。乙同学用灵敏试剂检验试管ⅲ中产物,未检出Fe2+,进一步论证后证实他的推测较为合理。但 是甲同学在12小时后检验ⅲ中产物,检出了Fe2+,对此现象的合理解释是 。(4)实验ⅳ是 的对照实验。a.实验ⅰ b.实验ⅱ c.实验ⅲ
思路点拨:实验探究浓度对化学平衡的影响,需控制其他条件相同,只使一个量发生变化,所 以实验中往往由空白实验进行对照。
解析:(1)对于平衡:Fe3++3SCN- Fe(SCN)3,增大c(Fe3+),平衡向正反应方向移动,c[Fe(SCN)3]增大,溶液血红色加深。(2)铁粉把Fe3+还原为Fe2+,c(Fe3+)减小,使Fe3++3SCN- Fe(SCN)3平衡向逆反应方向移动,所以ⅱ中溶液血红色变浅。(3)①C2 能被Fe3+氧化,产生气体的化学式是CO2;②Fe3+与C2 发生氧化还原反应速率较慢,Fe3+与C2 反应产生Fe(C2O4 速率较快,所以乙同学用灵敏试剂检验试管ⅲ中产物,未检出Fe2+,甲同学在12小时后检验ⅲ中产物, 检出了Fe2+。(4)实验ⅳ滴加4滴蒸馏水,保证实验ⅳ与实验ⅰ、实验ⅲ中溶液体积相同,所以 实验ⅳ是实验ⅰ、实验ⅲ的对照实验。
结论:在其他条件不变的情况下,升高温度,平衡向吸热反应方向移动;降低温度,平衡向 放热反应方向移动。
典例 取五等份NO2,分别加入温度不同、容积相同的恒容密闭容器中,发生反应:2NO2(g) N2O4(g) ΔH<0。反应相同时间后,分别测定体系中NO2的体积分数,并作出其随反应温度变 化的关系图。下列示意图中,可能与实验结果相符的是 ( )
思路点拨:各容器中NO2的体积分数是反应相同时间后测量的,不一定每个反应均达到平 衡。
解析:反应在不同温度下进行,相同时间后不一定都达到平衡状态。若反应都没有达到平 衡,则温度较低的容器中NO2含量高。若反应均达到平衡,由于正反应是放热反应,温度升高, NO2的体积分数增大。
1.对于有气体参与的化学反应
2.“惰性”气体对化学平衡的影响(1)恒温、恒容条件 原平衡体系 体系总压强增大 体系中各组分的浓度不变 平衡不移动(2)恒温、恒压条件 原平衡体系 容器容积增大,各气体组分的分压减小 体系中各组分的浓度同等程度地减小
典例 在容积不变的密闭容器中存在如下反应:2A(g)+B(g) 3C(g)+D(s) ΔH<0,某研究小组研究了在其他条件不变时,改变某一条件对上述反应的影响,下列分析不正确的是 ( )
A.图Ⅰ表示增大反应物浓度对该平衡的影响B.图Ⅱ表示减小压强对该平衡的影响C.图Ⅲ表示温度对该平衡的影响,温度:乙>甲D.图Ⅳ表示催化剂对该平衡的影响,催化效率:甲>乙
思路点拨:本题考查外界条件对反应速率、化学平衡的影响。速率—时间图像既要考虑速 率,也要考虑平衡移动。图像题要看清坐标轴,看清突变点、拐点等。
解析:增大反应物的浓度,正、逆反应速率均增大,在增大的瞬间,逆反应速率与原平衡时速 率相等,不会离开原平衡点,A错误;对反应前后气体体积不变的反应,压强改变,平衡不移动,减 小压强反应速率减慢,B正确;曲线乙先达到拐点,说明乙的温度高于甲,C正确;催化剂不影响 化学平衡,但可以缩短反应达到平衡所用时间,D正确。
1.等效平衡的含义 在一定条件(恒温恒容或恒温恒压)下,同一可逆反应体系,不管从正反应开始,还是从逆 反应开始,达到化学平衡状态时,同种物质的百分含量(质量分数、物质的量分数、体积分数) 相同,这样的化学平衡互称为等效平衡。
2.等效平衡的类型和规律
思维建模 不同条件下等效平衡的思维模式(1)构建恒温、恒容平衡思维模式 新平衡状态可看作两个原平衡状态简单的叠加并压缩而成,相当于增大压强,如图所示:(2)构建恒温、恒压平衡思维模式(以气体物质的量增加的反应为例) 新平衡状态可看作两个原平衡状态简单的叠加,压强不变,平衡不移动,如图所示:
1.改变压强或温度 温度或压强改变后,若能使化学平衡向正反应方向移动,则反应物的转化率一定增大,若 平衡逆向移动,则反应物的转化率减小。2.改变反应物用量 对于反应aA(g)+bB(g) cC(g)+dD(g):(1)若只增加A的量,平衡正向移动,则A的转化率减小,B的转化率增大。(2)若在恒温恒压条件下,同等倍数地增大A、B的物质的量,平衡不移动,A、B的转化率不 变。
(3)若在恒温恒容条件下,同等倍数地增大A、B的物质的量,A、B的转化率与气态物质的化 学计量数有关:a+b=c+d,平衡不移动,A、B转化率不变;a+b>c+d,平衡正向移动,A、B转化率增大;a+b
问题1 A、B两点的浓度平衡常数Kc(A)与Kc(B)大小关系?提示 平衡常数只受温度影响,A、B两点的温度相同,所以Kc(A)=Kc(B)。
问题2 A、B、C三点中NO2的平衡转化率最高的是?提示 增大压强,平衡向气体体积减小的方向移动,该反应的正反应是气体体积增大的反应, 所以增大压强,平衡逆向移动,NO2的平衡转化率减小,则A、B、C三点中NO2的平衡转化率最 高的是A点。
提示 在C点时,二氧化碳与二氧化氮的浓度相等,根据反应2NO2(g)+2C(s) N2(g)+2CO2(g)可知,平衡时二氧化碳的浓度为氮气的2倍,所以混合气体中CO2的体积分数为 ,NO2的体积分数为 ,N2的体积分数为 ,则该反应的压强平衡常数Kp= = MPa=2 MPa。
问题3 C点时该反应的压强平衡常数Kp(Kp是用平衡分压代替平衡浓度计算的平衡常数,分压= 总压×物质的量分数)是多少?
讲解分析化学平衡图像题解题技巧
例题 在特定环境中有效地处理CO2具有重要的研究价值。CO2的转化途径之一为CO2(g)+ 3H2(g) CH3OH(g)+H2O(g) ΔH<0。请回答下列问题:(1)上述反应自发进行的条件为 (“高温”“任意温度”或“低温”)。(2)某实验小组对该反应进行了如下探究:向Ⅰ、Ⅱ、Ⅲ三个容积均为2 L的相同的恒容密闭 容器中分别投入1 ml CO2、3 ml H2,同时在Ⅰ、Ⅱ、Ⅲ三个容器中分别加入等量的催化剂 A、催化剂B和催化剂C,控制反应的温度,发生反应。测定在相同时间内CO2的转化率随温度 的变化曲线如图所示。
①催化剂对反应的催化效果由强到弱的顺序为 > > (选填“A” “B”或“C”);②b点时v(正) v(逆)(填“>”“<”或“=”);③图中a、c点均表示反应已经达到平衡状态,a点CO2的平衡转化率比c点高的原因是
;④T4 K时,此反应的平衡常数K= (结果保留两位小数)。
该反应为放热反应,温度升高,平衡逆向移动
素养解读:图像类试题是以图像为试题的信息来源,精心设计问题的一种信息处理和分析 题。通过对图像类试题信息的规范审读,进一步提高学生获取信息的能力,提升学生对图像 的分析与识别能力以及数据读取、分析与处理能力,培养变化观念与平衡思想、证据推理与 模型认知的化学学科核心素养。
信息提取:
解题思路:(1)该反应的ΔH<0,ΔS<0,当ΔH-TΔS<0时反应自发进行,则温度较低时,反应自发进行。(2)①催化剂能改变反应速率,不影响平衡转化率,在反应未达到平衡状态时,相同温度时,催化剂催化效果越好,反应速率越大,则反应相同时间时CO2的转化率越高,由图可知,催化剂 的催化效果由强到弱的顺序为A>B>C;②b点时,反应未达到平衡状态,则反应向正反应方向进行, 所以v(正)>v(逆);③该反应为放热反应,反应达到平衡状态时继续升高温度,平衡向逆反应方向 移动,CO2的转化率降低;④T4 K时,反应达到平衡时二氧化碳的转化率为80.00%,则反应消耗二氧 化碳的物质的量为1 ml×80.00%=0.8 ml,列三段式: CO2(g)+3H2(g) CH3OH(g)+H2O(g)起始(ml/L) 0.5 1.5 0 0转化(ml/L) 0.4 1.2 0.4 0.4平衡(ml/L) 0.1 0.3 0.4 0.4
则此反应的平衡常数K= ≈59.26。
苏教版 (2019)第一单元 化学反应速率教学ppt课件: 这是一份苏教版 (2019)<a href="/hx/tb_c4009315_t3/?tag_id=26" target="_blank">第一单元 化学反应速率教学ppt课件</a>,共33页。
高中化学苏教版 (2019)选择性必修1第三单元 化学平衡的移动获奖ppt课件: 这是一份高中化学苏教版 (2019)选择性必修1第三单元 化学平衡的移动获奖ppt课件,共14页。PPT课件主要包含了等效平衡的概念,随堂训练1,随堂训练2,随堂训练3,习题研究,作业布置等内容,欢迎下载使用。
高中第三单元 化学平衡的移动获奖ppt课件: 这是一份高中第三单元 化学平衡的移动获奖ppt课件,共26页。PPT课件主要包含了学习目标,一化学平衡的移动等内容,欢迎下载使用。













