



广东省广州市2023-2024学年高三上学期调研考试化学试卷(原卷版+解析版)
展开
这是一份广东省广州市2023-2024学年高三上学期调研考试化学试卷(原卷版+解析版),文件包含广东省广州市2023-2024学年高三上学期调研考试化学试卷原卷版docx、广东省广州市2023-2024学年高三上学期调研考试化学试卷解析版docx等2份试卷配套教学资源,其中试卷共33页, 欢迎下载使用。
本试卷共8页,20小题,满分100分。考试用时75分钟。
注意事项:
1.答卷前,考生务必将用黑色字迹的钢笔或签字笔将自己的姓名、考生号、试室号和座位号填写在答题卡上。用2B铅笔将试卷类型(B)填涂在答题卡相应位置上。并在化学答题卡相应位置上填涂考生号。
2.作答选择题时,选出每小题答案后,用2B铅笔把答题卡对应题目选项的答案信息点涂黑:如需改动,用橡皮擦干净后,再选涂其他答案。答案不能答在试卷上。
3.非选择题必须用黑色字迹的钢笔或签字笔作答,答案必须写在答题卡各题目指定区域内相应位置上:如需改动,先划掉原来的答案,然后再写上新答案;不准使用铅笔和涂改液。不按以上要求作答无效。
4.考生必须保持答题卡的整洁。考试结束后,将试卷和答题卡-并交回。
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23
一、选择题:本题共16小题,共44分。第1~10小题,每小题2分;第11~16小题,每小题4分。在每小题给出的四个选项中,只有一项是符合题目要求的。
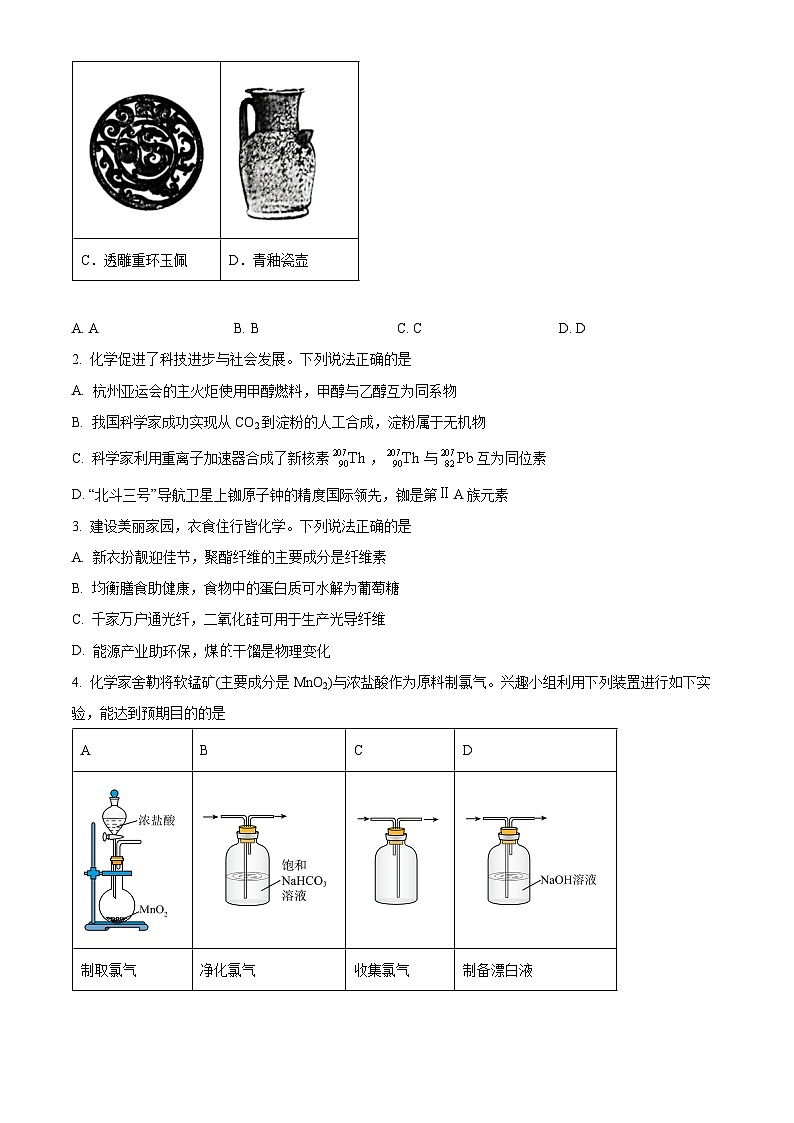
1. 下列馆藏文物主要由金属材料制成的是
A. AB. BC. CD. D
【答案】B
【解析】
【详解】A.三彩釉陶俑属于硅酸盐产品,不属于金属材料,A不合题意;
B.错银铜牛灯的主要成分是Cu、Ag合金,错银铜牛灯主要由金属材料制成,B符合题意;
C.透雕重环玉佩的主要成分是SiO2、Al2O3等,SiO2、Al2O3不属于金属材料,C不合题意;
D.青釉瓷壶属于硅酸盐产品,不属于金属材料,D不合题意;
故答案为:B。
2. 化学促进了科技进步与社会发展。下列说法正确的是
A. 杭州亚运会的主火炬使用甲醇燃料,甲醇与乙醇互为同系物
B. 我国科学家成功实现从CO2到淀粉的人工合成,淀粉属于无机物
C. 科学家利用重离子加速器合成了新核素,与互为同位素
D. “北斗三号”导航卫星上铷原子钟的精度国际领先,铷是第A族元素
【答案】A
【解析】
【详解】A.甲醇(CH3OH)与乙醇(CH3CH2OH)的结构相似,分子组成相差1个CH2,两者互为同系物,A正确;
B.淀粉属于有机物,B错误;
C.与两者质子数不同,二者不互为同位素,C错误;
D.铷是第五周期第IA族元素,D错误;
故选A。
3. 建设美丽家园,衣食住行皆化学。下列说法正确的是
A. 新衣扮靓迎佳节,聚酯纤维的主要成分是纤维素
B. 均衡膳食助健康,食物中的蛋白质可水解为葡萄糖
C. 千家万户通光纤,二氧化硅可用于生产光导纤维
D. 能源产业助环保,煤的干馏是物理变化
【答案】C
【解析】
【详解】A.聚酯纤维是一种合成纤维,主要成分不是纤维素,A错误;
B.均衡膳食助健康,食物中蛋白质可水解为氨基酸,B错误;
C.千家万户通光纤,二氧化硅可用于生产光导纤维,用来传输光信号,C正确;
D.煤的干馏是化学变化,D错误;
故答案为:C。
4. 化学家舍勒将软锰矿(主要成分是MnO2)与浓盐酸作为原料制氯气。兴趣小组利用下列装置进行如下实验,能达到预期目的的是
A. AB. BC. CD. D
【答案】D
【解析】
【详解】A.软锰矿与浓盐酸制氯气,该反应需在加热条件下进行,故A错误;
B.除去氯气中的氯化氢气体应该用饱和食盐水,故B错误;
C.氯气密度比空气大,应用向上排空气法收集,则收集氯气时,应从长导管通入,故C错误;
D.氯气可与氢氧化钠溶液反应,被氢氧化钠溶液吸收,进行尾气处理,故D正确。
答案选D。
5. 一种能标记DNA的有机物的结构简式如图所示,下列关于该有机物的说法不正确的是
A. 能使酸性KMnO4溶液褪色B. 最多能与2倍物质的量的NaOH反应
C. 能与NaHCO3溶液反应生成CO2D. 能与浓溴水发生加成反应和取代反应
【答案】B
【解析】
【详解】A.由结构简式可知,有机物分子中含有的碳碳双键能与酸性高锰酸钾溶液发生氧化反应,使酸性高锰酸钾溶液褪色,故A正确;
B.由结构简式可知,有机物分子中含有1个羧基、1个酚羟基、一个酰胺基,最多能与3倍物质的量的NaOH反应,故B错误;
C.由结构简式可知,有机物分子中含有羧基,能与NaHCO3溶液反应生成CO2,故C正确;
D.有机物分子中含有的碳碳双键能与溴水发生加成反应,酚羟基的邻位上的H能和浓溴水中的溴原子发生取代反应,故D正确;
故选B。
6. 下列劳动项目与所述的化学知识没有关联的是
A. AB. BC. CD. D
【答案】A
【解析】
【详解】A.焙制蛋糕加入小苏打作膨松剂,是碳酸氢钠受热分解生成二氧化碳气体,与碳酸铵与酸反应的化学知识无关联,故A错误;
B.含氯消毒剂具有氧化性,可以用84消毒液清洁家居用品,与所述的化学知识有关联,故B正确;
C.用聚乳酸吸管代替传统塑料吸管,聚乳酸在自然界易降解,防止白色污染,与所述的化学知识有关联,故C正确;
D.重金属离子可使蛋白质变性,喷洒波尔多液防治农作物病害,与所述的化学知识有关联,故D正确;
故选:A。
7. 吡啶(C5H5N)是一种有机弱碱,可与盐酸反应生成盐酸盐(C5H5NHCl)。下列关于0.01ml/LC5H5NHCl水溶液的叙述正确的是
A. 水溶液的pH=2B. 加水稀释,pH降低
C. 水溶液中:c(Cl-)=c(C5H5NH)+c(H+)D. 水溶液中:c(Cl-)>c(C5H5NH+)>c(H+)
【答案】D
【解析】
【详解】A.吡啶(C5H5N)是一种有机弱碱,其对应的盐酸盐溶液显酸性,但水解是微弱的,所以0.01 ml/LC5H5NHCl水溶液的pH>2,A错误;
B.C5H5NHCl水溶液显酸性,加水稀释,C5H5NHCl溶液酸性减弱,pH升高,B错误;
C.C5H5NHCl水溶液中存在电荷守恒,表达式为:c(H+)+c(Cl-)=c(C5H5NH+)+c(H+),C错误;
D.C5H5NHCl水溶液中主要存在Cl-和C5H5NH+,C5H5NH+会发生水解使得溶液显酸性,故 c(Cl-)> c(C5H5NH+)>c(H+)>c(OH-), D正确;
故选D。
8. 部分含氮物质的分类与相应化合价关系如图所示。下列推断不合理的是
A. a可经催化氧化生成cB. b既可被氧化,也可被还原
C. d与水反应只生成eD. “雷雨发庄稼”包括b→c→d→e的转化
【答案】C
【解析】
【分析】部分含氮物质的分类与相应化合价关系如图所示,价态和物质分类分析得到,a为NH3,b为N2,c为NO,d为NO2,e为HNO3。
【详解】A.NH3可经催化氧化生成NO,氨气和氧气反应生成NO和水,故A正确;
B.N2中氮元素化合价0价,可以升高,也可以降低,既可被氧化,也可被还原,故B正确;
C.NO2与水反应生成HNO3和NO,故C错误;
D.“雷雨发庄稼”氮气先与氧气在闪电条件下反应生成NO,继续被氧化为二氧化氮,再与水反应生成硝酸,包括N2→NO→NO2→HNO3的转化,故D正确;
故选:C。
9. 如图装置能保护埋在潮湿土壤中的钢铁输水管,减缓钢铁输水管的锈蚀。下列说法不正确的是
A. 钢铁被腐蚀时电极反应为Fe-2e-=Fe2+B. 该装置利用了牺牲阳极法进行防腐
C. 该装置钢铁输水管是电池的正极D. 该装置电子从钢铁输水管经导线流向镁
【答案】D
【解析】
【分析】该金属防护措施采用的是牺牲阳极法,即金属镁、钢管和土壤电解质溶液构成原电池,金属Mg是活泼金属、发生失电子的反应、作负极,负极反应式为Fe-2e-=Fe2+,钢铁作正极,正极上氧气等物质发生得电子的还原反应生成OH-,放电时电子由负极经过导线流向正极。
【详解】A.钢铁被腐蚀时Fe失电子生成Fe2+,负极反应式为Fe-2e-=Fe2+,故A正确;
B.金属Mg比Fe活泼,该金属防护措施利用原电池原理,即为牺牲阳极法,故B正确;
C.金属镁、钢管和土壤电解质溶液构成原电池时Mg发生失电子的反应、作负极,钢铁作正极,故C正确;
D.该装置为原电池,镁作负极,钢铁作正极,放电时电子从镁经导线流向钢铁输水管,故D错误;
故选:D。
10. 将铜丝浸没在浓硫酸中加热,按如图装置进行含硫物质的实验。下列说法不正确的是
A. Cu与浓硫酸反应,体现H2SO4的酸性和氧化性
B. 蓝色石蕊试纸变红,说明SO2是酸性氧化物
C. 品红试纸和酸性KMnO4溶液均褪色,体现SO2的还原性
D. Na2S溶液中出现淡黄色浑浊,体现SO2的氧化性
【答案】C
【解析】
【分析】Cu和浓硫酸在加热条件下反应生成CuSO4和SO2,SO2使品红溶液褪色体现二氧化硫的漂白性,SO2具有还原性,能使酸性高锰酸钾溶液褪色,SO2水溶液使蓝色石蕊试纸变红,SO2与Na2S溶液反应生成S单质,出现淡黄色浑浊;
【详解】A.Cu和浓硫酸在加热条件下反应生成CuSO4和SO2,生成CuSO4的硫酸体现酸性,生成SO2的硫酸体现氧化性,所以该反应中浓硫酸体现酸性和氧化性,故A正确;
B.蓝色石蕊试纸变红,说明SO2和水反应生成酸,则SO2为酸性氧化物,故B正确;
C.SO2使品红溶液褪色体现二氧化硫的漂白性,SO2使酸性高锰酸钾溶液褪色体现二氧化硫的还原性,故C错误;
D.Na2S溶液中出现淡黄色浑浊,说明有S单质生成,反应过程中,SO2中的S元素化合价由+4价变为0价,所以SO2体现氧化性,故D正确;
故选:C。
11. 设NA为阿伏加德罗常数的值。氯碱工业涉及NaCl、Cl2、H2、NaOH等物质,下列说法正确的是
A. 1.0ml/LNaCl溶液中Cl-数目为NA
B. 电解生成1mlCl2理论上转移电子数为2NA
C. 标准状况下22.4LH2的质子数为NA
D. 40gNaOH固体中含有极性共价键的数目为2NA
【答案】B
【解析】
【详解】A.缺少溶液的体积,无法计算1.0ml/L氯化钠溶液中氯化钠的物质的量和含有氯离子的数目,故A错误;
B.氯化钠溶液电解生成1ml氯气时,反应转移电子数目为1ml×2×NAml—1=2NA,故B正确;
C.氢气分子的质子数为2,则标准状况下22.4L氢气的质子数为×2×NAml—1=2NA,故C错误;
D.氢氧化钠是含有离子键和共价键的离子化合物,40g氢氧化钠固体中含有极性共价键的数目为×1×NAml—1=NA,故D错误;
故选B。
12. 乙烯直接水合法生产乙醇的反应为C2H4(g)+H2O(g)C2H5OH(g)。下图为乙烯的平衡转化率与温度、压强的关系[其中n(H2O):n(C2H4)=1:1],下列说法正确的是
A. p1>p2>p3
B. 该反应>0
C. M点C2H5OH的平衡产率为20%
D. 恒压条件下向M点的体系中通入乙烯,乙烯的平衡转化率增大
【答案】C
【解析】
【详解】A.该反应是气体体积减小的反应,增大压强,平衡正向移动,乙烯的转化率增大,由图可知,相同温度下转化率p1<p2<p3,因此压强p1<p2<p3,故A错误;
B.温度升高,乙烯的转化率降低,平衡逆向移动,正向为放热反应,ΔH<0,故B错误;
C.由乙烯直接水合法生产乙醇的反应为C2H4(g)+H2O(g)⇌C2H5OH(g)可知乙烯的转化率=乙醇的产率,则M点C2H5OH的平衡产率为20%,故C正确;
D.恒压条件下向M点的体系中通入乙烯,体积增大,乙烯的平衡转化率减小,故D错误;
故选:C。
13. 下列陈述与陈述均正确,且具有因果关系的是
A. AB. BC. CD. D
【答案】B
【解析】
【详解】A.Na是活泼金属,常温与氧气反应生成Na2O,加热条件下Na和氧气反应生成Na2O2,且密度大于煤油,金属钠应保存在煤油中,故A错误;
B.存在的平衡为2NO2(g)⇌N2O4(g),装有NO2的密闭烧瓶浸泡在热水中颜色变深,即升高平衡逆向移动,则NO2转化为N2O4放热,N2O4转化为NO2的反应吸热,故B正确;
C.AlCl3溶液与氨水的反应为AlCl3+3NH3•H2O=Al(OH)3↓+3NH4Cl,说明碱性:NH3•H2O>Al(OH)3,与Al(OH)3加热分解生成Al2O3无关,故C错误;
D.甲苯被酸性高锰酸钾溶液氧化生成苯甲酸,酸性KMnO4溶液的紫红色褪去,说明与苯环相连的甲基易被氧化,甲苯分子中不含有碳碳双键,故D错误;
故选:B。
14. 下列反应的方程式书写不正确的是
A. H2O(g)通过灼热铁粉:3H2O(g)+2FeFe2O3+3H2
B. 金属钠加入水中:2Na+2H2O=2Na++2OH-+H2↑
C. Na2CO3溶液处理水垢中的CaSO4:(aq)+CaSO4(s)CaCO3(s)+(aq)
D. Na2S2O3溶液中加入稀硫酸:+2H+=SO2↑+S↓+H2O
【答案】A
【解析】
【详解】A.H2O(g)通过灼热铁粉:4H2O(g)+3FeFe3O4+4H2,A错误;
B.金属钠加入水中反应生成氢氧化钠和氢气,反应的离子方程式为:2Na+2H2O═2Na++2OH-+H2↑,B正确;
C.Na2CO3溶液处理水垢中的CaSO4反应,发生沉淀转化:(aq)+CaSO4(s)CaCO3(s)+(aq),C正确;
D.Na2S2O3溶液中加入稀硫酸反应生成硫酸钠、硫单质和二氧化硫,+2H+═SO2↑+S↓+H2O,D正确;
故答案为:A。
15. 净化污水用到的某种絮凝剂的主要成分为XYZ4(ME4)2,所含的5种短周期主族元素在每个周期均有分布,M与E为第ⅥA族元素,Y的基态原子价层p轨道半充满,Y与E同周期,X是在地壳中含量最多的金属元素。下列说法正确的是
A. 元素电负性:Y>E>ZB. 简单氢化物沸点:Y>E>M
C. 第一电离能:Y>E>XD. ME3和的空间结构均为平面三角形
【答案】C
【解析】
【分析】XYZ4( ME4)2所含的5种短周期主族元素在每个周期均有分布,则有一种元素是H元素;其中X是在地壳中含量最多的金属元素,则X为A1元素;M与E为第ⅥA族元素,二者分别为O、S中的一种,Y的基态原子价层p轨道半充满,可知Y处于ⅤA族,而Y与E同周期,结合化学式可知Y为N元素、E为O元素、M为S元素,则Z为H元素。然后根据元素周期律及物质的性质分析解答。
【详解】根据分析可知:X为A1元素、Y为N元素、Z为H元素、M为S元素、E为O元素。
A.同周期主族元素从左向右元素的电负性逐渐增大。N、O在它们的氢化物中都表现负价,说明它们的电负性都比氢大,则电负性E(O)>Y(N)>Z(H),A错误;
B.Y、E、M的简单氢化物分别为NH3、H2O、H2S。常温下,H2O是液体,而NH3、H2S是气体,则说明H2O的沸点最高;NH3分子之间形成氢键,H2S分子之间只存在范德华力,因此NH3的沸点比H2S高,即沸点:E(H2O)>Y(NH3)>M(H2S),B错误;
C.Al是活泼金属元素,N、O是非金属元素,则A1的第一电离能最小,N元素2p轨道为半充满稳定状态,N的第一电离能比O大,即第一电离能:Y(N)>E(O)>X(Al),C正确;
D.SO3分子中心原子S原子价层电子对数=3+=3,其空间构型为平面三角形;的中心原子S原子价层电子对数=3+=4,其空间构型为三角锥形,D错误;
故合理选项是C。
16. 我国科学家研发了一种新型Zn-CO2水介质电池,其工作原理如图所示。工作时H2O在双极膜界面处解离成H+和OH-,放电时下列说法不正确的是
A. CO2在多孔Pd纳米片表面转化为甲酸
B. 正极区溶液的pH减小
C. 负极的电极反应式为Zn+4OH-_2e-=
D. 每生成1ml甲酸,双极膜处有4mlH2O解离
【答案】D
【解析】
【分析】由题干原电池装置图可知,放电时,Zn电极上Zn失电子和OH-反应生成,电极反应式为Zn-2e-+4OH-=,则Zn电极为负极,多孔Pd纳米片为正极,正极上CO2和H+反应生成HCOOH,电极反应式为CO2+2H++2e-=HCOOH,双极膜中间物质为H2O,H2O在双极膜界面处解离成H+和OH-,H+通过阳离子交换膜进入右侧区域,OH-通过阴离子交换膜进入左侧区域。
【详解】A.通过以上分析知,CO2在多孔Pd纳米片表面得电子和氢离子反应转化为甲酸,A正确;
B.多孔Pd纳米片为正极,正极上生成甲酸,溶液的pH减小,B正确;
C.通过以上分析知,负极反应式为Zn+4OH--2e-=,C正确;
D.每生成1ml甲酸,右侧消耗2ml氢离子,则双极膜处有2ml H2O解离,D错误;
故答案为:D。
二、非选择题:本题共4小题,共56分。
17. 某小组通过下列实验测定可逆反应的平衡常数。
(1)配制溶液
由固体配制溶液,需要的仪器有烧杯、药匙、玻璃棒、___________(从下列图中选择,写出名称)。
(2)验证反应是可逆反应
实验I:将溶液和溶液
等体积混合,产生灰黑色沉淀,溶液呈黄色。
①取实验I反应后的上层清液或沉淀进行实验,将表格补充完整。
实验2中灰黑色沉淀溶解的离子方程式为___________。
②至少完成表格中实验___________(选填1、2、3、4),可证明该反应为可逆反应。
(3)测定反应的平衡常数
查阅资料:通过氧化还原滴定法可测定平衡时,再计算得出和,进而求算出平衡常数K。
实验Ⅱ:室温下,待实验I中反应达到平衡状态时,取上层清液,用标准溶液滴定,达到滴定终点记录消耗标准溶液的体积。重复实验3次,平均消耗标准溶液的体积为。
①计算平衡时___________,平衡常数___________(用含的计算式表示)。
②若取实验Ⅰ中的浊液进行实验Ⅱ,会使测得的平衡常数值___________(填“偏高”“偏低”或“不受影响”),原因是___________(用化学平衡移动原理解释)。
【答案】(1)100mL容量瓶和胶头滴管
(2) ①. 白色沉淀 ②. K3[Fe(CN)6] ③. Ag+2H++=Ag++NO2↑+H2O ④. 1、3或2、3
(3) ①. ②. ③. 偏低 ④. 浊液中存在,滴定时平衡向左移动,导致被消耗的体积增大,值偏低
【解析】
【分析】要证明为可逆反应只要证明生成物和反应物同时存在;通过测定平衡时Fe2+的浓度、结合转化浓度之比等于化学计量数之比确定平衡时各物质的物质的量浓度,进一步计算化学平衡常数。
【小问1详解】
由FeSO4∙7H2O固体配制100mL0.040ml/LFeSO4溶液的实验步骤为:计算、称量、溶解、冷却、转移、洗涤、定容、摇匀等,需要的仪器有烧杯、药匙、玻璃棒、100mL容量瓶、胶头滴管等,不需要坩埚、分液漏斗、球形冷凝管。
【小问2详解】
①取上层清液,滴加NaCl溶液,产生白色沉淀可得出结论:存在Ag+;要检验Fe2+可取上层清液,滴加K3[Fe(CN)6]溶液,产生蓝色沉淀;实验2取少量灰黑色沉淀,滴加浓硝酸,沉淀溶解,出现红棕色气体,证明存在Ag,Ag与浓硝酸反应生成AgNO3、NO2和H2O,反应的离子方程式为Ag++2H+=Ag++NO2↑+H2O。
②将0.010ml/LAg2SO4溶液和0.040ml/LFeSO4溶液等体积混合,发生反应Ag++Fe2+Fe3++Ag↓后FeSO4一定过量,故要证明该反应为可逆反应,要检验存在生成物Ag或Fe3+和Ag+、不能检验Fe2+,故证明该反应为可逆反应,至少完成表格中实验1、3或2、3。
【小问3详解】
①Fe2+具有还原性,KMnO4具有强氧化性,两者发生的反应为5Fe2+++8H+=5Fe3++Mn2++4H2O,则c(Fe2+)=ml/L;消耗的c(Fe2+)=(0.02-)ml/L,则平衡时c(Ag+)=0.01ml/L-(0.02-)ml/L=(-0.01)ml/L、c(Fe3+)=(0.02-)ml/L,反应的平衡常数K=。
②若取实验Ⅰ中的浊液进行实验Ⅱ,浊液中存在Ag,滴定Fe2+时,随着c(Fe2+)减小,平衡Ag++Fe2+Fe3++Ag↓向左移动,导致被Fe2+消耗的KMnO4溶液体积V1增大,K值偏低。
18. 镓、锗均是重要金属,一种从炼锌矿渣[主要含铁酸锗GeFe2O5、铁酸镓Ga2(Fe2O4)3、铁酸锌ZnFe2O4]回收镓、锗、锌的工艺流程如下:
已知:①25℃时,Ksp[Ga(OH)3]=3.0×10-36,Ksp[Zn(OH)2]=2.5×10-17,Kb(NH3·H2O)=1.75×10-5。
②Ga与Al同主族,化学性质相似。
回答下列问题:
(1)基态Fe原子的价层电子排布式为___________。
(2)“酸浸还原”中,Ga2(Fe2O4)3转化为Ga3+和Fe2+,该反应的离子方程式为___________。
(3)“沉镓"所得ZnSO4溶液中Zn2+浓度为0.25ml/L,25℃时,为了提取尽可能多的Ga3+且避免Ga(OH)3中混入Zn(OH)2沉淀,需要调节溶液pH小于___________,此时“沉镓”所得滤液中c(NH3·H2O)___________c()(填“>”“
相关试卷
这是一份[化学]2024~2025学年广东广州荔湾区广州市真光中学高三上学期开学考试化学试卷(原题版+解析版),文件包含2024_2025学年广东广州荔湾区广州市真光中学高三上学期开学考试化学试卷解析版pdf、2024_2025学年广东广州荔湾区广州市真光中学高三上学期开学考试化学试卷原题版pdf等2份试卷配套教学资源,其中试卷共20页, 欢迎下载使用。
这是一份2024届广东省广州市高三下学期三模化学试卷(原卷版+解析版),文件包含2024届广东省广州市高三下学期三模化学试卷原卷版docx、2024届广东省广州市高三下学期三模化学试卷解析版docx等2份试卷配套教学资源,其中试卷共31页, 欢迎下载使用。
这是一份广东省广州市天河区2023-2024学年高二上学期期末化学试卷(原卷版),文件包含广东省广州市天河区2023-2024学年高二上学期期末化学试卷原卷版docx、广东省广州市天河区2023-2024学年高二上学期期末化学试卷解析版docx等2份试卷配套教学资源,其中试卷共35页, 欢迎下载使用。








