





还剩12页未读,
继续阅读
人教版九下化学第十单元课时2酸的化学性质课件
展开
这是一份人教版九下化学第十单元课时2酸的化学性质课件,共20页。
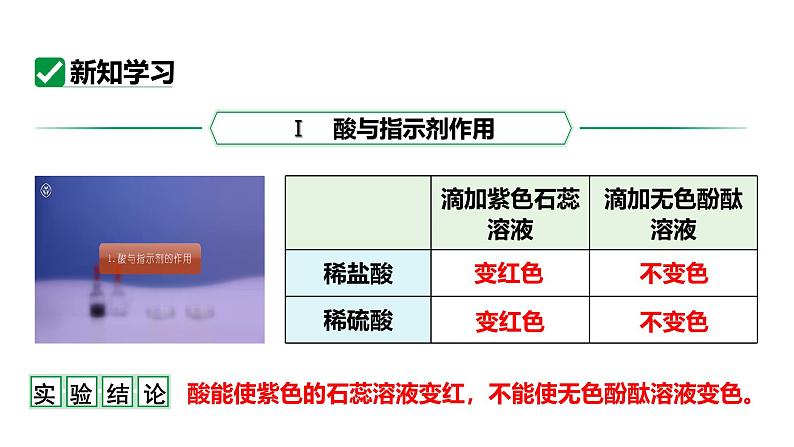
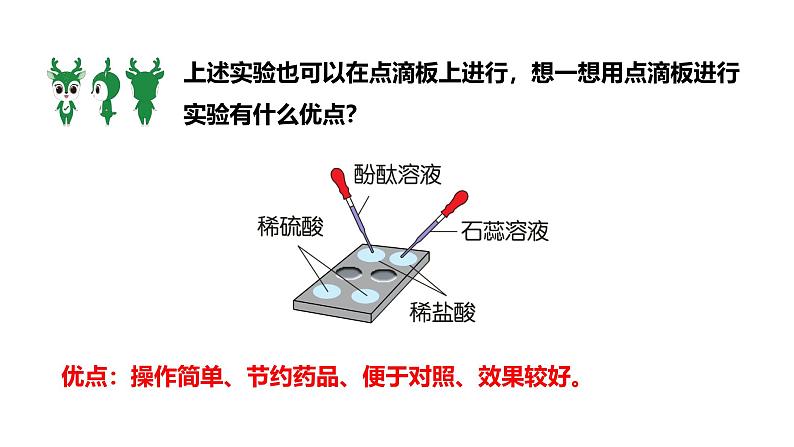
课时2 酸的化学性质九下 化学 人教版学习目标新课引入新知学习课堂小结1.探究并归纳酸的化学性质2.能书写与酸的化学性质有关的反应方程式 上节课我们学到了几种常见的酸,从名称上看,它们最后一个字都是“酸”,从组成上看,都含有氢元素!变红色变红色不变色不变色酸能使紫色的石蕊溶液变红,不能使无色酚酞溶液变色。优点:操作简单、节约药品、便于对照、效果较好。上述实验也可以在点滴板上进行,想一想用点滴板进行实验有什么优点? 回忆第八单元所学的镁、锌、铁分别与稀盐酸或稀硫酸的反应的现象。有气泡产生,固体逐渐减少有气泡产生,固体逐渐减少有气泡产生有气泡产生有气泡产生,溶液变为浅绿色有气泡产生,溶液变为浅绿色Mg + 2HCl === MgCl2 + H2↑Zn + 2HCl === ZnCl2 + H2↑Fe + 2HCl === FeCl2 + H2↑Mg + H2SO4 === MgSO4 + H2↑Zn + H2SO4 === ZnSO4 + H2↑Fe + H2SO4 === FeSO4 + H2↑写出化学方程式。都会生成氢气,另一生成物是金属离子与酸根离子构成的化合物(盐)。因为食醋中含有醋酸,能与铁、铝发生化学反应。想一想,为什么不可将醋放在铁锅中长时间烹调,不可用铝制品调拌要放醋的凉菜? 在盛有稀盐酸和稀硫酸的试管里分别放入一根生锈(铁锈的主要成分是Fe2O3)的铁钉,过一会儿取出,用水洗净,铁钉表面和溶液颜色有什么变化?铁锈消失,铁钉变得光亮,无色溶液变黄2.利用酸清除铁锈时,能否将金属制品长时间浸泡在酸中,为什么?1.以上反应的生成物有什么共同之处?不能。当铁钉表面的铁锈被清除完,酸将与铁发生反应。如盐酸:Fe + 2HCl === FeCl2 + H2↑酸能使酸碱指示剂显示不同的颜色,如酸溶液使紫色的石蕊溶液变红,使无色酚酞溶液不变色。酸能与活泼金属反应,产生氢气。利用此性质在实验室可用酸来制备氢气。酸能与某些金属氧化物反应,生成水。利用此性质可用稀盐酸或稀硫酸来除锈。 酸的通性酸的化学性质与金属反应与指示剂反应与活泼金属反应生成盐和氢气酸能使石蕊溶液变红色酸不能使酚酞溶液变色与某些金属氧化物反应生成盐和水与金属氧化物反应1.用足量的盐酸浸泡生锈的铁钉,可观察到的实验现象是( )①铁钉上的铁锈消失;②铁钉上有气泡产生;③溶液呈黄色。 A.只有①② B.只有①③ C.只有③ D.①②③D2.某工厂利用废铁屑与废硫酸反应制取硫酸亚铁。现有废硫酸9.8 t(H2SO4的质量分数为20%),与足量的废铁屑反应,可生产FeSO4的质量是多少?解:设可生产FeSO4的质量为x。解得 x = 3.04t答:可生产FeSO4的质量是3.04t。 98 1529.8t×20% xFe + H2SO4 === FeSO4 + H2↑3.学习完酸的化学性质,小凯构建了如图所示的知识网络图。请回答:(1)溶液X是一种酸,试剂A的名称是_____________。(2)若X是稀硫酸、B是氧化物,B的化学式为_______。无色溶液XABCD红色溶液无色气体浅绿色溶液黄色溶液紫色石蕊溶液Fe2O3(3)若X是稀盐酸、C是单质,则C的名称为_____。(4)若X是稀盐酸、D是碳酸钙,则X与D反应的化学方程式为 ___________________________________。无色溶液XABCD红色溶液无色气体浅绿色溶液黄色溶液铁2HCl + CaCO3 === CaCl2 + H2O + CO2↑4.向盛有一定量铜和氧化铜混合物的烧杯中滴加稀盐酸,边滴边搅拌,反应过程中剩余固体的质量与加入稀盐酸的质量如图所示,下列说法不正确的是( )A.M点时,剩余固体是铜和氧化铜B.M、N点时,溶液中的溶质均只有CuCl2C. P点时溶液的酸性比N点时强D.混合物中铜的质量为(a-b)gD A(√):铜与盐酸不反应,氧化铜与稀盐酸反应生成氯化铜和水。M点后剩余固体质量继续减小,可知继续发生氧化铜与稀盐酸的反应,因此M点时剩余固体是铜和氧化铜。B(√):M点时溶液中的溶质为反应生成的氯化铜,N点时氧化铜与稀盐酸恰好完全反应,此时溶液中的溶质为反应生成的氯化铜。C(√):N点时氧化铜与稀盐酸恰好完全反应,P点时稀盐酸过量,故P点时溶液的酸性比N点时强。D(×):铜不参与反应,反应后所剩固体为铜,即铜的质量为bg。对应巩固练习见《基础题与中考新考法》
课时2 酸的化学性质九下 化学 人教版学习目标新课引入新知学习课堂小结1.探究并归纳酸的化学性质2.能书写与酸的化学性质有关的反应方程式 上节课我们学到了几种常见的酸,从名称上看,它们最后一个字都是“酸”,从组成上看,都含有氢元素!变红色变红色不变色不变色酸能使紫色的石蕊溶液变红,不能使无色酚酞溶液变色。优点:操作简单、节约药品、便于对照、效果较好。上述实验也可以在点滴板上进行,想一想用点滴板进行实验有什么优点? 回忆第八单元所学的镁、锌、铁分别与稀盐酸或稀硫酸的反应的现象。有气泡产生,固体逐渐减少有气泡产生,固体逐渐减少有气泡产生有气泡产生有气泡产生,溶液变为浅绿色有气泡产生,溶液变为浅绿色Mg + 2HCl === MgCl2 + H2↑Zn + 2HCl === ZnCl2 + H2↑Fe + 2HCl === FeCl2 + H2↑Mg + H2SO4 === MgSO4 + H2↑Zn + H2SO4 === ZnSO4 + H2↑Fe + H2SO4 === FeSO4 + H2↑写出化学方程式。都会生成氢气,另一生成物是金属离子与酸根离子构成的化合物(盐)。因为食醋中含有醋酸,能与铁、铝发生化学反应。想一想,为什么不可将醋放在铁锅中长时间烹调,不可用铝制品调拌要放醋的凉菜? 在盛有稀盐酸和稀硫酸的试管里分别放入一根生锈(铁锈的主要成分是Fe2O3)的铁钉,过一会儿取出,用水洗净,铁钉表面和溶液颜色有什么变化?铁锈消失,铁钉变得光亮,无色溶液变黄2.利用酸清除铁锈时,能否将金属制品长时间浸泡在酸中,为什么?1.以上反应的生成物有什么共同之处?不能。当铁钉表面的铁锈被清除完,酸将与铁发生反应。如盐酸:Fe + 2HCl === FeCl2 + H2↑酸能使酸碱指示剂显示不同的颜色,如酸溶液使紫色的石蕊溶液变红,使无色酚酞溶液不变色。酸能与活泼金属反应,产生氢气。利用此性质在实验室可用酸来制备氢气。酸能与某些金属氧化物反应,生成水。利用此性质可用稀盐酸或稀硫酸来除锈。 酸的通性酸的化学性质与金属反应与指示剂反应与活泼金属反应生成盐和氢气酸能使石蕊溶液变红色酸不能使酚酞溶液变色与某些金属氧化物反应生成盐和水与金属氧化物反应1.用足量的盐酸浸泡生锈的铁钉,可观察到的实验现象是( )①铁钉上的铁锈消失;②铁钉上有气泡产生;③溶液呈黄色。 A.只有①② B.只有①③ C.只有③ D.①②③D2.某工厂利用废铁屑与废硫酸反应制取硫酸亚铁。现有废硫酸9.8 t(H2SO4的质量分数为20%),与足量的废铁屑反应,可生产FeSO4的质量是多少?解:设可生产FeSO4的质量为x。解得 x = 3.04t答:可生产FeSO4的质量是3.04t。 98 1529.8t×20% xFe + H2SO4 === FeSO4 + H2↑3.学习完酸的化学性质,小凯构建了如图所示的知识网络图。请回答:(1)溶液X是一种酸,试剂A的名称是_____________。(2)若X是稀硫酸、B是氧化物,B的化学式为_______。无色溶液XABCD红色溶液无色气体浅绿色溶液黄色溶液紫色石蕊溶液Fe2O3(3)若X是稀盐酸、C是单质,则C的名称为_____。(4)若X是稀盐酸、D是碳酸钙,则X与D反应的化学方程式为 ___________________________________。无色溶液XABCD红色溶液无色气体浅绿色溶液黄色溶液铁2HCl + CaCO3 === CaCl2 + H2O + CO2↑4.向盛有一定量铜和氧化铜混合物的烧杯中滴加稀盐酸,边滴边搅拌,反应过程中剩余固体的质量与加入稀盐酸的质量如图所示,下列说法不正确的是( )A.M点时,剩余固体是铜和氧化铜B.M、N点时,溶液中的溶质均只有CuCl2C. P点时溶液的酸性比N点时强D.混合物中铜的质量为(a-b)gD A(√):铜与盐酸不反应,氧化铜与稀盐酸反应生成氯化铜和水。M点后剩余固体质量继续减小,可知继续发生氧化铜与稀盐酸的反应,因此M点时剩余固体是铜和氧化铜。B(√):M点时溶液中的溶质为反应生成的氯化铜,N点时氧化铜与稀盐酸恰好完全反应,此时溶液中的溶质为反应生成的氯化铜。C(√):N点时氧化铜与稀盐酸恰好完全反应,P点时稀盐酸过量,故P点时溶液的酸性比N点时强。D(×):铜不参与反应,反应后所剩固体为铜,即铜的质量为bg。对应巩固练习见《基础题与中考新考法》
相关资料
更多









