





高中化学苏教版 (2019)选择性必修1专题2 化学反应速率与化学平衡第三单元 化学平衡的移动课文课件ppt
展开必备知识 自主预习储备
一、化学平衡状态的移动1.化学平衡移动的概念与实质(1)概念:当一个可逆反应达到平衡后,如果____、____、温度等反应条件改变,原来的平衡状态被破坏,化学平衡会移动,在一段时间后会达到________________。(2)实质:改变条件后,①v正≠v逆,②各组分的百分含量发生改变。
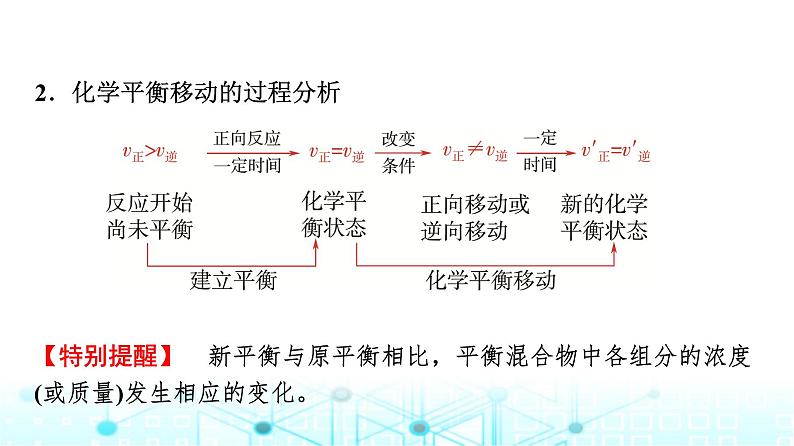
2.化学平衡移动的过程分析
【特别提醒】 新平衡与原平衡相比,平衡混合物中各组分的浓度(或质量)发生相应的变化。
3.化学平衡移动方向的判断
判一判 (正确的打“√”,错误的打“×”)(1)改变条件使v正增大了,则化学平衡一定向正反应方向移动。( )(2)化学平衡向正反应方向移动,v逆一定比v正小。( )(3)平衡与原平衡相比,平衡混合物中各组分的浓度(或质量)发生相应的变化。( )
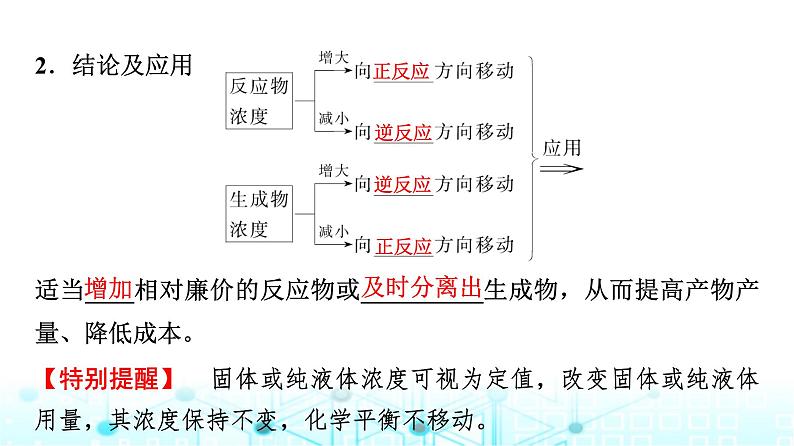
适当____相对廉价的反应物或__________生成物,从而提高产物产量、降低成本。
【特别提醒】 固体或纯液体浓度可视为定值,改变固体或纯液体用量,其浓度保持不变,化学平衡不移动。
判一判 (正确的打“√”,错误的打“×”)(1)合成氨反应中,增加N2的浓度,可使平衡正向移动,提高H2的转化率,降低成本。( )(2)C(s)+H2O(g)⥫⥬CO(g)+H2(g)在某温度下达到平衡后,增加一部分C(s),v正增大,平衡正向移动。( )(3)改变固体或纯液体用量,化学平衡不移动。( )
【特别提醒】 浓度商Qc与平衡常数K的表达式在形式上相同,但含义不同。计算平衡常数K必须代入各物质在平衡状态时的物质的量浓度,计算浓度商Qc只需代入各物质在某一时刻(可以不处于平衡状态)的物质的量浓度。
3.应用判断一定温度下、任意状态时反应体系平衡移动的情况若Qc
【特别提醒】 用浓度商预测化学平衡移动的方向,必须知道某温度下该反应的化学平衡常数K,并以此为标准,与同温度下、同一化学反应的浓度商Qc进行比较,由两者的相对大小即可判断化学平衡移动的方向。
练一练 镍具有较好的耐腐蚀,耐高温,防锈等性能,被广泛应用到不锈钢和合金钢等钢铁领域。在1 000 K时,镍可以发生反应Ni(s)+H2O(g)⥫⥬NiO(s)+H2(g),已知反应的平衡常数K=0.059,当水蒸气和氢气的物质的量浓度相等时,此反应是否平衡?如果不平衡反应向哪个方向进行?
提示:当水蒸气和氢气浓度相等时,Qc=1,K=0.059,Qc>K,反应逆向进行。
四、压强变化对化学平衡的影响1.压强对平衡移动的影响的实例探讨
【特别提醒】 对于只有固体或液体参加的反应,反应前后气体分子数不变的反应,改变压强,平衡不发生移动。
判一判 (正确的打“√”,错误的打“×”)(1)有气体参与的反应,改变压强,平衡一定发生移动。( )(2)增大压强可使2SO2(g)+O2(g) 2SO3(g)平衡向正反应方向移动,原因是增大压强,v正增大,v逆减小。( )(3)对CO(g)+H2O(g)⥫⥬CO2(g)+H2(g),在其他条件不变时,改变压强,平衡不移动。( )(4)对2HI(g)⥫⥬H2(g)+I2(g),其他条件不变时,增大压强,体系的颜色加深,平衡正向移动。( )
五、温度变化对化学平衡的影响1.实验探究
2.结论(其他条件不变化时)升高温度,化学平衡向____反应方向移动;降低温度,化学平衡向____反应方向移动。
【特别提醒】 温度变化,化学平衡一定会发生移动。
判一判 (正确的打“√”,错误的打“×”)(1)温度可以影响任意可逆反应的化学平衡状态。( )(2)升高温度,反应速率加快,化学平衡正向移动。( )(3)升高温度,反应速率加快,但反应物的转化率可能降低。( )(4)升高温度,化学平衡常数增大。( )
六、催化剂对化学平衡的影响加入催化剂可以大大地加快反应速率,是因为它可以降低反应所需______,从而提高活化分子________,从而增大反应速率,但是由于催化剂能够________地改变正、逆反应速率,因此它对化学平衡移动___影响。
【特别提醒】 催化剂不能改变达到化学平衡状态时反应混合物的组成,但是使用催化剂能同等程度地增大正、逆反应速率,缩短达到平衡所需要的时间。
七、勒夏特列原理1.概念如果改变影响平衡的一个因素(如浓度、压强或温度),平衡将向能够____这种改变的方向移动,也称化学平衡移动原理。
2.应用工业合成氨反应:N2(g)+3H2(g)⥫⥬2NH3(g) ΔH=-92.4 kJ·ml-1。
3.正确理解化学平衡移动原理(1)勒夏特列原理中的“减弱”不等于“消除”,更不是“扭转”,具体可理解如下:①若将体系温度从50 ℃升高到80 ℃,则化学平衡向吸热反应方向移动,达到新的平衡状态时50 ℃
关键能力 情境探究达成
(一)浓度对化学平衡的影响[情境素材]实验探究浓度对化学平衡的影响
[问题2] 反应C(s)+H2O(g)⥫⥬CO(g)+H2(g)在密闭容器中进行,已达平衡状态。现向容器中加入炭粉,化学平衡如何移动?
提示:化学平衡不移动。固体和纯液体的改变对平衡移动无影响。
提示:(1)当Qc=K时,反应处于平衡状态,v正=v逆;(2)当Qc
[问题探究][问题1] 对于可逆反应2NO2(g)⥫⥬N2O4(g),在恒温、恒容的密闭容器中,充入“惰性气体”,原平衡怎样移动?
提示:充入“惰性气体”,由于容器体积不变,引起压强增大,但各组分的浓度不变,平衡不移动。
[问题2] 对于可逆反应2NO2(g)⥫⥬N2O4(g),在恒温、恒压的密闭容器中,充入“惰性气体”,原平衡怎样移动?
提示:充入“惰性气体”,引起容器体积增大,引起各反应组分浓度减小,平衡向气体总体积增大的方向移动,即该反应向逆反应方向移动。
(三)温度对化学平衡移动的影响[情境素材]实验探究温度对化学平衡移动的影响。
[问题探究][问题1] 对一定条件下的化学平衡状态:(1)若改变物质的浓度,化学平衡是否一定发生移动?(2)若改变体系的温度,化学平衡是否一定发生移动?
提示:(1)不一定。改变浓度化学平衡不定发生移动,如H2(g)+I2(g)⥫⥬2HI(g),其他条件不变,把容器体积缩小,浓度增大,但平衡不移动。(2)一定。若改变温度,化学平衡一定发生移动。
[问题2] 平衡常数只与温度有关,对于可逆反应2NO2(g)⥫⥬N2O4(g) ΔH=-56.9 kJ·ml-1,升高温度,平衡常数如何变化?
提示:升高温度,化学平衡向吸热反应方向移动,该可逆反应是放热反应,因此升高温度该反应向逆反应方向移动,反应物的浓度增大,生成物的浓度减小,故平衡常数减小。
[归纳总结]1.浓度对化学平衡的影响规律及解释(1)浓度对化学平衡移动的影响规律
(1)“浓度对化学平衡移动的影响”中的“浓度”是指与反应有关的气体或溶液中参加反应的离子的浓度。(2)对于离子平衡体系,注意离子浓度的改变方式,排除不参与反应的离子的干扰。(3)固体或纯液体的浓度是常数,改变固体或纯液体的量并不影响v正、v逆的大小,平衡不移动。
2.压强对化学平衡移动的影响规律及解释(1)在其他条件不变时:
(2)利用平衡常数分析压强对化学平衡移动的影响
3.温度对化学平衡移动的影响规律
4.催化剂对化学平衡的影响规律
(1)加入催化剂可以大大地加快反应速率,是因为它可以降低反应所需活化能,从而提高活化分子百分数,从而增大反应速率,但是由于催化剂能够同等程度地改变正、逆反应速率,因此它对化学平衡移动无影响。(2)催化剂不能改变达到化学平衡状态时的反应混合物中的组成含量,但是使用催化剂能改变反应达到平衡所需的时间。
[能力达成]1.已知反应:2NO2(g)⥫⥬N2O4(g),把NO2、N2O4的混合气体盛装在两个连通的烧瓶里,然后用弹簧夹夹住橡皮管,把烧瓶A放入热水里,把烧瓶B放入冰水里,如图所示。与常温时烧瓶内气体的颜色进行对比发现,A烧瓶内气体颜色变深,B烧瓶内气体颜色变浅。下列说法错误的是( )A.题述过程中,A烧瓶内正、逆反应速率均加快B.题述过程中,B烧瓶内c(NO2)减小,c(N2O4)增大C.题述过程中,A、B烧瓶内气体密度均保持不变D.反应2NO2(g)⥫⥬N2O4(g)的逆反应为放热反应
热水 冰水 常温
D [升高温度,正、逆反应速率都增大,A项正确;B烧瓶内气体颜色变浅,说明平衡向生成N2O4的方向移动,B烧瓶内c(NO2)减小,c(N2O4)增大,B项正确;容器的容积不变,混合气体的质量不变,A、B烧瓶内气体密度都不变,C项正确;放在热水中的A烧瓶内气体颜色变深,放在冰水中的B烧瓶内气体颜色变浅,说明升高温度平衡向生成NO2的方向移动,降低温度平衡向生成N2O4的方向移动,故反应2NO2(g)⥫⥬N2O4(g)的正反应为放热反应,D项错误。]
2.利用反应:2NO(g)+2CO(g)⥫⥬2CO2(g)+N2(g) ΔH=-746.8 kJ·ml-1,可净化汽车尾气,如果要同时提高该反应的速率和NO的转化率,采取的措施是( )A.降低温度B.增大压强同时加催化剂C.升高温度同时充入N2D.及时将CO2和N2从反应体系中移走
B [A项,降温,平衡右移,NO的转化率提高,但反应速率降低,A错;B项,增大压强,平衡右移,NO的转化率提高,加入催化剂,可大幅度加快反应速率,B对;C项,升温,充入N2,平衡左移,NO的转化率降低,C错;D项,移走CO2和N2,平衡右移,但反应速率降低,D错。]
3.已知反应:mA(g)+nB(g)⥫⥬pC(g)+qD(g),当反应达到平衡后,改变压强,其反应速率的变化曲线分别如图所示。
① ② ③
回答下列问题:(1)①表示改变压强的方式是________压强,化学平衡____________移动,m+n________p+q。(2)②表示改变压强的方式是_________压强,化学平衡__________移动,m+n__________p+q。(3)③表示改变压强的方式是_________压强,化学平衡__________移动,m+n__________p+q。
[解析] (1)图像①改变压强后,v′正、v′逆都增大,故改变压强的方式是增大压强;v′正小于v′逆,平衡向逆反应方向移动;增大压强平衡向气体体积减小的方向移动,故逆反应方向是气体体积减小的方向,即m+n<p+q。(2)图像②改变压强后,v′正、v′逆都减小,故改变压强的方式是减小压强;v′正大于v′逆,平衡向正反应方向移动;减小压强平衡向气体体积增大的方向移动,故正反应方向是气体体积增加的方向,即m+n<p+q。(3)图像③改变压强后,v′正、v′逆都减小,故改变压强的方式是减小压强;v′正、v′逆同等倍数的减小,化学平衡不移动,气体体积反应前后相等,即m+n=p+q。
[情境素材]工业合成氨的化学方程式为N2(g)+3H2(g)⥫⥬2NH3(g) ΔH<0,该反应在“高温、高压、催化剂”的条件下进行。
[问题探究][问题1] 该反应在“高温、高压、催化剂”的条件下进行。如何用勒夏特列原理解释?不能用勒夏特列原理解释的是什么?为什么?
提示:该反应的正反应是放热反应,升高温度,化学平衡向吸热反应方向(逆反应方向)移动;该反应为反应后气体体积减小的反应,增大压强化学平衡向减弱压强增大的方向(正反应方向)移动。催化剂只能改变化学反应速率,不能用勒夏特列原理解释。
[问题2] 哪些情况不能用勒夏特列原理解释?举例说明。
提示:(1)若同时改变影响平衡移动的几个条件,不能简单根据勒夏特列原理来判断平衡移动的方向,只有在改变的条件对平衡移动的方向影响一致时,才能根据勒夏特列原理来判断平衡移动的方向。如A(g)+3B(g)⥫⥬2C(g) ΔH<0,对该反应同时加压、升温,平衡移动的方向无法确定;若加压的同时降温,则平衡向正反应方向移动。(2)对于不可逆过程或未达到平衡状态的可逆反应及反应速率进行的快慢、催化剂的催化作用等问题,均不能用勒夏特列原理解释。
[归纳总结]对勒夏特列原理中“减弱这种改变”的正确理解(1)定性角度:用于判断平衡移动的方向。(2)定量角度:“减弱”不等于“消除”,更不是“扭转”。
[能力达成]1.下列事实能用勒夏特列原理解释的是( )A.加入催化剂有利于合成氨的反应B.压缩氢气与碘蒸气反应的平衡混合气体,颜色变深C.500 ℃时比室温更有利于合成氨的反应D.将混合气体中的氨液化有利于合成氨反应
D [A、B两项,改变条件平衡均不移动,不能用勒夏特列原理解释;C项,根据勒夏特列原理,温度越低,NH3百分含量越高,采取500 ℃,主要考虑催化剂的活性和反应速率问题;D项,将混合气体中的氨液化,相当于减小了生成物的浓度,平衡正向移动,有利于合成氨反应。]
2.(1)在合成氨工业生产中,通常通过以下途径来提高合成氨的产量或产率。请分析采取这些措施的原因。①在反应器中注入过量N2 _______________________________。②采用适当的催化剂___________________________。③在高压下进行反应____________________________________。④在较高温度下进行反应_________________________________________________。
为了提高H2的转化率,提高产率
使反应具有较快的反应速率
为了提高N2和H2的转化率,提高产率
为了加快反应速率,且使催化剂(铁触媒)
(2)已知2SO2(g)+O2(g)⥫⥬2SO3(g) ΔH<0,其实验数据如下:
则工业上生产硫酸的合成塔中应选择的适宜温度是________,适宜压强是____________。
1.01×105 Pa
[解析] (1)根据合成氨的反应特点,从反应的限度来考虑,使用过量的N2和高压可以使平衡向正反应方向移动,提高原料转化率、氨的产率;从反应的速率来考虑,采用催化剂和较高温度能保证反应较快地进行,且使催化剂的活性最佳。(2)从化学方程式和表中数据可以看出,温度越高,SO2的转化率越低;压强越大,SO2的转化率越高。但在1.01×105 Pa即常压条件下,SO2已经有较高的转化率,并且考虑到成本、设备等方面的情况,故采用常压;450 ℃时反应虽然比550 ℃时反应慢一些,但其转化率很理想(且催化剂活性最佳),故选择450 ℃、1.01×105 Pa。
学习效果 随堂评估自测
1.对处于化学平衡的体系,以化学平衡与化学反应速率的关系可知,下列说法正确的是( )A.正反应进行的程度大,正反应速率一定大B.由于某一条件的改变,使正、逆反应速率不再相等,平衡一定发生移动C.当正反应速率大于逆反应速率时,平衡向逆反应方向移动D.增大体系压强,化学反应速率加快,化学平衡一定正向移动
B [反应进行的程度与反应速率没有直接的关系,选项A错误;当v正>v逆时,平衡向正反应方向移动,选项C错误;增大压强,对有气体参加的反应来说,化学反应速率加快,但平衡向气体总体积减小的方向移动,若反应前后气体总体积不变,平衡则不发生移动,D项错误。]
3.如图是可逆反应A+2B⥫⥬2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况。由此可推断下列说法正确的是( )A.正反应是放热反应B.D可能是气体C.逆反应是放热反应D.A、B、C、D均为气体
A [降温后v′正>v′逆,平衡向正反应方向移动,说明正反应放热;加压后v″正>v″逆,平衡向正反应方向移动,说明正反应气体体积减小,则D不可能是气体。]
(3)研究温度对于甲醇产率的影响。在210~290℃,保持原料气中CO2和H2的投料比不变,按一定流速通过催化剂,得到甲醇的平衡产率与温度的关系如下图所示。该反应焓变ΔH____0(填“>”“=”或“<”),其依据是_____________________________。
温度升高甲醇的平衡产率减小
基础课时固基练(14) 化学平衡的移动
1.下列叙述中说明某化学平衡一定发生移动的是( )A.混合体系中气体密度发生变化B.正、逆反应速率改变C.混合物中各组分的浓度改变D.反应物的转化率改变
D [对于反应前后气体体积相等的反应来说,增大压强,气体的密度增大,平衡不移动,A错误;对于反应前后气体体积不变的反应,增大压强反应速率增大,但平衡不发生变化,B错误;对于反应前后气体体积相等的反应来说,增大体系的体积,体系各组分的物质的量浓度减小,平衡不移动,C错误;反应物的转化率发生变化,说明物质的量一定在变化,化学平衡一定发生移动,D正确。]
2.下列事实中,能用勒夏特列原理来解释的是( )A.燃烧粉碎的黄铁矿矿石有利于SO2的生成B.鼓入过量空气有利于SO2转化为SO3C.工业上大多数反应使用了催化剂D.500 ℃左右比室温更利于合成氨的反应
B [A项是从增大反应物接触面积加快反应速率考虑的,与平衡无关,不符合题意;B项是从增大反应物浓度有利于平衡向右移动考虑的,符合题意;C项是从使用催化剂一般能加快反应速率考虑的,与平衡无关,不符合题意;D项是从高温能加快反应速率考虑的,但反应物的转化率下降,不利于合成氨反应,不符合题意。]
3.在一定条件下,工业制取SO3的反应为2SO2(g)+O2(g)⥫⥬2SO3(g) ΔH<0,下列能使平衡向正反应方向移动的是( )A.加入催化剂 B.升温C.减小压强 D.加入一定量的O2
D [催化剂仅能改变反应速率,不能引起平衡移动;升温或减小压强平衡向逆反应方向移动;增大O2的浓度,平衡向正反应方向移动。]
4.在水溶液中存在反应:Ag+(aq)+Fe2+(aq)⥫⥬Ag(s)+Fe3+(aq) ΔH<0,达到平衡后,为使平衡体系中析出更多的银,可采取的措施是( )A.升高温度 B.加水稀释C.增大Fe2+的浓度 D.常温下加压
C [正反应放热,升高温度,平衡向逆反应方向移动,A错误;加水稀释,平衡向离子数目增多的方向移动,即平衡向逆反应方向移动,B错误;增大Fe2+的浓度,平衡向正反应方向移动,C正确;常温下加压对水溶液中的平衡移动几乎无影响,D错误。]
C [因为ΔH>0,升高温度,平衡常数增大,平衡向正反应方向移动,降低温度平衡向逆反应方向移动。]
6.COCl2(g)⥫⥬CO(g)+Cl2(g) ΔH>0,当反应达到平衡时,下列措施:①升温、②恒容通入惰性气体、③增加CO浓度、④减压、⑤加催化剂、⑥恒压通入惰性气体,能提高COCl2转化率的是( )A.①②④ B.①④⑥C.②③⑤ D.③⑤⑥
B [本题考查外界因素对化学平衡移动的影响,从不同层面考查勒夏特列原理的应用。该反应为吸热反应,升温则平衡正向移动,反应物转化率提高,①正确;恒容时,通入惰性气体,反应物与生成物浓度不变,平衡不移动,②错误;增加CO浓度,平衡逆向移动,反应物转化率降低,③错误;该反应正反应为气体分子数增大的反应,减压时平衡向正反应方向移动,反应物转化率提高,④正确;催化剂只能改变反应速率,不能改变平衡状态,⑤错误;恒压时,通入惰性气体,容器体积增大,反应物与生成物浓度降低,平衡向气体增加的方向移动,即向正反应方向移动,反应物转化率提高,⑥正确。]
C [由表知,体积不变升高温度,c(Y)增大,平衡右移,因升高温度,平衡向吸热反应方向移动,说明正反应为吸热反应,Q>0,B、D错;温度不变,容器体积增大,即由1 L变为2 L,若平衡不移动,此时c(Y)应减小为原来一半,现c(Y)比原来的一半大,即减压,平衡向右移动,向气体体积增大的方向移动,所以m
C [催化剂可以降低反应所需的活化能,从而提高反应速率,但不影响SO2的转化率,A项错误;催化剂的使用不影响化学平衡,但能缩短反应达到平衡所需的时间,B项错误,C项正确;对于给定的反应而言,焓变与催化剂无关,D项错误。]
9.对于合成氨的反应来说,使用催化剂和施加高压,下列叙述中正确的是( )A.都能提高反应速率,都对化学平衡状态无影响B.都对化学平衡状态有影响,都不影响达到平衡状态所用的时间C.都能缩短达到平衡状态所用的时间,只有压强对化学平衡状态有影响D.催化剂能缩短反应达到平衡状态所用的时间,而压强无此作用
C [对化学反应N2(g)+3H2(g) 2NH3(g),催化剂只能提高反应速率,使反应达到平衡状态所用的时间缩短,不能使化学平衡发生移动。高压能提高反应速率,使反应达到平衡状态所用的时间缩短,也能使化学平衡向生成NH3的方向移动。]
10.目前工业上利用甲烷催化裂解生产不含一氧化碳和二氧化碳的清洁氢气。该过程多用铁、钴和镍等过渡金属纳米催化剂,其反应为CH4(g)⥫⥬C(s)+2H2(g)。已知温度升高,甲烷的平衡转化率增大。下列有关说法不正确的是( )A.甲烷裂解属于吸热反应B.在反应体系中加催化剂,反应速率增大C.增大体系压强,不能提高甲烷的转化率D.在1 500 ℃以上时,甲烷的转化率很高,但几乎得不到炭黑,是因为在高温下该反应为放热反应
D [根据温度升高,甲烷的平衡转化率增大,知甲烷裂解属于吸热反应,A项正确、D项错误;在体系中加入合适的催化剂,能使反应速率增大,B项正确;甲烷发生分解反应,反应后气体分子数增大,故增大压强平衡向逆反应方向移动,C项正确。]
11.(易错题)合成氨反应:N2(g)+3H2(g)⥫⥬2NH3(g) ΔH=-92.4 kJ·ml-1,在反应过程中,正反应速率的变化如图所示:下列说法正确的是( )A.t1时升高了温度B.t2时使用了催化剂C.t3时增大了压强D.t4时降低了温度
B [升温,正、逆反应速率同时增大,但由于该反应是放热反应,v逆比v正增加得大,A错误;加压、正、逆反应速率同时增加,C错误;降温,正、逆反应速率瞬间减小,D错误。]
12.某工厂利用CO2和H2合成CH3OH,CO2(g)+3H2(g)⥫⥬CH3OH(g)+H2O(g) ΔH=-49.0 kJ·ml-1。(1)上述反应达到平衡后,升高温度,平衡___________(填“正向”“逆向”或“不”)移动。(2)上述反应的化学平衡常数表达式为K=________________。已知某温度下该反应的平衡常数K=1.0,某时刻测得该温度下密闭容器中各物质的物质的量浓度如表:
则此时正反应速率和逆反应速率的关系是______(填字母)。A.v(正)>v(逆)B.v(正)
①若容器的体积为2 L,则实验1中,前5 min内CO2的反应速率为_____________________。②与实验1相比,若仅改变某一实验条件,则实验2改变的条件是________________。
0.15 ml·L-1·min-1
化学选择性必修1第一单元 化学反应速率教学课件ppt: 这是一份化学选择性必修1<a href="/hx/tb_c4009315_t3/?tag_id=26" target="_blank">第一单元 化学反应速率教学课件ppt</a>,共60页。PPT课件主要包含了分液漏斗,收集到气体的体积,催化作用等内容,欢迎下载使用。
高中化学苏教版 (2019)选择性必修1专题2 化学反应速率与化学平衡第一单元 化学反应速率备课ppt课件: 这是一份高中化学苏教版 (2019)选择性必修1<a href="/hx/tb_c4009315_t3/?tag_id=26" target="_blank">专题2 化学反应速率与化学平衡第一单元 化学反应速率备课ppt课件</a>,共59页。PPT课件主要包含了每一步反应,基元反应,反应机理,有效碰撞,平均能量,活化能,放出的能量,逆反应,电磁波,超声波等内容,欢迎下载使用。
化学选择性必修1第一单元 化学反应速率示范课ppt课件: 这是一份化学选择性必修1<a href="/hx/tb_c4009315_t3/?tag_id=26" target="_blank">第一单元 化学反应速率示范课ppt课件</a>,共60页。PPT课件主要包含了逐渐减慢,快慢程度,反应物浓度,生成物浓度,颜色深浅,显色物质浓度间,SO2或O2,气密性良好等内容,欢迎下载使用。













