



高中化学苏教版 (2019)必修 第一册专题5 微观结构与物质的多样性第三单元 从微观结构看物质的多样性示范课ppt课件
展开1.了解同素异形现象、同分异构现象,培养宏观辨识与微观探析的化学核心素养。2.了解晶体与非晶体的微观结构,能预测物质具有的一些性质,培养证据推理与模型认知的化学学科核心素养。
一、同素异形现象1.同素异形现象和同素异形体(1)同一种元素能够形成几种不同的单质,这种现象称为________________。(2)同一种元素可形成不同单质,这些单质之间互称为这种元素的__________。
必备知识 自主预习储备
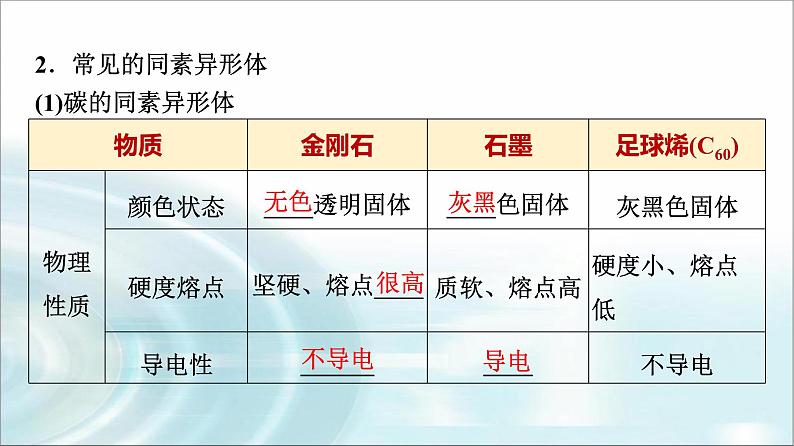
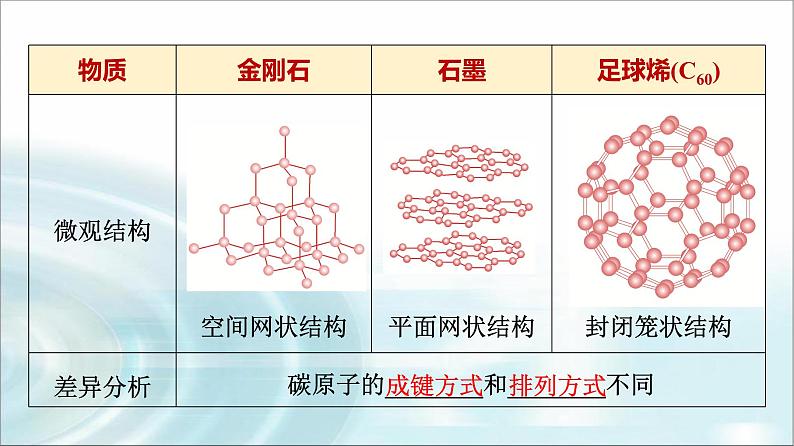
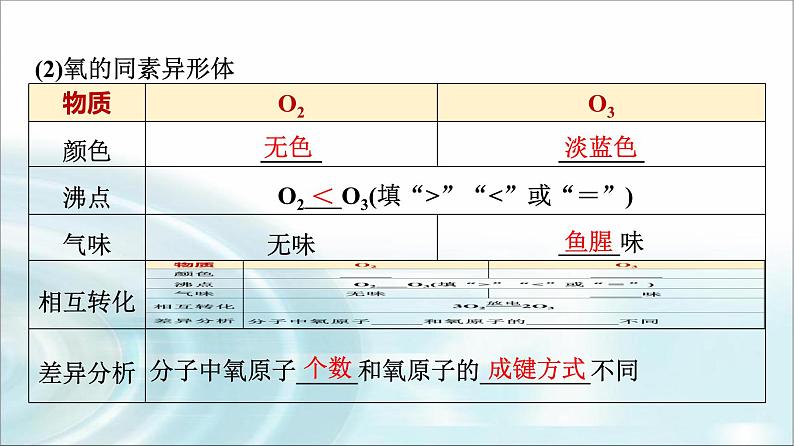
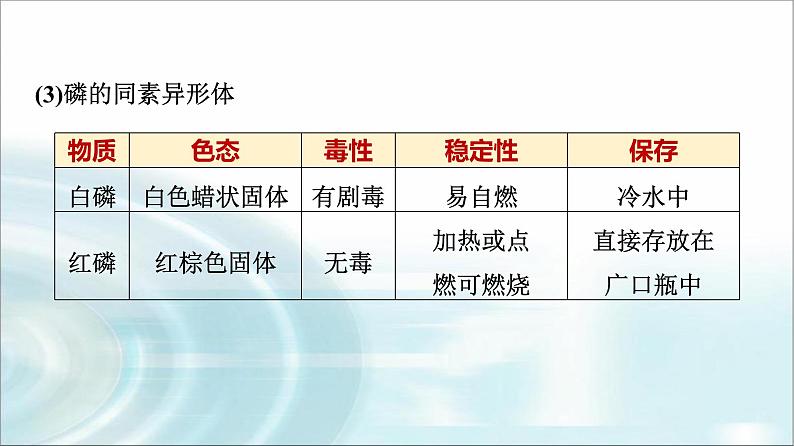
2.常见的同素异形体(1)碳的同素异形体
判一判 (正确的打“√”,错误的打“×”)(1)H、D、T互为同素异形体。( )(2)同素异形体的性质完全相同。( )(3)互为同素异形体的物质一定是单质。( )
二、同分异构现象1.同分异构现象和同分异构体(1)化合物具有相同的______,但具有不同____的现象,称为同分异构现象。(2)分子式相同而结构____的化合物互称为同分异构体。(3)同分异构现象主要表现在有机化合物中。
2.实例(1)正丁烷和异丁烷
判一判 (正确的打“√”,错误的打“×”)(1)互为同分异构体的两种物质相对分子质量一定相同。( )(2)C石墨和C金刚石互为同分异构体。( )(3)NO2和N2O互为同分异构体。( )
三、晶体与非晶体1.常见固态物质一般可分为晶体和非晶体。____有规则的几何外形和固定的熔点,如氯化钠、金刚石、干冰等。______没有固定的熔点,一般也不具备规则的几何外形。
微点拨:晶体规则的几何外形是其内部构成微粒有规则排列的结果。
想一想 二氧化碳、二氧化硅都是ⅣA族元素的氧化物,但二者的物理性质相差较大,你知道是什么原因吗?试比较二者熔点的高低。
[提示] CO2属于分子晶体而SiO2属于共价晶体,故二者物理性质差别较大。SiO2的熔点高于CO2。
素材1:国家科技奖获得者于敏被誉为“氢弹之父”。制造氢弹的原料是氘、氚。素材2:澳大利亚研究人员开发出被称为第五形态的固体碳,这种新的碳结构称作纳米泡沫,它的外形类似海绵,密度极小,并且有磁性。
关键能力 情境探究达成
区别同位素、同素异形体、同分异构体
素材3:1828年,德国化学家弗里德里希·维勒首次使用无机物质氰酸铵(NH4CNO)与硫酸铵人工合成了尿素( )。尿素的合成揭开了人工合成有机物的序幕。
[提示] 它们都是氢元素的不同核素,互称为同位素。
2.纳米泡沫碳与金刚石之间是什么关系?
[提示] 纳米泡沫碳与金刚石是碳元素形成的不同单质,二者互为同素异形体。
3.同素异形体之间物理性质和化学性质是否相同?同素异形体之间的相互转化是化学变化还是物理变化?
[提示] 同素异形体物理性质不同,化学性质可能相似。同素异形体之间的转化属于化学变化。
4.氰酸铵和尿素是什么关系?
[提示] 氰酸铵(NH4CNO)和尿素( )分子式相同(都是CH4N2O),结构不同,所以它们是同分异构体。
2.对同素异形体的理解(1)组成元素:只含有一种元素。(2)物质类别:互为同素异形体的只能是单质。(3)性质关系:同素异形体之间的物理性质有差异,但化学性质相似。(4)相互转化:同素异形体之间的转化属于化学变化,因为转化过程中有化学键的断裂与形成。(5)同素异形体之间的转化既有单质参加,又有单质生成,但由于没有涉及化合价的变化,一般认为这种转化属于非氧化还原反应。
3.四角度认识同分异构体(1)从物质看:互为同分异构体的物质只能是化合物。它们之间的转化属于化学变化,若共存则为混合物。(2)从分子式看:互为同分异构体的化合物,其分子式相同,相对分子质量也相同,但相对分子质量相同的化合物分子式不一定相同,如甲酸(HCOOH)和乙醇(CH3CH2OH)的相对分子质量均为46。(3)从结构看:互为同分异构体的化合物,空间结构不同。(4)从性质看:互为同分异构体的化合物,物理性质不同,化学性质可能相似。
1.下列物质属于同素异形体的是( )A.甲烷和乙烷 B.35Cl和37ClC.红磷和白磷 D.氢氧化钠和氢氧化钾
C [由同种元素形成的不同种单质互为同素异形体。甲烷和乙烷属于化合物,A项错误;35Cl和37Cl是质子数相同、中子数不同的原子,它们互称为同位素,B项错误;红磷和白磷是由磷元素形成的不同种单质,它们互为同素异形体,C项正确;氢氧化钠和氢氧化钾均是化合物,是两种不同的碱,D项错误。]
2.如图所示为乙醇(C2H5OH)和二甲醚(CH3OCH3)的球棍模型,下列说法错误的是( )A.两者互为同分异构体B.两者的化学键完全相同C.两者的化学性质不同D.两者的相对分子质量相同
B [乙醇和二甲醚的分子式相同(均为C2H6O),但两者的结构不同,故两者互为同分异构体,具有相同的相对分子质量,A、D项正确;从球棍模型可知,在乙醇分子中存在碳碳单键、碳氧单键、氢氧键、碳氢键,而二甲醚分子中只有碳氧单键与碳氢键,B项错误;由于两者的结构不同,且属于不同类物质,故两者的化学性质必然不同,C项正确。]
在很多星级酒店或海鲜城里面,我们都可以看到一些食物被端上桌时周围呈现烟雾缭绕的景象,仿佛仙景一般,其实那是干冰升华使周围温度骤降造成的现象。
1.干冰是哪种类型的晶体?上述现象说明它的哪种性质?
[提示] 干冰属于分子晶体,上述现象说明它的熔沸点很低。从固态变成气态时吸收大量热量,从而使周围温度降低,空气中水蒸气液化成雾。
2.干冰气化时破坏了哪种作用力?与晶体类型有什么关系?
[提示] 由于干冰是分子晶体,气化时破坏的是分子间作用力。
3.不同类型晶体熔化时破坏的作用力有何不同?
[提示] 熔化时,离子晶体的离子键被破坏,共价晶体中共价键被破坏,分子晶体中分子间作用力被破坏(有氢键的还会破坏氢键和分子间作用力),金属晶体的金属键被破坏。
1.不同类型晶体的比较一般情况下,不同类型晶体的熔、沸点:共价晶体>离子晶体>分子晶体。金属晶体的熔、沸点差别较大,有些金属熔、沸点较低,例如碱金属;有些金属熔、沸点很高,例如金属钨的熔点高达3 000 ℃以上。
2.同类型晶体的比较(1)离子晶体一般地,离子晶体中阴、阳离子半径越小,离子所带电荷越多,离子键越强,离子晶体的熔、沸点越高。例如,熔点:NaCl>KCl> RbCl>CsCl;NaF>NaCl>NaBr> NaI;MgO>Na2O>NaCl。
(2)共价晶体一般地,对于结构相似的共价晶体,原子半径越小,共价键的键长越短,共价键越强,共价晶体的熔、沸点越高。例如,熔点:金刚石>SiC>晶体硅。
(3)分子晶体一般地,对于组成和结构相似的分子晶体,相对分子质量越大,分子间作用力越强,晶体的熔、沸点越高。例如,沸点:F2
(4)金属晶体一般地,对于主族元素形成的金属晶体,金属阳离子半径越小、离子所带电荷数越多,金属键越强,金属的熔、沸点越高。例如,熔点:Li>Na>K>Rb>Cs;Na
1.下列物质性质的变化规律与化学键强弱无关的是( )A.F2、Cl2、Br2、I2的熔点逐渐升高B.HF、HCl、HBr、HI的热稳定性依次减弱C.金刚石的硬度、熔点、沸点都高于晶体硅D.NaF、NaCl、NaBr、NaI的熔点依次降低
A [F2、Cl2、Br2、I2形成的晶体为分子晶体,熔化时仅破坏分子间作用力,与化学键无关,A项符合题意。]
2.下列化合物按其晶体的熔点由高到低排列正确的是( )A.SiO2 CsCl CBr4 CF4B.SiO2 CsCl CF4 CBr4C.CsCl SiO2 CBr4 CF4D.SiO2 CF4 CBr4 CsCl
A [SiO2属于共价晶体,CsCl属于离子晶体,而CBr4和CF4属于分子晶体。一般情况下,不同类型晶体的熔、沸点:共价晶体>离子晶体>分子晶体。对于组成和结构相似的分子晶体,如CF4、CBr4,随着相对分子质量逐渐增大,物质的熔、沸点逐渐升高。由此可知,熔点:SiO2>CsCl>CBr4>CF4。]
1.科学家发现C60后,近年又合成了许多球形分子,如C50、C70、C120、C540等,它们互称为( )A.同一种物质 B.同分异构体C.同素异形体 D.同位素
学习效果 随堂评估自测
2.下列各组物质中,互称为同分异构体的是( )A.冰和水B.氧气和臭氧 C.纯碱和烧碱D.
D [冰和水都是H2O,属于同一种物质,A项错误;氧气和臭氧是由同种元素形成的不同种单质,二者互为同素异形体,B项错误;纯碱为Na2CO3、烧碱为NaOH,前者是盐,后者是碱,二者化学式不同,C项错误; 的分子式均为C5H12,但是结构不同,二者互为同分异构体,D项正确。]
3.根据表中给出的几种物质的熔沸点数据,判断下列说法错误的是( )
A.SiCl4是分子晶体B.单质B可能是共价晶体C.AlCl3在加热时能升华D.NaCl比MgCl2更易熔化
D [晶体的性质与其晶体类型相关。SiCl4的熔、沸点较低,所以属于分子晶体,A项正确;单质B的熔、沸点较高,可能属于共价晶体,B项正确;AlCl3的熔点高于沸点,所以加热时直接从固态变成气态,即易升华,C项正确;NaCl的熔点高于MgCl2的,所以MgCl2比NaCl更易熔化,D项错误。]
4.有几种晶体:A.水晶,B.冰醋酸,C.白磷,D.金刚石,E.晶体氩,F.干冰。(1)属于分子晶体的是__________________,直接由原子构成的分子晶体是________。(2)属于共价晶体的化合物是________。(3)直接由原子构成的晶体是____________。(4)受热熔化时,化学键不发生变化的是___________,需克服共价键的是________。
[解析] 分子晶体由分子构成的有B、C、E、F。晶体氩是单原子分子;原子晶体和单原子分子晶体都由原子直接构成,原子晶体有A、D,但化合物只有A;分子晶体熔化时,一般不破坏化学键;原子晶体熔化时,破坏化学键。
基础课时固基练(27) 从微观结构看物质的多样性
2.某实验室对液氢样本施加约4.95×1011 Pa压力,成功制造出了金属氢,这是一种以氢离子和自由电子为基本单位的晶体。下列关于金属氢的推测错误的是( )A.可能具有很好的导电性B.与氢气互为同素异形体C.制造金属氢的过程属于化学变化D.摩尔质量与氢气相同
D [金属氢是一种以氢离子和自由电子为基本单位的晶体,存在自由移动的电子,能导电,故A正确;金属氢是由氢元素组成的单质,与氢气互为同素异形体,故B正确;制造金属氢的过程中,有新物质生成,属于化学变化,故C正确;金属氢是由氢原子构成的单质,是与氢气不同的单质,故其摩尔质量不同,故D错误。]
3.下列各组物质的晶体中,化学键类型相同、晶体类型也相同的是( )A.SO2和SiO2 B.CO2和H2OC.SiC和HCl D.CCl4和KCl
B [A项中SO2和SiO2的化学键相同,都是极性共价键,但晶体类型不同,SO2晶体属于分子晶体,SiO2晶体属于共价晶体;B项中CO2和H2O的化学键都是极性共价键,且都属于分子晶体;C项中SiC和HCl的化学键相同,都为极性共价键,但晶体类型不同,SiC晶体属于共价晶体,HCl晶体属于分子晶体;D项中CCl4和KCl的化学键类型不同,CCl4为极性共价键,KCl为离子键,且晶体类型也不同,CCl4晶体属于分子晶体,KCl晶体属于离子晶体。]
4.互为同分异构体的物质一定不可能具有( )A.相同的分子式B.相同的结构C.相似的化学性质D.相同的相对分子质量
B [互为同分异构体的物质的分子式相同,其相对分子质量也相同,但其结构不同,化学性质可能相似。]
5.下列各对物质中,属于同分异构体的是( )A.白磷和红磷B.干冰和CO2
D [A项白磷和红磷两者属于同素异形体,不符合题意;B项干冰和CO2是同一种物质,只是状态不同,不符合题意;C项属于同一种物质,不符合题意;D项中两者的分子式均为C6H14,结构不同,属于同分异构体,符合题意。]
6.氧气在放电或紫外线照射下能转化为臭氧(O3)。下列说法正确的是( )A.O3和O2互为同位素B.O2比O3稳定C.等体积O3和O2含有相同质子数D.O3与O2的相互转化是物理变化
B [O2和O3互为同素异形体,A不正确;温度、压强不确定,不能确定O2、O3的物质的量,不能确定其质子数,C不正确;同素异形体之间的转化属于化学变化,D不正确。]
7.请参考下表中有关数据,完成下列问题:
(1)工业上常用电解熔融MgCl2的方法制金属镁,用电解Al2O3与冰晶石熔融混合物的方法生产铝。不用电解熔融MgO的方法生产镁的原因是________________________________________________________________________________________________________________;不用电解熔融AlCl3的方法生产铝的原因是_______________________________________________________________________________。(2)设计一个方案证明MgCl2和AlCl3的晶体类型。实验方法是____________________________________________________________________________________________________________________。
MgO的熔点远高于MgCl2,电解熔融MgO需要更高的温度,既增加成本,又不便于操作
AlCl3属于分子晶体,熔融状态不能导电,不能被电解
将两种晶体加热至熔融状态,MgCl2能导电,AlCl3不能导电,证明MgCl2为离子晶体,AlCl3为分子晶体
[解析] (1)由表中数据可知,MgO的熔点远高于MgCl2,电解熔融MgO需要更高的温度,会消耗更多的电能,既增加成本,又不便于操作。观察表中数据可知,AlCl3的熔点较低,且沸点比熔点低,易升华,属于分子晶体,熔融状态不能导电,不能被电解,故不用电解熔融AlCl3的方法生产铝。(2)离子晶体在熔融状态能导电,而分子晶体在熔融状态不能导电,利用此特点可区分离子晶体和分子晶体。实验方法为将两种晶体加热至熔融状态,MgCl2能导电,AlCl3不能导电,证明MgCl2为离子晶体,AlCl3为分子晶体。
8.原子序数依次增大的短周期元素a、b、c、d和e中,a的最外层电子数为其周期数的 2倍;b的-2价离子比d的-2 价离子少 8个电子,c的+1价离子比e的-1价离子少8个电子。回答下列问题:(1)元素a为_____,c为_____(填化学式,下同)。(2)由这些元素形成的双原子分子为________________。(3)这些元素的单质或由它们形成的AB型化合物中,其晶体类型属于共价晶体的是________,属于离子晶体的是________,属于金属晶体的是____,属于分子晶体的是_____________________(每空均填一种)。
S(或CO、O2、Cl2)
9.下列各组物质中,3种物质的晶体类型都不相同的是( )A.KCl、H2SO4、P4 B.CO2、Na3PO4、MgC.NH4F、C60、干冰 D.Si、SiO2、K2CO3
B [A项中的H2SO4和P4都是分子晶体,KCl是离子晶体;B项中CO2、Na3PO4、Mg分别属于分子晶体、离子晶体、金属晶体;C项中C60和干冰均为分子晶体,NH4F是离子晶体;D项中的Si和SiO2都是共价晶体。]
10.石墨烯是从石墨材料中剥离出来的,其剥离原理其实并不复杂,就像我们将写错的字用胶条从纸上粘下来一样。石墨烯是由碳原子构成的只有一层原子厚度的二维晶体,它是目前发现的最薄、强度最大、导电导热性能最强的一种新型纳米材料。科学家甚至预言“石墨烯将彻底改变21世纪”。下列关于石墨烯的说法错误的是( )A.从石墨中剥离出石墨烯属于化学变化B.石墨烯由碳原子构成C.石墨烯与石墨互为同位素D.石墨的导电性比银的强
C [石墨与石墨烯是不同种物质,因此从石墨中剥离出石墨烯属于化学变化,故A项正确;石墨烯是由碳原子构成的,故B项正确;石墨烯与石墨都是碳单质,二者互为同素异形体,故C项错误;由题中信息可知,石墨烯是目前发现的最薄、强度最大、导电导热性能最强的一种新型纳米材料,因此石墨烯的导电性比银的强,故D项正确。]
11.(素养题)U、V、W、X、Y、Z是原子序数依次增大的六种常见元素。Y的单质在W2中燃烧的产物可使品红溶液褪色。Z和W元素形成的化合物Z3W4是具有磁性的黑色固体,U的单质在W2中燃烧可生成UW和UW2两种气体。X的单质是一种金属,该金属在UW2中剧烈燃烧生成黑、白两种固体。请回答下列问题:(1)V的单质分子的结构式为________;Z元素在元素周期表中的位置是________________。
(2)U元素形成的同素异形体的晶体类型可能是________(填序号)。①共价晶体 ②离子晶体 ③分子晶体 ④金属晶体(3)U、V、W形成的10电子氢化物中,沸点较低的是________(填化学式)。(4)YW2气体通入BaCl2和HNO3的混合溶液,生成白色沉淀和无色气体VW,有关反应的离子方程式为_____________________________________________________,由此可知VW和YW2还原性较强的是________(填化学式)。
===3BaSO4↓+2NO+4H+
12.如图所示是部分短周期主族元素单质熔点的变化图,根据此图回答下列问题:
(1)③号元素在元素周期表中的位置是________________,该元素的一种同素异形体能导电,该同素异形体的名称是________。(2)⑤⑥两种元素的最高价氧化物对应的水化物之间相互反应的离子方程式为______________________________________________。(3)⑦号元素的原子结构示意图为 。
苏教版 (2019)第三单元 物质的分散系教案配套ppt课件: 这是一份苏教版 (2019)<a href="/hx/tb_c4002490_t3/?tag_id=26" target="_blank">第三单元 物质的分散系教案配套ppt课件</a>,共54页。PPT课件主要包含了分散质,分散剂,一条光亮的通路,溶液和胶体,FeOH3,水溶液,熔融状态下,水溶液中,OH-,金属阳离子等内容,欢迎下载使用。
苏教版 (2019)必修 第一册第三单元 从微观结构看物质的多样性示范课课件ppt: 这是一份苏教版 (2019)必修 第一册<a href="/hx/tb_c4002510_t3/?tag_id=26" target="_blank">第三单元 从微观结构看物质的多样性示范课课件ppt</a>,共11页。PPT课件主要包含了关键能力定点破等内容,欢迎下载使用。
苏教版 (2019)必修 第一册专题5 微观结构与物质的多样性第三单元 从微观结构看物质的多样性公开课课件ppt: 这是一份苏教版 (2019)必修 第一册专题5 微观结构与物质的多样性第三单元 从微观结构看物质的多样性公开课课件ppt,共44页。PPT课件主要包含了学习目标,同素异形体,自主预习,排列方式,成键方式,分子式,C2H6O,非晶体,阳离子,离子键等内容,欢迎下载使用。













