





化学选择性必修1第三单元 化学平衡的移动教学ppt课件
展开探究要点 典例合作细解
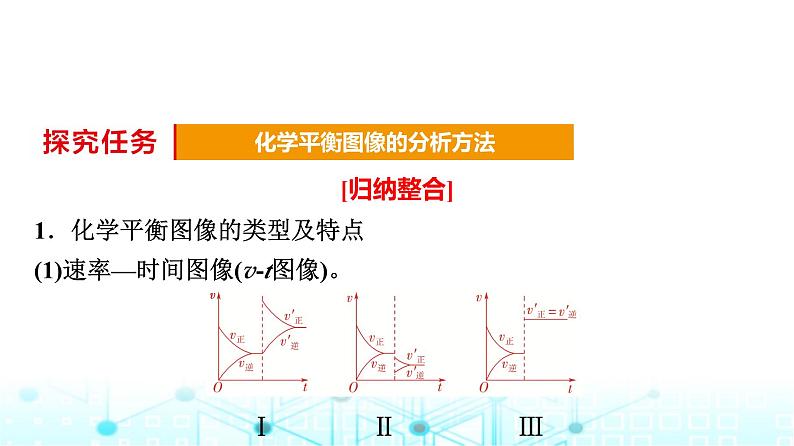
[归纳整合]1.化学平衡图像的类型及特点(1)速率—时间图像(v-t图像)。
Ⅰ Ⅱ Ⅲ
Ⅰ.达到平衡后,改变某一条件正反应速率突变,逆反应速率渐变,v′正>v′逆,说明是增大了反应物的浓度,使正反应速率突变,且平衡正向移动。Ⅱ.达到平衡后,改变某一条件,正、逆反应速率都是突然减小的,v′正>v′逆,平衡正向移动,说明该反应的正反应可能是放热反应或气体总体积增大的反应,改变的条件是降低温度或减小压强。Ⅲ.达到平衡后,改变某一条件,正、逆反应速率都是突然增大的,并且v′正、v′逆增大程度相同,说明该化学平衡没有发生移动,可能是使用了催化剂,也可能是对反应前后气体总体积不发生变化的反应增大压强(压缩体积)所致。
[分析方法]判断平衡移动方向,根据v′正、v′逆的相对大小;判断改变的哪种外界条件,根据改变条件的那一时刻v′正、v′逆的变化,若v′正或v′逆有一个在原平衡未变则为改变的浓度;若两个都发生了突变,则为改变的温度或压强;若两个都发生了突变且仍然相等,则为加入催化剂或等体反应改变压强。
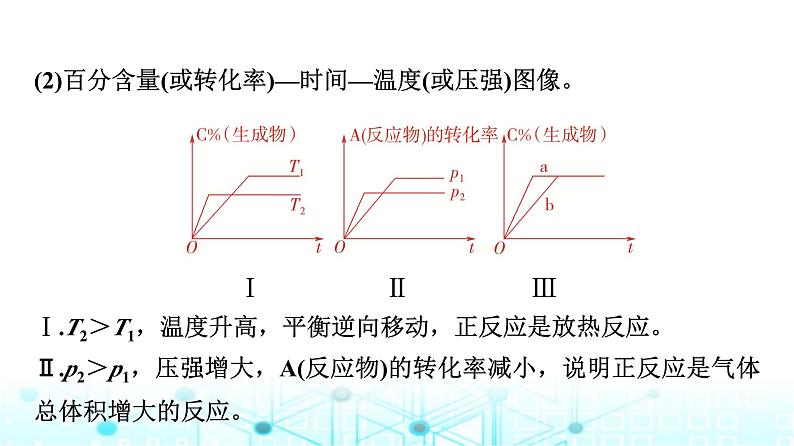
(2)百分含量(或转化率)—时间—温度(或压强)图像。Ⅰ Ⅱ ⅢⅠ.T2>T1,温度升高,平衡逆向移动,正反应是放热反应。Ⅱ.p2>p1,压强增大,A(反应物)的转化率减小,说明正反应是气体总体积增大的反应。
Ⅲ.生成物C的百分含量不变,说明平衡不发生移动,但反应速率a>b,故a可能使用了催化剂;若该反应是反应前后气体总体积不变的可逆反应,a也可能是增大了压强(压缩体积)。[分析方法]①“先拐先平数值大”。在化学平衡图像中,先出现拐点的反应则是先达到平衡,先出现拐点的曲线表示的温度较高(如图Ⅰ中T2>T1)、压强较大(如图Ⅱ中p2>p1)或使用了催化剂(如图Ⅲ中a使用了催化剂)。
②正确掌握图像Ⅰ、Ⅱ中反应规律的判断方法图Ⅰ中,T2>T1,升高温度,生成物百分含量降低,平衡逆向移动,正反应为放热反应。图Ⅱ中,p2>p1,增大压强,反应物的转化率降低,平衡逆向移动。则正反应为气体体积增大的反应。图Ⅲ说明了条件改变对化学平衡不产生影响,a可能是加入了催化剂,或该反应是反应前后气体体积不变的反应,a是增大压强。
(3)百分含量(或转化率)—压强—温度图像。如上图中确定压强为105 Pa或107 Pa,则生成物C的百分含量随温度T的升高而逐渐减小,说明正反应是放热反应;再确定温度T不变,做横坐标的垂线,与压强线出现两个交点,分析生成物C的百分含量随压强的变化可以发现,压强增大,生成物C的百分含量增大,说明正反应是气体总体积减小的反应。
[分析方法]在化学平衡图像中,包括纵坐标、横坐标和曲线所表示的三个量。确定横坐标所表示的量,讨论纵坐标与曲线的关系,或者确定纵坐标所表示的量,讨论横坐标与曲线的关系,即“定一议二”。如上图中T1温度下,A→B压强增大,C%增大,平衡正向移动,则正反应是气体分子数减小的反应;105 Pa时,A→C温度升高,C%减小,平衡逆向移动,则正反应是放热反应。
(4)物质的量 (浓度)—时间图像[n(c)-t图像]。在2 L密闭容器中,某一反应有关物质A(g)、B(g)、C(g)的物质的量变化如图所示。①横坐标表示反应过程中时间变化,纵坐标表示反应过程中物质的物质的量的变化。②该反应的化学方程式是3A(g)+B(g)⥫⥬2C(g)。③在反应达2 min时,正反应速率与逆反应速率之间的关系是相等。④若用A物质的量浓度的变化表示反应达平衡(2 min)时的正反应速率是0.15 ml·L-1·min-1。
[分析方法]各物质的n或c不随时间变化时达到平衡状态,据起始量和平衡量求出转化量,各物质的转化量之比等于化学计量数之比,可以得出化学(或离子)方程式中的化学计量数。(5)特殊图像。①对于反应aA(g)+bB(g)⥫⥬cC(g)+dD(g) ΔH<0,M点前,表示化学反应从反应开始到建立平衡的过程,则v正>v逆,M点为平衡点,M点后为平衡受温度的影响情况。
②如图所示曲线是其他条件不变时,某反应物的平衡转化率与温度的关系曲线。图中标出的1、2、3、4四个点,表示v正>v逆的是点3,表示v正<v逆的是点1,而点2、4表示v正=v逆。[分析方法]①中图像,由于某一条件对平衡的影响只能向一个方向移动,所以最高点(最低点)及以后为平衡状态受条件的影响情况,前面为未达到平衡的情况。②中图像曲线上的点全为对应条件下的平衡点。
B [该反应是反应前后气体分子数不变的反应,随着反应的进行,气体的总物质的量始终不变,总压强始终不变,A错误;t2时,设向容器中加入3 ml C,正反应速率逐渐增大,达到新的平衡后保持不变,变化情况与图像相符,B正确;t2时,设向容器中加入3 ml C,相当于加入1 ml A和2 ml B,则状态Ⅱ相当于起始投料为2 ml A和5 ml B,若是投料为2 ml A和6 ml B与状态Ⅰ等效,即状态Ⅱ相当于减少了B的投料,平衡逆向移动,A的体积分数变大,即φ(Ⅱ)>φ(Ⅰ),C错误;化学平衡常数只与温度有关,温度不变,平衡常数不变,即K(Ⅱ)=K(Ⅰ),D错误。]
[对点即练]1.下面的各图中,表示2A(g)+B(g)⥫⥬2C(g)(正反应放热)这个可逆反应的正确图像为( )
A [随着温度的升高,化学平衡应向吸热反应方向即逆反应方向移动,所以生成物C的体积分数减小,反应物的含量增大、转化率减小,A正确、D错误;增大体系的压强,由于反应的两边都是气态物质,所以正反应和逆反应的速率都增大,B错误;加入催化剂,只能加快反应速率,缩短达到平衡的时间,不能使平衡移动,所以达到平衡后,各组分的浓度及体积分数应该不变,C错误。]
2.反应mX(g)⥫⥬nY(g)+pZ(g) ΔH,在不同温度下的平衡体系中,物质Y的体积分数随压强变化的曲线如图所示。下列说法错误的是( )A.该反应的ΔH>0B.m<n+pC.B、C两点化学平衡常数:KB>KCD.A、C两点的反应速率v(A)<v(C)
C [由图可知温度升高,Y的体积分数增大,说明平衡正向移动,则正反应为吸热反应;增大压强,Y的体积分数减小,说明平衡逆向移动,则m<n+p;对吸热反应来说,温度升高,K增大,KB<KC;A、C两点温度相同,C点压强大,则C点的速率大于A点。]
A [据图可知,Y点对应乙烯的平衡转化率为20%,起始n(C2H4)∶n(H2O)=1∶1,设C2H4和H2O的起始物质的量均为1 ml,根据“三段式”计算: C2H4(g)+H2O(g)⥫⥬C2H5OH(g)起始/ml 1 1 0转化/ml 0.2 0.2 0.2平衡/ml 0.8 0.8 0.2
基本能力 随堂评估自测
1.在密闭容器中进行反应:2SO2(g)+O2(g)⥫⥬2SO3(g)(正反应放热)。如图是某次实验的化学反应速率随时间变化的图像,推断在t1时刻突然改变的条件可能是( ) A.催化剂失效 B.减小生成物的浓度C.降低体系温度 D.增大容器的体积
C [从图像可以看出:改变条件后,反应速率与原平衡速率出现断点且低于原平衡反应速率,说明改变的条件可能是降低温度或减压。从改变条件后的v′正与v′逆的大小关系,可得出化学平衡正向移动。降低温度,该平衡正向移动,必有v′正>v′逆,故选C。]
2.在恒压、NO和O2的起始浓度一定的条件下,催化反应相同时间,测得不同温度下NO转化为NO2的转化率如图中实线所示(图中虚线表示相同条件下NO的平衡转化率随温度的变化)。下列说法正确的是( ) A.反应2NO(g)+O2(g)===2NO2(g)的ΔH>0 B.图中X点所示条件下,延长反应时间能提高NO转化率C.图中Y点所示条件下,增加O2的浓度不能提高NO转化率D.380℃下,c起始(O2)=5.0×10-4 ml·L-1,NO平衡转化率为50%,则平衡常数K<2 000
3.有Ⅰ、Ⅱ、Ⅲ3个体积均为0.5 L的恒容密闭容器,在Ⅰ、Ⅱ、Ⅲ中按不同投料比(Z)充入HCl和O2(如下表),加入催化剂发生反应:4HCl(g)+O2(g)⥫⥬2Cl2(g)+2H2O(g) ΔH。HCl的平衡转化率与Z和T的关系如图所示。
下列说法不正确的是( )A.ΔH<0B.a<4
(1)用各物质的平衡分压表示总反应的平衡常数,表达式Kp=_________________。(2)图中对应等压过程的曲线是________,判断的理由是_______________________________________________________________________。(3)当x(CH3OH)=0.10时,CO2的平衡转化率α=________,反应条件可能为___________________或__________________。
总反应ΔH<0,升高温度时平衡向逆反应方向移动,甲醇的物质的量分数变小
5×105 Pa、210 ℃
9×105 Pa、250 ℃
能力课时培优练(4) 化学平衡图像分析
1.室温下,某溶液初始时仅溶有M和N且浓度相等,同时发生以下两个反应:①M+N===X+Y;②M+N===X+Z,反应①的速率可表示为v1=k1c2(M),反应②的速率可表示为v2=k2c2(M)(k1、k2为速率常数)。反应体系中组分M、Z的浓度随时间变化情况如图,下列说法错误的是( )
A.0~30 min时间段内,Y的平均反应速率为6.67×10-8ml·L-1·min-1B.反应开始后,体系中Y和Z的浓度之比保持不变C.如果反应能进行到底,反应结束时62.5%的M转化为ZD.反应①的活化能比反应②的活化能大
能力课时4 化学平衡图像分析
2.反应X===2Z经历两步:①X―→Y;②Y―→2Z。反应体系中X、Y、Z的浓度c随时间t的变化曲线如图所示。下列说法不正确的是( )A.a为c(X)随t的变化曲线 B.t1时,c(X)=c(Y)=c(Z)C.t2时,Y的消耗速率大于生成速率D.t3后,c(Z)=2c0-c(Y)
D [由题图知,a起始浓度最大,在整个反应过程中浓度一直减小,所以a代表c(X)随t的变化曲线,A说法正确;t1时,三条曲线相交,三种物质的浓度相等,B说法正确;结合题给反应判断,先增加后减小的是c(Y)随t变化的曲线,一直增大的是c(Z)随t变化的曲线,t2时,c(Y)在减小,说明Y的消耗速率大于生成速率,C说法正确;由题图知,t3后,X反应完全,X转化为Y的浓度为c0,Y的剩余浓度变为c(Y),则生成Z的消耗量为c0-c(Y),生成Z的量为c(Z)=2c0-2c(Y),D说法错误。]
3.如图是恒温下某化学反应的反应速率随反应时间变化的示意图。下列叙述与示意图不相符合的是( )A.反应达到平衡时,正反应速率和逆反应速率相等B.该反应达到平衡态Ⅰ后,增大反应物浓度,平衡发生移动,达到平衡态ⅡC.该反应达到平衡态Ⅰ后,减小反应物浓度,平衡发生移动,达到平衡态ⅡD.同一种反应物在平衡态Ⅰ和平衡态Ⅱ时浓度不相等
C [减小反应物浓度的瞬间,逆反应速率不变,正反应速率迅速降低,且达到新平衡时的反应速率比原平衡时的速率小,这与示意图不符,C错。]
4.已知反应2SO2(g)+O2(g)⥫⥬2SO3(g) ΔH<0,向某体积恒定的密闭容器中按体积比2∶1充入SO2和O2,在一定条件下发生反应。如图是某物理量(Y)随时间(t)变化的示意图(图中T表示温度),Y可以是( )A.O2的体积分数B.混合气体的密度C.密闭容器内的压强D.SO2的转化率
D [由题图可知,温度T2达到平衡所用时间短,反应速率较快,所以温度T2>T1,温度升高,Y表示的物理量降低,该反应的正反应为放热反应,升高温度平衡向逆反应方向移动,氧气的体积分数增大,A错误;升温平衡向逆反应方向移动,但混合气体的总质量不变,容器的体积不变,混合气体的密度不变,B错误;升温平衡向逆反应方向移动,混合气体的总物质的量增大,容器的体积不变,容器的压强增大,C错误;升温平衡向逆反应方向移动,SO2的转化率降低,D正确。]
(2)t2时将容器容积迅速缩小至原来的一半并保持不变,图中能正确表示压缩后N2分压变化趋势的曲线是_______(用图中a、b、c、d表示),理由是___________________________________________________________________________________________________________________________________________________________________________________。
容积迅速缩小至原来的一半时,N2分压变为原来
的2倍;其他条件不变时,容器容积减小,压强增大,平衡向气体体积减小的方向移动,该平衡逆向移动,所以N2分压先变为原来的2倍,后逐渐减小
苏教版 (2019)选择性必修1专题2 化学反应速率与化学平衡第二单元 化学反应的方向与限度课文内容ppt课件: 这是一份苏教版 (2019)选择性必修1<a href="/hx/tb_c4009316_t3/?tag_id=26" target="_blank">专题2 化学反应速率与化学平衡第二单元 化学反应的方向与限度课文内容ppt课件</a>,共60页。PPT课件主要包含了浓度幂之积,平衡常数,已转化的量,3计算等内容,欢迎下载使用。
高中化学苏教版 (2019)选择性必修1第二单元 化学反应的方向与限度教学课件ppt: 这是一份高中化学苏教版 (2019)选择性必修1<a href="/hx/tb_c4009316_t3/?tag_id=26" target="_blank">第二单元 化学反应的方向与限度教学课件ppt</a>,共60页。PPT课件主要包含了正反应,逆反应,情境素材,①③④等内容,欢迎下载使用。
高中化学第四单元 沉淀溶解平衡课文课件ppt: 这是一份高中化学<a href="/hx/tb_c4009323_t3/?tag_id=26" target="_blank">第四单元 沉淀溶解平衡课文课件ppt</a>,共56页。PPT课件主要包含了浓度大小有关,2×10-8,不饱和等内容,欢迎下载使用。













