
三年(2022-2024)高考化学真题分类汇编(全国通用)专题09 水溶液中的离子反应与平衡(原卷版)
展开考法01 弱电解质的电离平衡
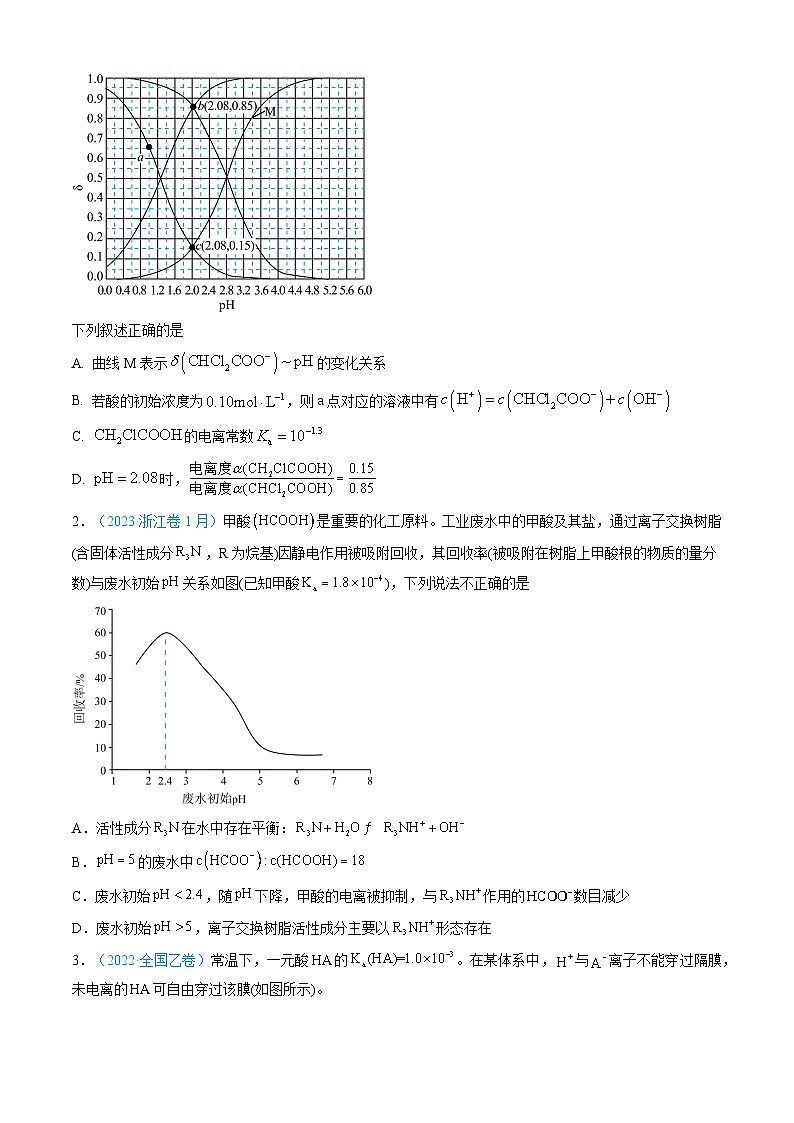
1. (2024·新课标卷)常温下和的两种溶液中,分布系数δ与pH的变化关系如图所示。[比如:]
下列叙述正确的是
A. 曲线M表示的变化关系
B. 若酸的初始浓度为,则a点对应的溶液中有
C. 的电离常数
D. 时,
2.(2023·浙江卷1月)甲酸是重要的化工原料。工业废水中的甲酸及其盐,通过离子交换树脂(含固体活性成分,R为烷基)因静电作用被吸附回收,其回收率(被吸附在树脂上甲酸根的物质的量分数)与废水初始关系如图(已知甲酸),下列说法不正确的是
A.活性成分在水中存在平衡:
B.的废水中
C.废水初始,随下降,甲酸的电离被抑制,与作用的数目减少
D.废水初始,离子交换树脂活性成分主要以形态存在
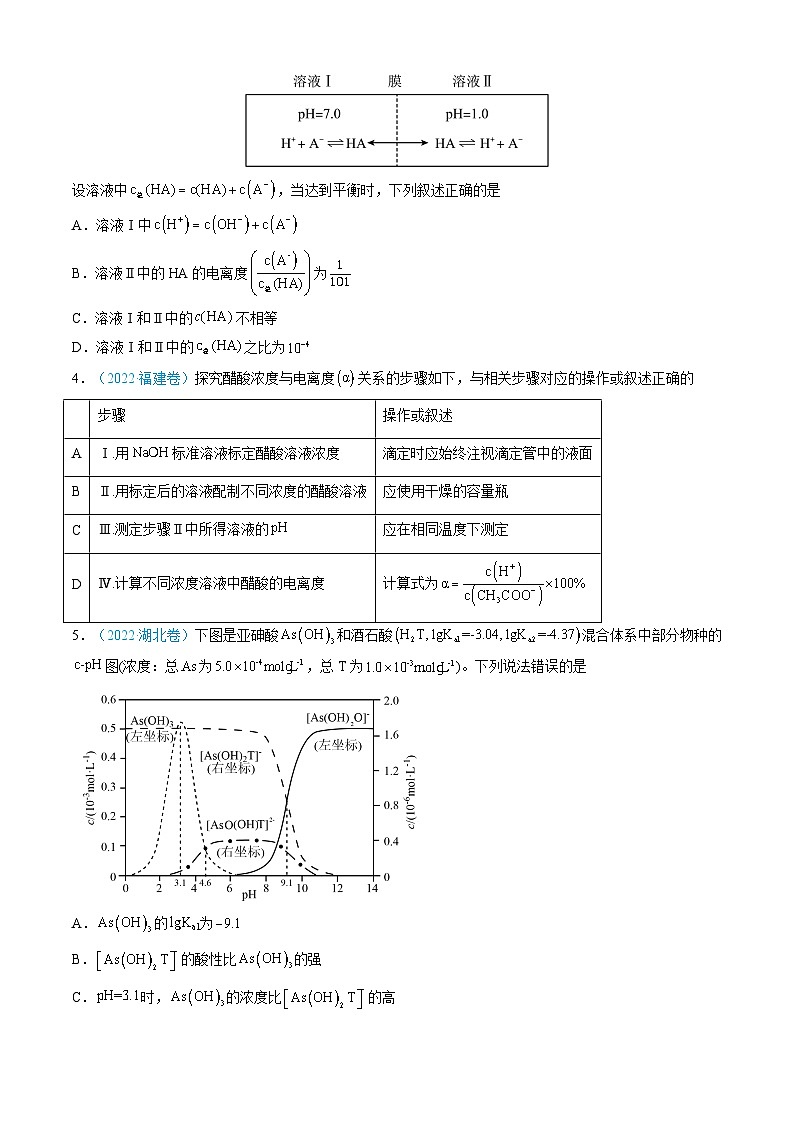
3.(2022·全国乙卷)常温下,一元酸的。在某体系中,与离子不能穿过隔膜,未电离的可自由穿过该膜(如图所示)。
设溶液中,当达到平衡时,下列叙述正确的是
A.溶液Ⅰ中
B.溶液Ⅱ中的HA的电离度为
C.溶液Ⅰ和Ⅱ中的不相等
D.溶液Ⅰ和Ⅱ中的之比为
4.(2022·福建卷)探究醋酸浓度与电离度关系的步骤如下,与相关步骤对应的操作或叙述正确的
5.(2022·湖北卷)下图是亚砷酸和酒石酸混合体系中部分物种的图(浓度:总为,总T为)。下列说法错误的是
A.的为
B.的酸性比的强
C.时,的浓度比的高
D.时,溶液中浓度最高的物种为
6.(2022·湖北卷)根据酸碱质子理论,给出质子的物质是酸,给出质子的能力越强,酸性越强。已知:,,下列酸性强弱顺序正确的是
A.B.
C.D.
7.(2022·浙江卷)已知25℃时二元酸H2A的Ka1=1.3×10-7,Ka2=7.1×10-15。下列说法正确的是
A.在等浓度的Na2A、NaHA溶液中,水的电离程度前者小于后者
B.向0.1ml·L-1的H2A溶液中通入HCl气体(忽略溶液体积的变化)至pH=3,则H2A的电离度为0.013%
C.向H2A溶液中加入NaOH溶液至pH=11,则c(A2-)>c(HA-)
D.取pH=a的H2A溶液10mL,加蒸馏水稀释至100mL,则该溶液pH=a+1
8.(2022·北京卷)2022年3月神舟十三号航天员在中国空间站进行了“天宫课堂”授课活动。其中太空“冰雪实验”演示了过饱和醋酸钠溶液的结晶现象。下列说法不正确的是
A.醋酸钠是强电解质
B.醋酸钠晶体与冰都是离子晶体
C.常温下,醋酸钠溶液的
D.该溶液中加入少量醋酸钠固体可以促进醋酸钠晶体析出
考法02 水的电离和溶液的pH
9.(2023·湖南卷)常温下,用浓度为的标准溶液滴定浓度均为的和的混合溶液,滴定过程中溶液的随()的变化曲线如图所示。下列说法错误的是
A.约为
B.点a:
C.点b:
D.水的电离程度:
10.(2023·山东卷)一定条件下,乙酸酐醇解反应可进行完全,利用此反应定量测定有机醇中的羟基含量,实验过程中酯的水解可忽略。实验步骤如下:
①配制一定浓度的乙酸酐-苯溶液。
②量取一定体积乙酸酐-苯溶液置于锥形瓶中,加入样品,充分反应后,加适量水使剩余乙酸酐完全水解:。
③加指示剂并用甲醇标准溶液滴定至终点,消耗标准溶液。
④在相同条件下,量取相同体积的乙酸酐-苯溶液,只加适量水使乙酸酐完全水解;加指示剂并用甲醇标准溶液滴定至终点,消耗标准溶液。样品中羟基含量(质量分数)计算正确的是
A.B.
C.D.
11.(2023·山东卷)一定条件下,乙酸酐醇解反应可进行完全,利用此反应定量测定有机醇中的羟基含量,实验过程中酯的水解可忽略。实验步骤如下:
①配制一定浓度的乙酸酐-苯溶液。
②量取一定体积乙酸酐-苯溶液置于锥形瓶中,加入样品,充分反应后,加适量水使剩余乙酸酐完全水解:。
③加指示剂并用甲醇标准溶液滴定至终点,消耗标准溶液。
④在相同条件下,量取相同体积的乙酸酐-苯溶液,只加适量水使乙酸酐完全水解;加指示剂并用-甲醇标准溶液滴定至终点,消耗标准溶液。根据上述实验原理,下列说法正确的是
A.可以用乙酸代替乙酸酐进行上述实验
B.若因甲醇挥发造成标准溶液浓度发生变化,将导致测定结果偏小
C.步骤③滴定时,不慎将锥形瓶内溶液溅出,将导致测定结果偏小
D.步骤④中,若加水量不足,将导致测定结果偏大
12.(2022·山东卷)实验室用基准配制标准溶液并标定盐酸浓度,应选甲基橙为指示剂,并以盐酸滴定标准溶液。下列说法错误的是
A.可用量筒量取标准溶液置于锥形瓶中
B.应选用配带塑料塞的容量瓶配制标准溶液
C.应选用烧杯而非称量纸称量固体
D.达到滴定终点时溶液显橙色
考法03 盐类水解及应用
13. (2024·江苏卷)室温下,通过下列实验探究SO2的性质。已知,。
实验1:将气体通入水中,测得溶液。
实验2:将气体通入溶液中,当溶液时停止通气。
实验3:将气体通入酸性溶液中,当溶液恰好褪色时停止通气。
下列说法正确的是
A. 实验1所得溶液中:
B. 实验2所得溶液中:
C. 实验2所得溶液经蒸干、灼烧制得固体
D. 实验3所得溶液中:
14. (2024·湖南卷)中和法生产的工艺流程如下:
已知:①的电离常数:,,
②易风化。
下列说法错误的是
A. “中和”工序若在铁质容器中进行,应先加入溶液
B. “调pH”工序中X为或
C. “结晶”工序中溶液显酸性
D. “干燥”工序需在低温下进行
15. (2024·湖南卷)常温下,向溶液中缓慢滴入相同浓度溶液,混合溶液中某两种离子的浓度随加入溶液体积的变化关系如图所示,下列说法错误的是
A. 水的电离程度:
B. M点:
C. 当时,
D. N点:
16.(2023·北京卷)下列过程与水解反应无关的是
A.热的纯碱溶液去除油脂
B.重油在高温、高压和催化剂作用下转化为小分子烃
C.蛋白质在酶的作用下转化为氨基酸
D.向沸水中滴入饱和溶液制备胶体
17.(2023·湖南卷)常温下,用浓度为的标准溶液滴定浓度均为的和的混合溶液,滴定过程中溶液的随()的变化曲线如图所示。下列说法错误的是
A.约为
B.点a:
C.点b:
D.水的电离程度:
18.(2022·浙江卷)时,苯酚的,下列说法正确的是
A.相同温度下,等的和溶液中,
B.将浓度均为的和溶液加热,两种溶液的均变大
C.时,溶液与溶液混合,测得,则此时溶液中
D.时,的溶液中加少量固体,水的电离程度变小
19.(2022·浙江卷)已知25℃时二元酸H2A的Ka1=1.3×10-7,Ka2=7.1×10-15。下列说法正确的是
A.在等浓度的Na2A、NaHA溶液中,水的电离程度前者小于后者
B.向0.1ml·L-1的H2A溶液中通入HCl气体(忽略溶液体积的变化)至pH=3,则H2A的电离度为0.013%
C.向H2A溶液中加入NaOH溶液至pH=11,则c(A2-)>c(HA-)
D.取pH=a的H2A溶液10mL,加蒸馏水稀释至100mL,则该溶液pH=a+1
20.(2022·河北卷)某水样中含一定浓度的CO、HCO和其他不与酸碱反应的离子。取10.00mL水样,用0.01000ml•L-1的HCl溶液进行滴定,溶液pH随滴加HCl溶液体积V(HCl)的变化关系如图(混合后溶液体积变化忽略不计)。
下列说法正确的是
A.该水样中c(CO)=0.01ml•L-1
B.a点处c(H2CO3)+c(H+)=c(OH—)
C.当V(HCl)≤20.00mL时,溶液中c(HCO)基本保持不变
D.曲线上任意一点存在c(CO)+c(HCO)+c(H2CO3)=0.03ml•L-1
考法04 沉淀溶解平衡
21. (2024·黑吉辽卷)下,、和的沉淀溶解平衡曲线如下图所示。某实验小组以为指示剂,用标准溶液分别滴定含水样、含水样。
已知:①为砖红色沉淀;
②相同条件下溶解度大于;
③时,,。
下列说法错误的是
A. 曲线②为沉淀溶解平衡曲线
B. 反应的平衡常数
C. 滴定时,理论上混合液中指示剂浓度不宜超过
D. 滴定达终点时,溶液中
22. (2024·全国甲卷)将0.10mml Ag2CrO4配制成1.0mL悬浊液,向其中滴加0.10ml·L-1的NaCl溶液。lg[cM/(ml·L-1)](M代表Ag+、Cl⁻或CrO42⁻)随加入NaCl溶液体积(V)的变化关系如图所示。
下列叙述正确的是
A.交点a处:c(Na+)=2c(Cl⁻)
B.Kₛₚ(AgCl)/Kₛₚ(Ag2CrO4)=10-2.21
C.V≤2.0mL时c(CrO42-)/c(Cl⁻)不变
D.y1=−7.82,y2=−lg34
23.(2023·全国甲卷)下图为和在水中达沉淀溶解平衡时的关系图(;可认为离子沉淀完全)。下列叙述正确的是
A.由点可求得
B.时的溶解度为
C.浓度均为的和可通过分步沉淀进行分离
D.混合溶液中时二者不会同时沉淀
24.(2023·全国乙卷)一定温度下,AgCl和Ag2CrO4的沉淀溶解平衡曲线如图所示。
下列说法正确的是
A.a点条件下能生成Ag2CrO4沉淀,也能生成AgCl沉淀
B.b点时,c(Cl-)=c(CrO),Ksp(AgCl)=Ksp(Ag2CrO4)
C.Ag2CrO4+2Cl-2AgCl+CrO的平衡常数K=107.9
D.向NaCl、Na2CrO4均为0.1ml·L-1的混合溶液中滴加AgNO3溶液,先产生Ag2CrO4沉淀
25.(2023·辽宁卷)某废水处理过程中始终保持H2S饱和,即,通过调节pH使和形成硫化物而分离,体系中与关系如下图所示,c为和的浓度,单位为。已知,下列说法正确的是
A.B.③为与的关系曲线
C.D.
26.(2023·湖南卷)处理某铜冶金污水(含)的部分流程如下:
已知:①溶液中金属离子开始沉淀和完全沉淀的如下表所示:
②。
下列说法错误的是
A.“沉渣Ⅰ”中含有和
B.溶液呈碱性,其主要原因是
C.“沉淀池Ⅱ”中,当和完全沉淀时,溶液中
D.“出水”经阴离子交换树脂软化处理后,可用作工业冷却循环用水
27.(2023·浙江卷)草酸()是二元弱酸。某小组做如下两组实验:
实验I:往溶液中滴加溶液。
实验Ⅱ:往溶液中滴加溶液。
[已知:的电离常数,溶液混合后体积变化忽略不计],下列说法正确的是
A.实验I可选用甲基橙作指示剂,指示反应终点
B.实验I中时,存在
C.实验Ⅱ中发生反应
D.实验Ⅱ中时,溶液中
28.(2023·浙江卷)碳酸钙是常见难溶物,将过量碳酸钙粉末置于水中达到溶解平衡:
[已知,,的电离常数],下列有关说法正确的是
A.上层清液中存在
B.上层清液中含碳微粒最主要以形式存在
C.向体系中通入气体,溶液中保持不变
D.通过加溶液可实现向的有效转化
29.(2022·湖南卷)室温时,用的标准溶液滴定浓度相等的、和混合溶液,通过电位滴定法获得与的关系曲线如图所示(忽略沉淀对离子的吸附作用。若溶液中离子浓度小于时,认为该离子沉淀完全。,,)。下列说法正确的是
A.a点:有白色沉淀生成
B.原溶液中的浓度为
C.当沉淀完全时,已经有部分沉淀
D.b点:
30.(2022·福建卷)锂辉石是锂的重要来源,其焙烧后的酸性浸出液中含有和杂质离子,可在0~14范围内调节对其净化(即相关离子浓度)。时,与关系见下图(碱性过强时和会部分溶解)。下列说法正确的是
A.可被净化的区间最大
B.加入适量,可进一步提升净化程度
C.净化的先后顺序:
D.
31.(2022·海南卷)某元素M的氢氧化物在水中的溶解反应为:、,25℃,-lgc与pH的关系如图所示,c为或浓度的值,下列说法错误的是
A.曲线①代表与pH的关系
B.的约为
C.向的溶液中加入NaOH溶液至pH=9.0,体系中元素M主要以存在pH=9.0,体系中元素M主要以存在
D.向的溶液中加入等体积0.4ml/L的HCl后,体系中元素M主要以存在
32.(2022·重庆卷)某小组模拟成垢-除垢过程如图。
100mL0.1ml•L-1CaCl2水溶液……
忽略体积变化,且步骤②中反应完全。下列说法正确的是
A.经过步骤①,溶液中c(Ca2+)+c(Na+)=c(Cl-)
B.经过步骤②,溶液中c(Na+)=4c(SO)
C.经过步骤②,溶液中c(Cl-)=c(CO)+c(HCO)+c(H2CO3)
D.经过步骤③,溶液中c(CH3COOH)+c(CH3COO-)=c(Cl-)
33.(2022·山东卷)工业上以为原料生产,对其工艺条件进行研究。现有含的、溶液,含的、溶液。在一定pH范围内,四种溶液中随pH的变化关系如图所示。下列说法错误的是
A.反应的平衡常数
B.
C.曲线④代表含的溶液的变化曲线
D.对含且和初始浓度均为的混合溶液,时才发生沉淀转化
考法05 离子平衡综合题
34. (2024·山东卷)常温下水溶液体系中存在反应:,平衡常数为K。已初始浓度,所有含碳物种的摩尔分数与变化关系如图所示(忽略溶液体积变化)。下列说法正确的是
A. 线Ⅱ表示的变化情况
B. 的电离平衡常数
C. 时,
D. 时,
35. (2024·浙江卷1月)常温下、将等体积、浓度均为0.40ml·L-1BaCl2溶液与新制H2SO3溶液混合,出现白色浑浊;再滴加过量的H2O2溶液,振荡,出现白色沉淀。
已知:H2SO3 Ka1=1.4×10-2 Ka2=6.0×10-8
Ksp(BaSO3)=5.0×10-10, Ksp(BaSO4)=1.1×10-10
下列说法不正确的是
A. H2SO3溶液中存在c(H+)>c(HSO3-)>c(SO32-)>c(OH-)
B. 将0.40ml·L-1H2SO3溶液稀释到0.20ml·L-1,c(SO32-)几乎不变
C. BaCl2溶液与H2SO3溶液混合后出现的白色浑浊不含有BaSO3
D. 存在反应Ba2++H2SO3+H2O2=BaSO4↓+2H++H2O是出现白色沉淀的主要原因
36. (2024·安徽卷)环境保护工程师研究利用、和处理水样中的。已知时,饱和溶液浓度约为,,,,。下列说法错误的是
A. 溶液中:
B. 溶液中:
C. 向的溶液中加入,可使
D. 向的溶液中通入气体至饱和,所得溶液中:
37. (2024·河北卷)在水溶液中,可与多种金属离子形成配离子。X、Y、Z三种金属离子分别与形成配离子达平衡时,与的关系如图。
下列说法正确的是
A. 的X、Y转化为配离子时,两溶液中的平衡浓度:
B. 向Q点X、Z的混合液中加少量可溶性Y盐,达平衡时
C. 由Y和Z分别制备等物质的量的配离子时,消耗的物质的量:
D. 若相关离子的浓度关系如P点所示,Y配离子的解离速率小于生成速率
38. (2024·湖北卷)气氛下,溶液中含铅物种的分布如图。纵坐标()为组分中铅占总铅的质量分数。已知,、,。下列说法错误的是
A. 时,溶液中
B. 时,
C. 时,
D. 时,溶液中加入少量,会溶解
39. (2024·江苏卷)室温下,根据下列实验过程及现象,能验证相应实验结论的是
40. (2024·浙江卷6月)室温下,水溶液中各含硫微粒物质的量分数随变化关系如下图[例如]。已知:。
下列说法正确的是
A. 溶解度:大于
B. 以酚酞为指示剂(变色的范围8.2~10.0),用标准溶液可滴定水溶液的浓度
C. 忽略的第二步水解,的溶液中水解率约为
D. 的溶液中加入等体积的溶液,反应初始生成的沉淀是
41.(2023·浙江卷6月)草酸()是二元弱酸。某小组做如下两组实验:
实验I:往溶液中滴加溶液。
实验Ⅱ:往溶液中滴加溶液。
[已知:的电离常数,溶液混合后体积变化忽略不计],下列说法正确的是
A.实验I可选用甲基橙作指示剂,指示反应终点
B.实验I中时,存在
C.实验Ⅱ中发生反应
D.实验Ⅱ中时,溶液中
42.(2023·湖北卷)为某邻苯二酚类配体,其,。常温下构建溶液体系,其中,。体系中含Fe物种的组分分布系数δ与pH的关系如图所示,分布系数,已知,。下列说法正确的是
A.当时,体系中
B.pH在9.5~10.5之间,含L的物种主要为
C.的平衡常数的lgK约为14
D.当时,参与配位的
43.(2023·新课标卷)向饱和溶液(有足量固体)中滴加氨水,发生反应和,与的关系如下图所示(其中M代表、、或)。
下列说法错误的是
A.曲线I可视为溶解度随浓度变化曲线
B.的溶度积常数
C.反应的平衡常数K的值为
D.时,溶液中
44.(2023·北京卷)利用平衡移动原理,分析一定温度下在不同的体系中的可能产物。
已知:i.图1中曲线表示体系中各含碳粒子的物质的量分数与的关系。
ii.2中曲线Ⅰ的离子浓度关系符合;曲线Ⅱ的离子浓度关系符合[注:起始,不同下由图1得到]。
下列说法不正确的是
A.由图1,
B.由图2,初始状态,无沉淀生成
C.由图2,初始状态,平衡后溶液中存在
D.由图1和图2,初始状态、,发生反应:
考点
三年考情(2022-2024)
命题趋势
考点1 水溶液中的离子反应与平衡
◆弱电解质的电离平衡:2024新课标卷、2023浙江卷、2022全国乙卷、2022湖北卷、2022浙江卷、2022北京卷
◆水的电离和溶液的pH:2023湖南卷、2023山东卷、2022山东卷、2022浙江卷
◆盐类的水解及其应用:2024江苏卷、2024湖南卷、2023北京卷、2023湖南卷、2022北京卷、2022海南卷、2022浙江卷、2022福建卷、2022河北卷、2022江苏卷
◆沉淀溶解平衡:2024黑吉辽卷、2024湖北卷、2024全国甲卷、2023全国甲卷、2023全国乙卷、2023辽宁卷、2023湖南卷、2023北京卷、2022湖南卷、2022福建卷、2022海南卷、2022重庆卷、2022山东卷
◆离子平衡综合题:2024山东卷、2024浙江卷、2024安徽卷、2024河北卷、2024湖北卷、2024江苏卷、2024浙江卷、2023浙江卷、2023新课标卷、2023湖北卷、2023北京卷
水溶液中的离子反应与平衡主要考查水溶液中的几大平衡问题:电离平衡、水的电离平衡、水解平衡和沉淀溶解平衡,以及中和滴定原理的应用,值得注意的是,对离子平衡的考查往往结合电离平衡、沉淀平衡、化学平衡等问题进行考查,综合性很强。各省命题的新课标卷中,大多数不再将水溶液中的离子反应与平衡作为压轴选择题出现,总体难度有所降低。
步骤
操作或叙述
A
Ⅰ.用标准溶液标定醋酸溶液浓度
滴定时应始终注视滴定管中的液面
B
Ⅱ.用标定后的溶液配制不同浓度的醋酸溶液
应使用干燥的容量瓶
C
Ⅲ.测定步骤Ⅱ中所得溶液的
应在相同温度下测定
D
Ⅳ.计算不同浓度溶液中醋酸的电离度
计算式为
物质
开始沉淀
1.9
4.2
6.2
3.5
完全沉淀
3.2
6.7
8.2
4.6
选项
实验过程及现象
实验结论
A
用溶液分别中和等体积的溶液和溶液,消耗的溶液多
酸性:
B
向溶液中滴加几滴溴水,振荡,产生淡黄色沉淀
氧化性:
C
向浓度均为的和混合溶液中滴加少量溶液,振荡,产生白色沉淀
溶度积常数:
D
用pH试纸分别测定溶液和溶液pH,溶液pH大
结合能力:
专题09 水溶液中的离子反应与平衡-三年(2022-2024)高考化学真题分类汇编(全国通用)(含解析): 这是一份专题09 水溶液中的离子反应与平衡-三年(2022-2024)高考化学真题分类汇编(全国通用)(含解析),共57页。
专题08 化学反应速率与化学平衡-三年(2022-2024)高考化学真题分类汇编(全国通用)(含解析): 这是一份专题08 化学反应速率与化学平衡-三年(2022-2024)高考化学真题分类汇编(全国通用)(含解析),共37页。
专题09 水溶液中的离子反应与平衡-三年(2022-2024)高考化学真题分类汇编(全国通用): 这是一份专题09 水溶液中的离子反应与平衡-三年(2022-2024)高考化学真题分类汇编(全国通用),文件包含专题09水溶液中的离子反应与平衡-真题汇编三年2022-2024高考化学真题分类汇编全国通用原卷版docx、专题09水溶液中的离子反应与平衡-真题汇编三年2022-2024高考化学真题分类汇编全国通用解析版docx等2份试卷配套教学资源,其中试卷共59页, 欢迎下载使用。












