






所属成套资源:2024-2025人教版(新课标)化学必修1PPT课件整套
高中化学人教版 (新课标)必修1第二节 离子反应获奖ppt课件
展开
这是一份高中化学人教版 (新课标)必修1第二节 离子反应获奖ppt课件,文件包含22离子反应第1课时电解质与非电解质pptx、化学视频素材硝酸钾熔化状态下导电avi等2份课件配套教学资源,其中PPT共38页, 欢迎下载使用。
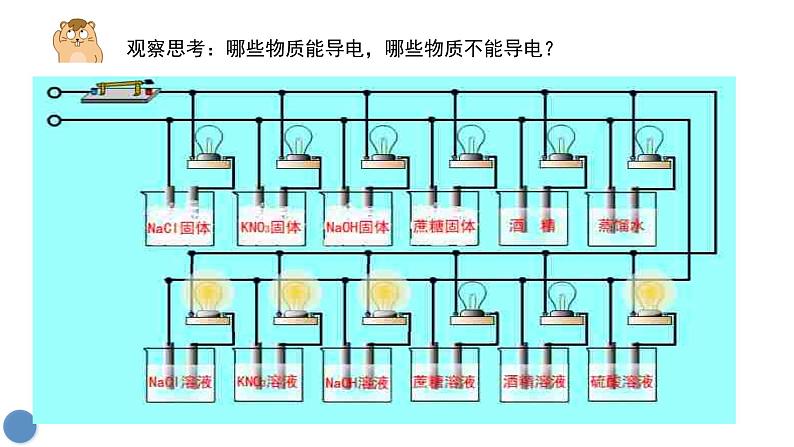
观察思考:哪些物质能导电,哪些物质不能导电?
我们知道像硝酸钾固体、氯化钠固体这样的盐不能导电,那么它们在熔融状态下可以导电吗?
结论:熔融状态下的硝酸钾能导电
熔融状态的硝酸钾的导电性实验
定义:在水溶液里或熔融状态下能导电的化合物叫做电解质
物质类别:(1)酸,如HCl、H2SO4、HNO3、CH3COOH、H2CO3等(2)碱,如NaOH、Ba(OH)2、NH3·H2O(3)盐,如NaCl、Na2SO4、BaSO4等(4)活泼金属氧化物(5)水
【小试牛刀】判断题: 铜能够导电,所以是电解质; 氯化钠的水溶液能够导电,所以食盐水是电解质; 盐酸是电解质硫酸是电解质
剖析电解质定义中的关键词:
(1)化合物:单质和混合物不属于化合物,所以不是电解质。
(×):因为盐酸是混合物,只能说氯化氢是电解质。
(2)或:两个条件满足其一即可;
【小试牛刀】判断: 固体氯化钠不导电,所以氯化钠不是电解质; NaCl在水溶液和熔融状态下都能导电,所以NaCl是电解质; 液态HCl不导电,所以HCl不是电解质; BaSO4难溶于水,其水溶液不导电,所以BaSO4不是电解质;
(3)熔融:对于各种状态的物质,熔融的含义不同对于常温下是固体的物质(如NaCl,KNO3),熔融态就是指加热至熔化的状态;对于常温下是液体的物质(如酒精,硫酸),熔融态是指纯液态的状态;对于常温下是气体的物质(如HCl,NH3),熔融态是指气体液化后的形式。
判断:CO2是不是电解质?
CO2不属于电解质。因为CO2溶于水后导电的物质已经不是CO2而是碳酸。
(4)导电是指自身能够导电,而不是发生化学反应才导电。
类似的物质还包括SO2,SO3,NO2,NH3
SO2+H2O=H2SO3; SO3+H2O=H2SO4NO2+H2O=HNO3+NO; NH3+H2O=NH3·H2O
【小试牛刀】下列叙述正确的是( )①氯化钠溶液能导电,所以氯化钠溶液是电解质②铜能导电,所以是电解质③BaSO4的水溶液不能导电,所以BaSO4不是电解质④固体氯化钠不导电,但氯化钠是电解质A.②③④ B.④ C.①④ D.①③④
定义:在水溶液和熔融状态下,均不能导电的化合物。
关键词剖析:(1)非电解质也必须是化合物判断:氢气在水溶液和熔融状态下均不能导电,所以氢气是非电解质(2)“和”判断:酒精在水溶液和熔融状态下均不能导电,所以酒精是非电解质
物质类别:(1)非金属氧化物,如CO2、SO2、NO2等 (2)部分非金属氢化物,如NH3等 (3)部分有机物(非酸非盐),如酒精、蔗糖等
【小试牛刀】根据中学对电解质、非电解质的定义判断下列叙述正确的是 ( )A.虽然石墨有较好的导电性,但它属于非电解质B.实验测定NH3、CO2的水溶液均能导电,所以NH3、CO2均是电解质C.实验测定液态HCl、固体NaCl均不能导电,所以HCl、NaCl均是非电解质D.蔗糖(纯净物)在水溶液、熔融状态下均不能导电,所以蔗糖属于非电解质
【再来一刀】下列叙述正确的是( )①液态氯化氢不能导电,所以氯化氢是非电解质②三氧化硫溶于水能导电,所以三氧化硫是电解质③AgCl的水溶液不能导电,所以AgCl是非电解质④尽管氨气溶入水能导电,但是氨气是非电解质⑤酒精在水溶液和熔融状态下均不导电,所以酒精是非电解质⑥汞可以导电,但它是单质,所以它不是电解质,而是非电解质A.②③⑥ B.④⑤ C.④⑤⑥ D.①④⑤⑥
非金属氧化物、部分非金属氢化物、部分有机物(非酸非盐)
酸、碱、盐、水、活泼金属氧化物
【小试牛刀】下列物质既不是电解质,又不是非电解质的是( ) A.NaHSO4 B.Cu(OH)2 C.O2 D.HCl
【再来一刀】下列四组物质中,前者属于电解质,后者属于非电解质的是 ( ) A.三氧化硫 碳酸钠 B.碳酸氢钠 蔗糖 C.氧化铝 硫 D.KCl晶体 BaSO4
【再来一刀】下列物质:①铜 ②稀硫酸 ③HCl ④氨气 ⑤空气 ⑥二氧化碳 ⑦氯化银 ⑧氯化钠 ⑨乙醇 ⑩硫酸氢钠 (1) 以上物质中属于电解质的是_________________。 (2) 属于非电解质的是________________。
金属和溶液能够导电的原因是什么?
二、酸、碱、盐在水溶液中的电离
NaCl在水中的溶解和电离的示意图
1、电离(1)定义:电解质在水溶液中或熔融状态下产生能够自由移动的离子的过程。
(2)电离的表示——电离方程式
用化学符号表示电解质电离成自由移动离子的过程。
如:NaCl=Na++Cl-
电解质和非电解质在水中电离的比较
现在你明白电解质溶液能导电和非电解质不能导电的原因了吗?
NaCl == Na+ + Cl-
遵循质量守恒(即方程式两边原子种类和个数必须相等)和电荷守恒。
Ba2+ + 2Cl-
(2)阴、阳离子拆开写,原子团不能拆
NaHCO3在水溶液中应该如何电离?
① 强酸的酸式盐: H+单独电离
NaHSO4=Na++H++SO42-
② 弱酸的酸式盐: H+不能单独电离
NaHSO4在水溶液中应该如何电离:
NaHCO3=Na++HCO3-
③ 在熔融状态下,酸式盐的H+均不单独电离
NaHSO4(熔融态)=Na++HSO4-
【小试牛刀】写出下列酸的电离方程式: HCl 、HNO3、H2SO4
H2SO4 == 2 H+ + SO42-
HCl == H+ + Cl-
HNO3 == H+ + NO3-
▲酸:电离时生成的阳离子全部是H+的化合物。
一、酸、碱、盐在水溶液中的电离
【再来一刀】写出下列碱的电离方程式:NaOH , KOH , Ba(OH)2
NaOH == Na+ + OH-
▲碱:电离时生成的阴离子全部是OH-的化合物。
Ba(OH)2 == Ba2++ 2OH-
KOH == K+ + OH-
练习3 写出下列盐的电离方程式:NaCl,KNO3,Fe2(SO4)3,NaHSO4
NaCl = Na+ + Cl-
▲盐:电离时能生成金属离子和酸根离子的化合物。
KNO3 = K+ + NO3-
Fe2(SO4)3 =2Fe3++3SO42-
NaHSO4 = Na+ + H+ +SO42-
【小试牛刀】下列电离方程式中正确的是( )A. Ca(OH)2 = Ca2+ +2 OH- B. FeCl3 =Fe2++3Cl- C. BaCl2 = Ba2++Cl- D. Na2CO3 =2Na++CO32-
【再来一刀】下列物质在水溶液中电离的电离方程式,不正确的是( )A.NaHCO3 = H++CO32-+Na+ B.HNO3 = H++NO3- C.Al2 (SO4) 3 = 2Al3++3SO42- D.Ba(OH) 2 = Ba2++2OH-
非电解质:非金属氧化物、NH3、部分有机物
强电解质:强酸、强碱、大多数盐、活泼金属氧化物
弱电解质:弱酸、弱碱、少部分盐、H2O
既不是电解质,也不是非电解质
二、电离方程式书写: (1)阴、阳离子拆开写,原子团不能拆; (2)构成物质的原子或原子团的个数在书写成离子时为系数; (3)酸式盐的电离,根据酸式盐对应的酸的强弱来确定: 强酸的酸式盐: H +单独电离;弱酸的酸式盐: H+不能单独电离;熔融态下两者H +都不能单独电离。(4)强电解质的电离用“=”,弱电解质的电离用“⇌”;(5)多元弱酸的电离要分步进行; (6)多元弱碱的电离一步书写
1.以下为中学化学中常见的物质①NaCl固体;②液态SO3;③冰醋酸;④ 汞;⑤BaCl2固态;⑥蔗糖;⑦乙醇;⑧熔融Na2O;⑨氨水;⑩石墨(1)能导电的是 ;(2)属于电解质的是 ;(3)属于非电解质的是 ;(4)溶于水后形成的水溶液能导电的是 ;
2.判断下列说法正确的是( ) A、其水溶液能导电的物质都是电解质 B、固体硫酸钠不能导电,它不是电解质 C、能导电的物质一定是电解质 D、固态磷酸是电解质,所以它在熔融时或是溶于水时能导电
3.下列叙述正确的是( )A、NaCl溶液在电流的作用下电离成钠离子和氯离子B、溶于水后能电离出H+的化合物都是酸C、硫酸钡难溶于水,但硫酸钡是电解质D、二氧化碳溶于水能导电,故二氧化碳属于电解质
4.下列电离方程式中正确的是( ) A、Al2(SO4)3=2Al3+ + 3SO42- B、Na2SO4=Na+ + SO42- C、Ca(NO3)2=Ca2+ + 2(NO3)2- D、Ba(OH)2=Ba2+ + OH2-










