





高中化学人教版 (新课标)必修1第三节 硫和氮的氧化物一等奖课件ppt
展开第三节 硫和氮的氧化物(第1课时 硫的氧化物)
第四章 非金属及其化合物
一、二氧化硫和三氧化硫
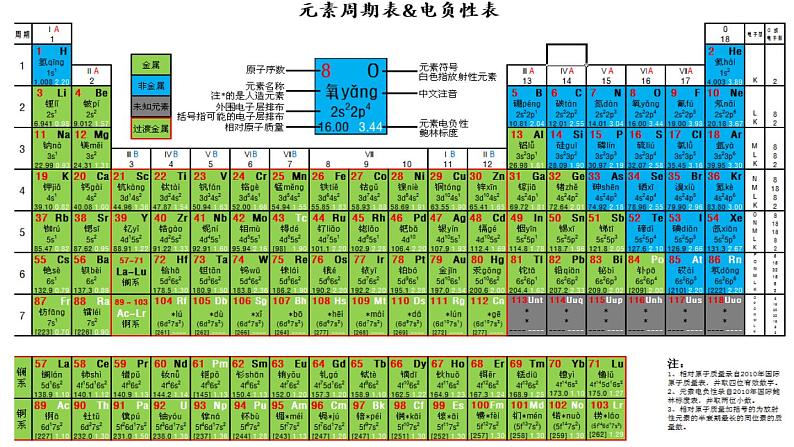
硫(S)位于元素周期表的第三周期、第VIA族
硫(硫黄)是一种重要的非金属元素,广泛存在于自然界。
火山口附近或地壳的岩层里
(2)物理性质:黄色晶体(俗称硫磺),质脆,易研成粉末。不溶于水,微溶于酒精,易溶于CS2 。
石膏(CaSO4·2H2O)
芒硝(Na2SO4·10H2O)
(3)化学性质:
S既有氧化性又有还原性!
实验现象:在氧气中燃烧生成明亮的蓝紫色火焰。
a.氧化性 S+Fe = FeS 2Cu+S = Cu2S
【小试牛刀】下列有关硫的性质的叙述正确的是( ) A.淡黄色晶体,质脆易粉碎,不溶于水易溶于酒精 B.硫的非金属性较强,在自然界中只以化合态存在 C.既有氧化性又有还原性,硫与铁粉和铜粉分别反应,都可生成二价金属硫化物 D.粘有硫的试管可用CS2或热的NaOH溶液清洗
SO2一种无色、有刺激性气味的有毒气体,密度比空气大、容易液化、易溶于水。
(1)漂白性:它能与某些有色物质结合生成不稳定的无色物质,发生的是非氧化还原反应。
“黄”银耳“变”成了“白”银耳。
亚硫酸是一种弱酸,不稳定,容易分解成水和二氧化硫。
【小试牛刀】判断下列反应哪个不属于可逆反应?
A.2NO2 N2O4B.2H2+O2 2H2O C.SO2+ H2O H2SO3 D.CO2+ H2O H2CO3
(3)既有氧化性,又有还原性。 ——从氧化还原角度
【现象分析】SO2具有还原性,能被酸性KMnO4溶液和溴水氧化,从而使它们的溶液褪色;它也具有弱氧化性,可将H2S氧化成单质S。
5SO2+2KMnO4+2H2O=K2SO4 +2MnSO4+2H2SO4
SO2+Br2 +2 H2O=H2SO4+2HBr
SO2+2H2S=3S↓+2H2O
SO2+2H2O+2FeCl3=2HCl+2FeCl2+H2SO4
几种具有漂白性物质的性质比较
氯水中的次氯酸将有色物质氧化成无色物质
氧化还原反应(化学变化)
可漂白大多数有色物质,能使紫色石蕊褪色。
二氧化硫与有色物质结合生成不稳定的无色物质
非氧化还原反应(化学变化)
可漂白某些有色物质,不能使石蕊试液褪色
将有色物质的分子吸附在其表面
可吸附某些有色物质的分子
2SO2+O2 2SO3
SO3+H2O=H2SO4
⑵ 可以漂白纸浆、毛、丝、草编制品等⑶ 杀灭霉菌和细菌⑷ 作食物和干果的防腐剂
熔点为16.8℃,沸点为44.8℃,常温下不为气体。 注意:不能说在标准状态下1mlSO3所占的体积为22.4L。
SO3+H2O=H2SO4(放出大量热)
SO3+CaO=CaSO4
SO3+Ca(OH)2=CaSO4+H2O
(2)化学性质:酸性氧化物的通性
1.常温下单质硫主要以S8形式存在。加热时,S8会转化为S6、S4、S2等。当温度达到750 ℃时,硫蒸气主要以S2形式存在(占92%)。下列说法中正确的是( ) A.S8转化为S6、S4、S2属于物理变化 B.不论哪种硫分子,完全燃烧时都生成二氧化硫 C.S2、S4、S6、S8都是硫元素形成的单质,为同种物质 D.把硫单质在空气中加热到750 ℃即得S2
2.如图是某燃煤发电厂处理废气的装置示意图,装置内发生的主要反应中不含( ) A.化合反应 B.分解反应 C.置换反应 D.氧化还原反应
3.如图装配好装置,待内外空气压强不变时标注出水银液面的刻度(用红漆),取下橡皮塞,在玻璃燃烧匙中加入硫粉,用酒精灯点燃迅速移入锥形瓶中并塞紧橡皮塞。硫粉安静地燃烧,水银柱推向左管.当火焰熄灭后,静置,水银柱又慢慢回到原标定的刻度。简要回答下列问题:
高中化学人教版 (新课标)必修1第四章 非金属及其化合物第三节 硫和氮的氧化物课文ppt课件: 这是一份高中化学人教版 (新课标)必修1第四章 非金属及其化合物第三节 硫和氮的氧化物课文ppt课件,共37页。PPT课件主要包含了二氧化硫的用途,雷雨发庄稼等内容,欢迎下载使用。
2020-2021学年第四章 非金属及其化合物第三节 硫和氮的氧化物说课ppt课件: 这是一份2020-2021学年第四章 非金属及其化合物第三节 硫和氮的氧化物说课ppt课件,共45页。PPT课件主要包含了实验4-7,SO2的物理性质,问题讨论,实验现象,品红溶液褪色,二氧化硫的用途,物理性质,化学性质,课堂小结,信使分子NO等内容,欢迎下载使用。
人教版 (新课标)必修1第三节 硫和氮的氧化物课文配套课件ppt: 这是一份人教版 (新课标)必修1第三节 硫和氮的氧化物课文配套课件ppt,共33页。PPT课件主要包含了明星分子NO,科学探究,未受酸雨伤害的水稻,课堂训练,雷雨发庄稼等内容,欢迎下载使用。













