





人教版 (新课标)必修1第四章 非金属及其化合物第四节 氨 硝酸 硫酸完美版课件ppt
展开酸:电离时产生的阳离子全部是H+的化合物
2、与碱发生中和反应生成盐和水
3、与碱性氧化物反应生成盐和水
4、与活泼金属反应生成H2
5、与部分盐反应生成另一种盐和另一种酸
(3)实验室里用金属与酸反应制取氢气,往往用稀硫酸或盐酸,而不用浓硫酸或硝酸,这是为什么?
色态:无色、粘稠的油状液体沸点:约338℃——难挥发性酸(高沸点酸)密度:1.84g/cm3——高密度酸溶解性:跟水以任意比互溶,溶解时放出大量热两高:沸点高、密度高两大:溶解度大、溶解放热量大
注意:稀释浓硫酸时,只能将浓硫酸沿烧杯 内壁缓慢加入水中,并边加边搅拌。
(1)浓H2SO4的物理性质
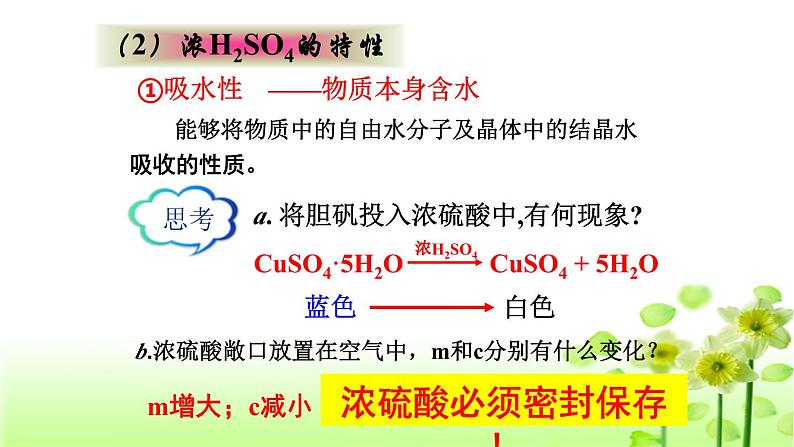
a. 将胆矾投入浓硫酸中,有何现象?
b.浓硫酸敞口放置在空气中,m和c分别有什么变化?
能够将物质中的自由水分子及晶体中的结晶水吸收的性质。
(2)浓H2SO4的特性
2003年1月29日、2月23日,清华大学机电系四年级学生刘海洋先后两次用浓硫酸将北京动物园的五只熊烧伤,其中一头黑熊双目失明。这一故意残害动物的事件经媒体披露后,引起了公众的强烈愤慨!
思考:浓硫酸为何能残害黑熊?
【实验】在200mL烧杯中放入20g蔗糖,加入几滴水,搅拌均匀。然后再加入15mL溶质的质量分数为98%的浓硫酸,迅速搅拌。
烧杯壁发烫,产生大量白雾;蔗糖逐渐变黑,体积膨胀,形成疏松多孔的海绵状的炭,并产生有刺激性气味气体。
将不含自由水分子的物质中的氢原子和氧原子按水分子的构成脱去的性质。
——物质本身不含水
b.与某些还原性化合物反应
H2SO4 (浓) +H2S = SO2↑+ S↓ +2H2O
H2SO4 (浓) +2HBr = SO2↑+ Br2+2H2O
—由+6价的硫引起,一般被还原为SO2
H2SO4 (浓) +2HI = SO2↑+ I2+2H2O
—浓硫酸只体现强氧化性
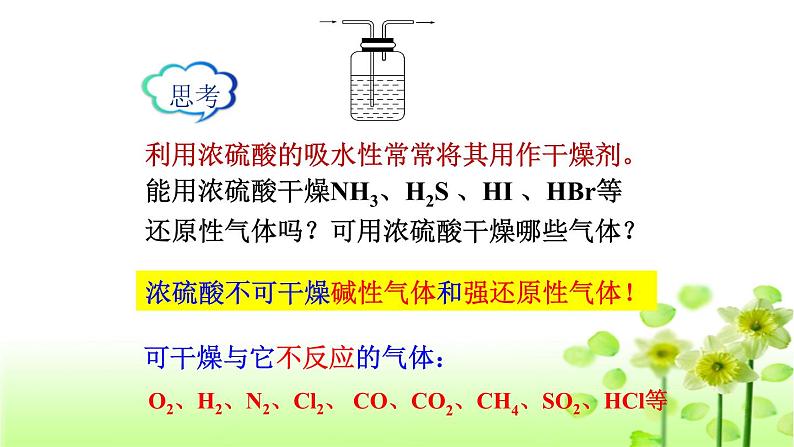
可干燥与它不反应的气体:
O2、H2、N2、Cl2、 CO、CO2、CH4、SO2、HCl等
利用浓硫酸的吸水性常常将其用作干燥剂。能用浓硫酸干燥NH3、H2S 、HI 、HBr等还原性气体吗?可用浓硫酸干燥哪些气体?
浓硫酸不可干燥碱性气体和强还原性气体!
c.与金属(Cu)反应
实验现象:a.加热前无变化;加热后,试管中铜丝表面 ;b.试管中的品红试液 ;试管中的紫色石蕊试液 ; c.冷却后,把试管里的液体慢慢倒入盛有少量水的另一支试 管里,溶液变为 。
注意:在加热情况下,绝大多数金属(除Pt、Au外)都能与浓硫酸反应,通常不产生H2!
Fe、Al 遇冷、浓硫酸发生钝化
—浓硫酸体现了强氧化性和酸性
通常情况下,浓硫酸可用铁制容器或铝制容器贮存和运输。
①反应要加热,否则不反应。 ②浓硫酸具有强氧化性,能将金属(非金属)的单质(低价态化合物)氧化至最高价态:非金属得到最高价态氧化物(S被氧化成SO2)、金属得到最高价态盐(硫酸盐以及其他盐),硫酸被还原成SO2,同时得到水。 ③浓硫酸与金属反应时,既表现酸性又表现强氧化性,而与非金属反应时,只表现强氧化性。 ④随着反应的进行,c(H2SO4)下降,一旦变为稀硫酸,反应停止。
【小结】浓硫酸能够与不活泼金属或非金属发生反应,反应过程中有如下规律
稀H2SO4:由H+和SO42-构成——弱氧化性(由H+体现) ——与活泼金属反应生成H2 浓H2SO4 :由H2SO4分子构成——强氧化性(由 S 体现)
浓硫酸具有强氧化性,稀硫酸是否有氧化性?如果有,其氧化性与浓硫酸的氧化性有何不同?
小结:浓硫酸与稀硫酸的比较
试剂:BaCl2溶液和稀盐酸方法:取少量待测液于试管中,先加足量稀盐酸酸化, 无明显现象;再加BaCl2溶液,若产生白色沉淀, 则有SO42-。
1、加入盐酸酸化以排除CO32-、SO32-、 Ag+ 、 HSO3-等的干扰。
2、不用硝酸酸化,防止SO32- 、 HSO3- 被氧化成SO42-而造成干扰。
①是重要的化工原料,用于制化肥、农药、炸药、染料、盐类等。
②是化学实验室里必备的重要试剂。
③用于精炼石油、金属加工前的酸洗及制取各种挥发性酸等。
Na2SO3(s)+2H2SO4(浓)=Na2SO4+H2O+SO2↑
(3)浓H2SO4的用途
亲爱的水 : 每当我遇上你,我就有种沸腾的感觉,我全身会发热。当我见不到你时,我会在空气中寻找你的气息。我是多么渴望与你相处! 我有时很暴躁,这我承认。但是我无法改变我的脾气。 因为这是我正六价硫原子决定的。 水, 虽然别人认为我的脾气不好。他们说我欺负铜和炭,欺负硫化氢。可是认识你以后,我脾气改了不少,就连铁、铝两个小淘气鬼我都容忍了。 水, 我为你可以付出一切, 就算为了你, 我变成稀硫酸,我也不会后悔, 我对你的心也不会变, 因为我是不挥发的,这点我比硝酸、盐酸强多了! 水, 请你不要逃避, 你逃到天涯海角, 我也会找到你。就算你逃到有机物中,我也会把氢氧重新合成你。因为我喜欢你! 98%浓硫酸 留
1.下列叙述或操作中正确的是( ) A.浓硫酸具有氧化性,稀硫酸无氧化性 B.浓硫酸能使硫酸铜晶体失去结晶水,体现了浓硫酸的脱水性 C.浓硫酸不慎沾到皮肤上,应立即用布拭去,再涂上稀NaOH溶液 D.浓硫酸对有机物的腐蚀性是浓硫酸脱水性和强氧化性的综合体现
高中化学人教版 (新课标)必修1第四章 非金属及其化合物第四节 氨 硝酸 硫酸多媒体教学ppt课件: 这是一份高中化学人教版 (新课标)必修1第四章 非金属及其化合物第四节 氨 硝酸 硫酸多媒体教学ppt课件,共53页。PPT课件主要包含了思考·交流,HCl,NH3,现象产生大量白烟,实验探究,实验·探究,如何检验SO42-,浓硫酸的特性,⑵脱水性,3氧化性等内容,欢迎下载使用。
人教版 (新课标)必修1第四节 氨 硝酸 硫酸图文ppt课件: 这是一份人教版 (新课标)必修1第四节 氨 硝酸 硫酸图文ppt课件,共47页。PPT课件主要包含了氨的化学性质,2氨与酸的反应,现象产生大量白烟,思考与交流,氨的用途,制铵盐,制硝酸,制尿素,制冷剂,试剂及操作等内容,欢迎下载使用。
高中化学人教版 (新课标)必修1第四节 氨 硝酸 硫酸教案配套ppt课件: 这是一份高中化学人教版 (新课标)必修1第四节 氨 硝酸 硫酸教案配套ppt课件,共19页。PPT课件主要包含了常见酸的挥发性,具有酸的通性,硝酸的不稳定性,浓硝酸与铜的反应,固+液→气,还原剂,介绍玻尔爱国事迹,氧化性酸小结,易钝化物质小结,硝酸的用途等内容,欢迎下载使用。













