





高中化学人教版 (新课标)必修1第四章 非金属及其化合物第四节 氨 硝酸 硫酸完美版ppt课件
展开(1)浓HNO3的物理性质
纯硝酸是无色、有刺激性气味的液体, 密度比水大,能以任意比溶解于水。
质量分数为69%的硝酸为浓硝酸。
质量分数为98%以上的硝酸为发烟硝酸。
低沸点(83℃),易挥发。
②氧化性:与金属反应(除Au和Pt外)
Cu+4HNO3(浓)= Cu(NO3)2+ 2NO2↑+2H2O
3Cu+8HNO3(稀)= 3Cu(NO3)2 + 2NO↑+4H2O
氧化性:浓硝酸>稀硝酸
(2)浓HNO3的化学性质
②氧化性:与非金属反应
【小结】硝酸与金属反应时,主要是HNO3中+5价的氮得到电子,被还原成较低价氮的物质,稀硝酸的还原产物一般是NO,浓硝酸的还原产物一般是NO2,而不像盐酸与金属反应那样生成H2。
【特别提醒】硝酸还能氧化FeO、 Fe(NO3)2(Fe2+)、 HBr(Br-)、 HI(I-) 、H2S (S2-)、 SO2等具有还原性的化合物发生氧化还原反应,因此,不能用硝酸与有关的盐反应制取HI、 SO2、 H2S、 HBr等气体
(浓、稀)硝酸具有强氧化性,均能将金属(非金属)的单质(低价态化合物)氧化至最高价态:非金属得到最高价态氧化物、金属得到最高价态盐(硝酸盐以及其他盐),浓硝酸被还原成NO2,硝酸被还原成NO或更低价态含氮化合物,同时得到水。
③不稳定性:硝酸不稳定,见光易分解:
因此,硝酸要保存在棕色瓶里,并置于阴凉的地方
注意:在加热情况下,绝大多数金属(除Pt、Au外)都能与浓硫酸反应,通常不产生H2!
Fe、Al 遇冷的浓硫酸(硝酸)发生钝化
通常情况下,浓硫酸可用铁制容器或铝制容器贮存和运输。
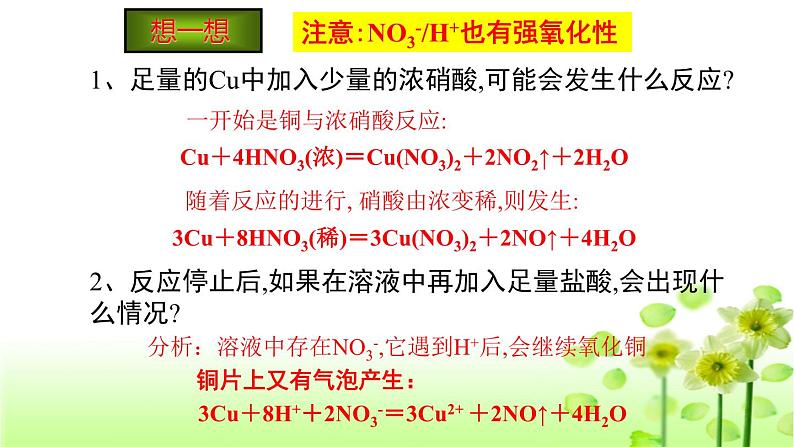
1、足量的Cu中加入少量的浓硝酸,可能会发生什么反应?
一开始是铜与浓硝酸反应:
Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O
随着反应的进行, 硝酸由浓变稀,则发生:
3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
2、反应停止后,如果在溶液中再加入足量盐酸,会出现什么情况?
分析:溶液中存在NO3-,它遇到H+后,会继续氧化铜
注意:NO3-/H+也有强氧化性
【小试牛刀】下列关于硝酸说法正确的是( ) A.硝酸与金属反应,主要是+5价氮得电子 B.与金属反应时,稀硝酸可能被还原为更低价态,则稀硝酸氧化性强于浓硝酸 C.硝酸电离出H+离子,能被Zn、Fe等金属还原成H2 D.常温下,向浓HNO3中投入Fe片,会产生大量红棕色气体
①是重要的化工原料,用于制化肥、农药、炸药、染料、盐类等。
②是化学实验室里必备的重要试剂。
③用于精炼石油、金属加工前的酸洗及制取各种挥发性酸等。
Na2SO3(s)+2H2SO4(浓)=Na2SO4+H2O+SO2↑
(1)浓H2SO4的用途
制化肥、农药、炸药、染料、盐等
(2)浓HNO3的用途
按正确的顺序连接下列仪器,并说明你的理由。
【小试牛刀】如何用实验方法证明木炭与浓硫酸反应的产物?
3Fe+8HNO3(稀)= 3Fe(NO3)2 + 2NO↑+4H2O
Fe被氧化成Fe(+2价),说明硝酸的氧化性弱,该说法是否正确?请说明理由。
1.物质氧化性、还原性的强弱,不仅与物质的结构有关,还与物质的浓度和反应温度有关。下列各组物质在反应中的产物与物质的浓度有关的是( ) ①Cu与HNO3溶液;②Cu与FeCl3溶液;③Zn与H2SO4溶液;④Fe与HCl溶液 A.①③ B.③④ C.①② D.①③④
2.向一定体积 18ml/L的浓硫酸中加入过量的铜片并加热,被还原的硫酸为0.9 ml。则浓硫酸的体积为( ) A. 等于50 mL B. 大于50 mL 小于 100 mL C. 等于100 mL D. 大于100 mL
3.用如图所示实验装置(夹持仪器已略去)探究铜丝与过量浓硫酸的反应。下列实验操作不合理的是( ) A.上下移动①中铜丝可控制SO2的量 B.②中选用品红溶液验证SO2的生成 C.③中选用NaOH溶液吸收多余的SO2 D.为确认CuSO4生成,向①中加水,观察颜色
高中化学人教版 (新课标)必修1第四章 非金属及其化合物第四节 氨 硝酸 硫酸多媒体教学ppt课件: 这是一份高中化学人教版 (新课标)必修1第四章 非金属及其化合物第四节 氨 硝酸 硫酸多媒体教学ppt课件,共53页。PPT课件主要包含了思考·交流,HCl,NH3,现象产生大量白烟,实验探究,实验·探究,如何检验SO42-,浓硫酸的特性,⑵脱水性,3氧化性等内容,欢迎下载使用。
人教版 (新课标)必修1第四节 氨 硝酸 硫酸图文ppt课件: 这是一份人教版 (新课标)必修1第四节 氨 硝酸 硫酸图文ppt课件,共47页。PPT课件主要包含了氨的化学性质,2氨与酸的反应,现象产生大量白烟,思考与交流,氨的用途,制铵盐,制硝酸,制尿素,制冷剂,试剂及操作等内容,欢迎下载使用。
高中化学人教版 (新课标)必修1第四节 氨 硝酸 硫酸教案配套ppt课件: 这是一份高中化学人教版 (新课标)必修1第四节 氨 硝酸 硫酸教案配套ppt课件,共19页。PPT课件主要包含了常见酸的挥发性,具有酸的通性,硝酸的不稳定性,浓硝酸与铜的反应,固+液→气,还原剂,介绍玻尔爱国事迹,氧化性酸小结,易钝化物质小结,硝酸的用途等内容,欢迎下载使用。













