




高中化学人教版 (新课标)选修4 化学反应原理第三节 化学反应热的计算优质课件ppt
展开2、已知石墨的燃烧热:△H=-393.5kJ/ml(1)写出石墨的完全燃烧的热化学方程式(2)二氧化碳转化为石墨和氧气的热化学方程式
如何测定二氧化碳转化为石墨和氧气的反应热呢?
①能直接测定吗?②若不能直接测,怎么办?
C(石墨、s)+O2(g)=CO2(g);△H=-393.51kJ/ml
CO2(g)=C(石墨、s)+O2(g);△H=+393.51kJ/ml
【强调】正逆反应的反应热效应数值相等,符号相反。“+”、“-”不能省去。
第三节 化学反应热的计算
第一章 化学反应与能量
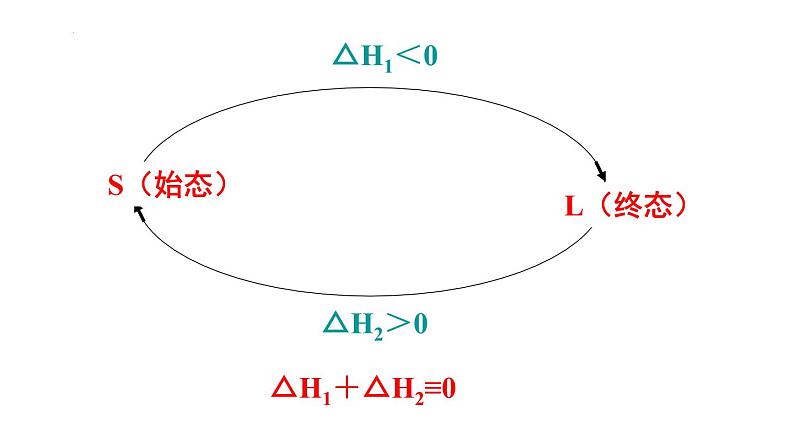
1、盖斯定律的内容 不管化学反应是一步完成或分几步完成,其反应热相同。换句话说,化学反应的反应热只与反应体系的始态和终态有关,而与反应的途径无关。
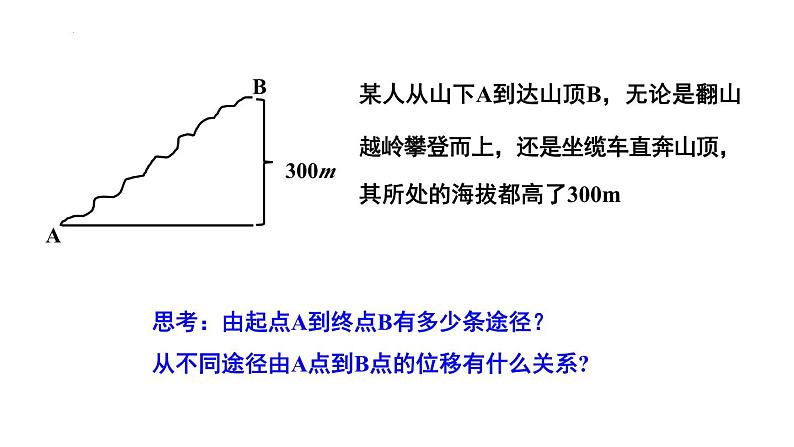
思考:由起点A到终点B有多少条途径?从不同途径由A点到B点的位移有什么关系?
某人从山下A到达山顶B,无论是翻山越岭攀登而上,还是坐缆车直奔山顶,其所处的海拔都高了300m
2、如何理解盖斯定律?
ΔH、ΔH1、ΔH2之间有何关系?
你的年轻,并不是你走弯路的资本
C(s)+1/2O2(g)=CO(g) △H1=?
CO(g)+1/2O2(g)=CO2(g) △H2=-283.0 kJ/ml
C(s)+O2(g)=CO2(g) △H3=-393.5 kJ/ml
∴△H1=△H3 - △H2 =-393.5 kJ/ml -(-283.0 kJ/ml)=-110.5 kJ/ml
出金刚石变成石墨的热化学方程式 (25℃,101kPa时), 燃烧热: ①C(石墨,s)+O2(g)=CO2(g) △H1=-393.5kJ/ml ②C(金刚石,s)+O2(g)=CO2(g) △H2=-395.0kJ/ml
②-①得:C(金刚石,s)=C(石墨,s) △H=-1.5kJ/ml
观察该热化学方程式,回答:金刚石能自动变成石墨吗?
不会,哪怕它们的能量相差不远。
【小试牛刀】某次发射火箭,用N2H4(肼)在NO2中燃烧,生成N2、液态H2O。已知: ① N2(g)+2O2(g)=2NO2(g) △H1=+67.2kJ/ml ② N2H4(g)+O2(g)=N2(g)+2H2O(l) △H2=-534kJ/ml 假如都在相同状态下,请写出发射火箭反应的热化学方程式。
2N2H4(g)+2NO2(g)=3N2(g)+4H2O(l) △H=-1135.2kJ/ml
①求总反应的反应热,不能不假思索地将各步反应的反应热简单相加。 ②不论一步进行还是分步进行,始态和终态完全一致,盖斯定律才成立。 ③某些物质只是在分步反应中暂时出现,最后应该恰好消耗完。
【自主归纳】 计算注意事项
有些化学反应进行很慢或不易直接发生,很难直接测得这些反应的反应热,可通过盖斯定律获得它们的反应热数据。
(1)“虚拟路径”法 若反应物A变为生成物D,可以有两个途径: ①由A直接变成D,反应热为ΔH; ②由A经过B变成C,再由C变成D,每步的反应热分别为ΔH1、 ΔH2、ΔH3。如图所示:则有 。
ΔH=ΔH1+ΔH2+ΔH3
(2)“加合”法 运用所给已知热化学方程式通过加减乘除的方法得到所求的热化学方程式。
先确定待求的反应方程式
找出待求方程式中各物质在已知方程式中的位置
根据待求方程式中各物质的计量数和位置对已知方程式进行处理,得到变形后的新方程式
将新得到的方程式进行加减(反应热也需要相应加减)
写出待求的热化学方程式
【小试牛刀】已知① CO(g)+1/2 O2(g)=CO2(g) ΔH1=-283.0 kJ/ml ② H2(g)+1/2 O2(g)=H2O(l) ΔH2=-285.8 kJ/ml ③C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l) ΔH3=-1370 kJ/ml 计算:④2CO(g)+4 H2(g)=H2O(l)+C2H5OH (l)的ΔH
【解】①×2+②×4-③=④ ΔH=ΔH1×2+ΔH2×4 -ΔH3 =-283.2×2 -285.8×4 +1370 =-339.2 kJ/ml
【再来一刀】1200℃时,天然气脱硫工艺中会发生下列反应 ①H2S(g)+3/2O2(g)=SO2(g)+H2O(g) △H1 ②2H2S(g)+SO2(g)=3/2S2(g)+2H2O(g) △H2 ③H2S(g)+1/2O2(g)=S(g)+H2O(g) △H3 ④2S(g)=S2(g) △H4 则△H4的正确表达式为( )A.△H4=2/3(△H1+△H2-3△H3)B.△H4=2/3(3△H3-△H1-△H2)C.△H4=3/2(△H1+△H2-3△H3)D.△H4=3/2(△H1-△H2-3△H3)
1. 已知一定量的物质参加反应放出的热量,写出其热化学反应方程式。2、有关反应热的计算(1)盖斯定律及其应用 (2)根据一定量的物质参加反应放出的热量(或根据已知的热化学方程式),进行有关反应热的计算或比较大小。(3)利用键能计算反应热
题型一:有关热化学反应方程式的的含义及书写
【小试牛刀】已知白磷和P4O6的分子结构如图所示,现提供以下化学键的键能(kJ•ml-1):P-P:198 ;P-O:360 ;O=O:498,则反应:P4(白磷)+3O2=P4O6 的反应热△H为( )
A.-1638 kJ•ml-1 B.+1638 kJ•ml-1C.-126 kJ•ml-1 D.+126 kJ•ml-1
题型二:燃烧热、中和热的判断、求算及测量
【解】钠与氯气起反应的化学方程式如下: Na(s)+1/2Cl2(g)=NaCl (s) 23g/ml △H 1.0g 17.87kJ
△H=23g/ml×(-17.87kJ)÷ 1.0g=-411kJ/ml
【解】设1kg乙醇燃烧后放出的热量为 X C2H6O(l)+3O2(g)=2CO2(g)+3H2O (l) △H=-1366.8kJ/ml 46g/ml -1366.8kJ/ml 1000g x
x=(-1366.8kJ/ml × 1000g)/ 46g/ml=-29710kJ
1、已知:C(s)+O2(g)=CO2(g) ; △H=-393.5kJ/ml H2O(g)+1/2O2(g)=H2O(l); △H=-241.8kJ/ml 欲得到相同的热量,需分别燃烧固体碳和氢气的质量比约为( ) A. 2:3.25 B. 12:3.25 C. 1:1 D. 393.5:241.8
2、已知胆矾溶于水时溶液温度降低,胆矾分解的热化学方程式为:CuSO4•5H2O(s)=CuSO4(s)+5H2O(l) △H=+Q1kJ/ml 室温下,若将1ml无水硫酸铜溶解为溶液时放热Q2kJ,则( ) A.Q1>Q2 B.Q1=Q2 C. Q1<Q2 D.无法确定
3、酸性氧化物和碱反应生成酸式盐的反应很难直接测其反应热。已知常温常压下,将22 g CO2通入750 mL 1 ml·L-1 NaOH溶液中充分反应,测得反应放出x kJ的热量。已知在该条件下,1 ml CO2通入1 L 2ml·L-1的NaOH溶液中充分反应放出y kJ热量,则CO2与NaOH溶液反应生成NaHCO3的热化学方程式为( ) A.CO2(g)+NaOH(aq)===NaHCO3(aq) ΔH=-(2y-x)kJ·ml-1 B.CO2(g)+NaOH(aq)===NaHCO3(aq) ΔH=-(2x-y)kJ·ml-1 C.CO2(g)+NaOH(aq)===NaHCO3(aq) ΔH=-(4x-y)kJ·ml-1 D.2CO2(g)+2NaOH(l)===2NaHCO3(l) ΔH=-(8x-2y)kJ·ml-1
4、磷在氧气中燃烧,可能生成两种固态氧化物。3.1g单质磷(P)在3.2g氧气中燃烧,至反应物耗尽,并放出XkJ热量。(1)通过计算确定反应产物的组成是(用化学式表示)______________,其相应的质量(g)为___________________。(2)已知单质磷的燃烧热为,则与O2反应生成固态的反应热____________________。(3)写出反应生成固态的热化学方程式: ______________________________________________________。
P(s)+3/4O2(g)=1/2P2O3(s) △H=-(20X-Y)kJ/ml
2.75g、3.55g
-(20X-Y)kJ/ml
化学选修4 化学反应原理第一章 化学反应与能量第三节 化学反应热的计算课文配套课件ppt: 这是一份化学选修4 化学反应原理第一章 化学反应与能量第三节 化学反应热的计算课文配套课件ppt,共24页。PPT课件主要包含了探究一,探究二等内容,欢迎下载使用。
人教版 (新课标)选修4 化学反应原理第三节 电解池课文课件ppt: 这是一份人教版 (新课标)选修4 化学反应原理第三节 电解池课文课件ppt,共32页。PPT课件主要包含了第1课时电解原理,探究一,探究二等内容,欢迎下载使用。
选修4 化学反应原理第三节 化学反应热的计算评课课件ppt: 这是一份选修4 化学反应原理第三节 化学反应热的计算评课课件ppt,共9页。













