




所属成套资源:人教版(新课标)化学选修4化学反应原理PPT课件+课后练习+章末测试全册
- 人教版 (新课标)选修4 化学反应原理 3.2水的电离和溶液的酸碱性(第3课时 酸碱中和滴定(一)) 课后练习 课件 0 次下载
- 人教版 (新课标)选修4 化学反应原理 3.2 水的电离和溶液的酸碱性(第2课时 溶液的酸碱性与pH) 课后练习 课件 0 次下载
- 人教版 (新课标)选修4 化学反应原理 3.3 盐类的水解(第1课时 盐溶液的酸碱性和盐类的水解) 课件 课件 0 次下载
- 人教版 (新课标)选修4 化学反应原理 3.3 盐类的水解(第1课时 盐溶液的酸碱性和盐类的水解)(课后精炼) 试卷 0 次下载
- 人教版 (新课标)选修4 化学反应原理 3.3 盐类的水解(第2课时 盐类的水解的影响因素和应用) 课后练习 课件 1 次下载
高中人教版 (新课标)第二节 水的电离和溶液的酸碱性精品ppt课件
展开
这是一份高中人教版 (新课标)第二节 水的电离和溶液的酸碱性精品ppt课件,共23页。PPT课件主要包含了组织建设,溶液的pH值,1两种强酸混合,2两种强碱混合,②酸过量酸性,③碱过量碱性,约为7,<pH<5,<pH<12,a+b=14等内容,欢迎下载使用。
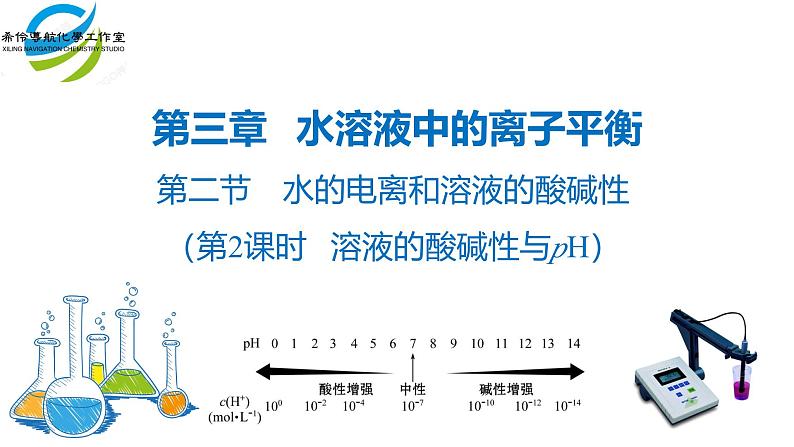
第二节 水的电离和溶液的酸碱性(第2课时 溶液的酸碱性与pH)
第三章 水溶液中的离子平衡
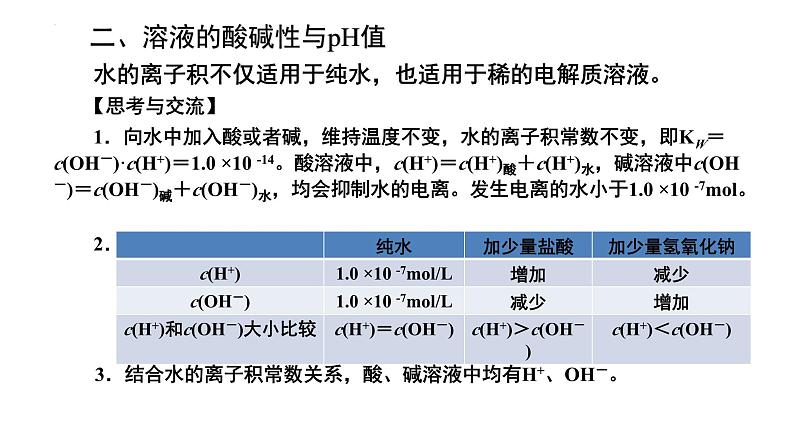
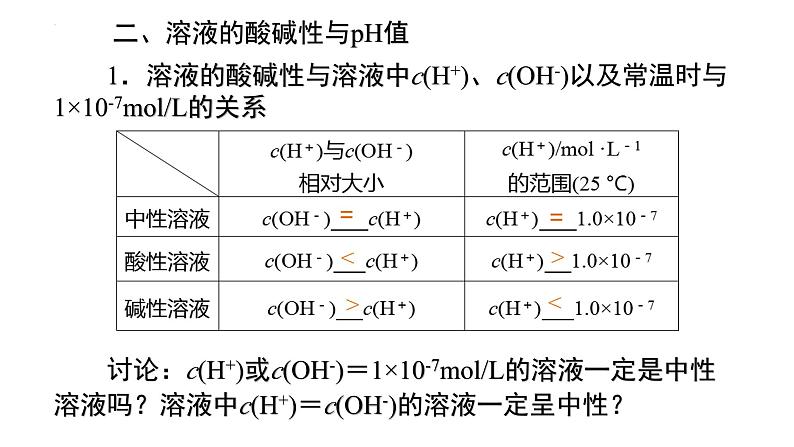
二、溶液的酸碱性与pH值
水的离子积不仅适用于纯水,也适用于稀的电解质溶液。
1.向水中加入酸或者碱,维持温度不变,水的离子积常数不变,即KW=c(OH-)·c(H+)=1.0 ×10 -14。酸溶液中,c(H+)=c(H+)酸+c(H+)水,碱溶液中c(OH-)=c(OH-)碱+c(OH-)水,均会抑制水的电离。发生电离的水小于1.0 ×10 -7ml。
3.结合水的离子积常数关系,酸、碱溶液中均有H+、OH-。
1.溶液的酸碱性与溶液中c(H+)、c(OH-)以及常温时与1×10-7ml/L的关系
讨论:c(H+)或c(OH-)=1×10-7ml/L的溶液一定是中性溶液吗?溶液中c(H+)=c(OH-)的溶液一定呈中性?
(1)定义:化学上常采用H+的物质的量浓度的负对数来表示溶液的酸碱性。
(3)溶液的酸碱性与pH值的关系
常温下:酸性溶液:c(H+)>c(OH-) pH<7 中性溶液:c(H+)= c(OH-) pH=7 碱性溶液:c(H+)<c(OH-) pH>7
(2)表示方法:pH=-lg c(H+)
(4)溶液的pH值越小,c(H+)越大,c(OH-)就越小,溶液的酸性就越强;溶液的pH值越大,c(OH-)越大,c(H+)就越小,溶液的碱性就越强。
注意:pH=0并非没有H+,而是c(H+)=1ml/L,pH=14并非无OH-,而是c(OH-)=1ml/L
讨论:pH=7的溶液一定呈中性?
100℃中性溶液的pH=6
(5)pH的适用范围:0~14。 即c(H+)<1ml/L或c(OH-)<1ml/L。当c(H+)>1ml/L或c(H-)>1ml/L时直接用c(H+)或c(OH-)表示。
(6)溶液pH的测定方法:
①酸碱指示剂法(只能测定溶液的pH范围)。常见酸碱指示剂的变色范围:
②利用pH试纸测定。使用的正确操作为取一小块pH试纸于干燥洁净的玻璃片或表面皿上,用干燥洁净的玻璃棒蘸取试液点在试纸上,当试纸颜色变化稳定后迅速与标准比色卡对照,读出pH。用pH试纸测定试液的pH,读数只能为取整数。
【注意】1.pOH:采用OH-的物质的量浓度的负对数来表示溶液的酸碱性,pOH=-lgc(OH-) 且常温时:pOH+pH=14。 2.溶液的酸碱性用pH与7的大小关系来判断,必须是常温;而用c(H+)、c(OH-)的相对大小来判断溶液酸碱性,则不受温度影响。
③利用pH计测定。仪器pH计可精确测定试液的pH(读至小数点后2位)。
D.对水升高温度,c(H+)增大,酸性增强
B.如果c(H+)不等于c(OH-)则溶液一定呈现酸碱性
C.如果c(H+)/ c(OH-)的值越大则酸性越强
A.在任何条件下,纯水都呈中性
【小试牛刀】判断正误:
【再来一刀】一定温度下,满足下列条件的溶液一定呈酸性的是 ( )A.pH=6的某物质的水溶液B.加酚酞后显无色的溶液C.能与金属Al反应放出H2的溶液D.c(H+)>c(OH-)的任意物质的水溶液
三、有关溶液pH的计算
pH=-lgc(H+)
pOH=-lgc(OH-)
c(H+)=1×10-14/c(OH-)
总结:显什么性,找什么离子(显性)(浓度),算什么值。
1.单一溶液的pH计算
【例题1】常温下,求0.0005ml/L的H2SO4溶液、Ba(OH)2溶液的pH?100℃时0.0005ml/L的H2SO4溶液、Ba(OH)2溶液的pH?
3 11 3 9
2.酸碱溶液混合的pH计算
【例题2】常温下,求100mL0.005ml/L的H2SO4溶液与100mL 0.01ml/L的HCl溶液的混合溶液的pH?
【小试牛刀】常温下,求pH=3的H2SO4溶液与pH=5的HCl溶液的等体积混合,溶液的pH?(已知lg5=0.7)
【温馨提示】已知pH值,则c(H+)=10-pH,c(OH-)=10-14+pH或c(OH-)=10-pOH(常温)
【例题3】常温下,求100mL0.005ml/L的Ba(OH)2溶液与100mL 0.01ml/L的NaOH溶液的混合溶液的pH?
【小试牛刀】常温下,求pH=10的Ba(OH)2溶液与pH=12的NaOH溶液的等体积混合,溶液的pH?(已知lg5=0.7)
【温馨提示】碱溶液混合不能直接计算c(H+),而应直接计算c(OH-)
(3)强酸与强碱混合 先判断反应后溶液的酸碱性,再进行计算.
①恰好完全反应:中性,pH=7。此时c(H+)V酸=c(OH-)V碱
【例题4】0.1L pH=2盐酸和0.1L pH=11的NaOH溶液相混合,求混合后溶液的pH值?(已知lg5=0.7)
【小试牛刀】pH=2盐酸和pH=12的Ba(OH)2溶液等体积相混合,求混合后溶液的pH值?
【再来一刀】pH=3盐酸和pH=12的Ba(OH)2溶液等体积相混合,求混合后溶液的pH值?(已知lg5=0.7)
3.酸碱溶液稀释后的pH
【例题5】0.001 ml/L盐酸的pH=____,加水稀释到原来的10倍,pH=___,加水到原来的103倍,pH=___,加水到原来的104 倍pH= _____,加水到原来的106倍,pH=______
【小试牛刀】pH=12的NaOH溶液加水稀释到原来的103倍,则溶液的pH=__,pH=10的NaOH溶液加水稀释到原来的105倍,则溶液的pH=___
【再来一刀】pH=3的HAc溶液加水稀释到原来102倍,溶液的pH值范围 ;pH=12氨水加水稀释到原来103倍,溶液的pH值范围_ _______。
【规律】 (1)pH=a的强酸稀释至10n倍,溶液的pH增加n个单位,即pH稀=a+n;无限稀释,pH接近7(不能等于大于7) (2)pH=b的强碱稀释至10n倍,溶液的pH减少n个单位,即pH稀=b-n;无限稀释,pH接近7(不能等于小于7) (3)pH=a的弱酸稀释至10n倍,溶液的pH增加小于n个单位,即:a<pH稀<a+n;无限稀释,pH接近7(不能等于大于7) (4)pH=b的弱碱稀释至10n倍,溶液的pH减少小于n个单位,即:b-n<pH稀<b;无限稀释,pH接近7(不能等于小于7)
1.pH=2的A、B两种酸溶液各1 mL,分别加水稀释到1000 mL,其中pH与溶液体积V的关系如图所示,下列说法正确的是( ) A.A、B两酸溶液的物质的量浓度一定相等 B.稀释后,A酸溶液的酸性比B酸溶液强 C.a=5时,A是强酸,B是弱酸 D.一定有关系:5>a>2
2.常温下一种pH为2 的酸溶液与一种pH为12 的碱溶液等体积相混合,对溶液的酸碱性的说法正确的是( ) A.若是二元强酸和一元强碱,混合液为酸性 B.若是浓的强酸和稀的强碱,混合液中呈酸性 C.若是浓的弱酸和稀的强碱,混合液呈碱性 D.若是强酸和强碱相混合,溶液反应后呈中性
3.(双选)同体积的pH为3的盐酸、硫酸、醋酸和硝酸四种溶液,分别加入足量的锌粉,叙述正确的是( ) A.硫酸溶液中放出的氢气的量最多 B.醋酸溶液中放出的氢气的量最多 C.盐酸和硝酸中放出的氢气的量相等 D.盐酸比硝酸放出的氢气的量多
5.pH=13的Ba(OH)2溶液与pH=2的HCl溶液混合,所得溶液的pH=11,求Ba(OH)2溶液与HCl溶液的体积比?
4.向体积均是1L,pH值也相等的盐酸和醋酸两溶液中加入表面积、质量均相等的锌块,下列叙述不正确的是( ) A.反应开始时,盐酸的速率比醋酸快 B.反应过程中,醋酸的速率比盐酸快 C.充分反应后,两者产生的氢气的体积可能相等 D.充分反应后,若有一种溶液中的锌有多余,则一定是盐酸的锌有余
6.已知水在25 ℃和95 ℃时,其电离平衡曲线如下图所示:(1)则25 ℃时水的电离平衡曲线应为 ,(填“A”或“B”)请说明理由 。 (2)25 ℃时,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则NaOH溶液与H2SO4溶液的体积比为 。 (3)95℃时,若100体积pH1=a的某强酸溶液与1体积pH2=b的某强碱溶液混合后溶液呈中性,则混合前,该强酸的pH1与强碱的pH2之间应满足的关系是 。 (4)曲线B对应温度下,pH=2的某HA溶液和pH=10的NaOH溶液等体积混合后,混合溶液的pH=5。请分析原因: 。
KWB>KWA,水的电离是吸热过程,降低温度,平衡逆向移动,c(H+)、c(OH-)减小.KW减小
曲线B对应95℃,水的离子积为1×10-12,pH=2的HA溶液和pH=10NaOH溶液等体积混合后的pH=5显酸性,说明HA是弱酸,H+与OH-恰好反应后,HA有余而使溶液显酸性。
相关课件
这是一份人教版 (新课标)选修4 化学反应原理第三章 水溶液中的离子平衡第二节 水的电离和溶液的酸碱性一等奖课件ppt,共23页。PPT课件主要包含了组织建设,无影响,滴定管读数正误对比,读数误差,无法判断舍去,容量瓶,cV200ρ,十酸碱滴定突跃,滴定曲线等内容,欢迎下载使用。
这是一份人教版 (新课标)选修4 化学反应原理第二节 水的电离和溶液的酸碱性优质课ppt课件,共16页。PPT课件主要包含了水的电离,K电离=等内容,欢迎下载使用。
这是一份2020-2021学年第二节 水的电离和溶液的酸碱性备课课件ppt,共33页。PPT课件主要包含了探究一,探究二等内容,欢迎下载使用。










