





所属成套资源:2024-2025鲁科版化学选择性必修1PPT课件全册
高中化学鲁科版 (2019)选择性必修1第4节 金属的腐蚀与防护试讲课ppt课件
展开
这是一份高中化学鲁科版 (2019)选择性必修1第4节 金属的腐蚀与防护试讲课ppt课件,共20页。PPT课件主要包含了金属的电化学腐蚀,总结归纳,金属的防护,交流与讨论,课堂练习等内容,欢迎下载使用。
自主探究: [阅读教材P30,回答] 1、什么是金属的腐蚀?特点是什么? 2、金属的腐蚀可分为哪几类?
a. 化学腐蚀b.电化学腐蚀
本质:金属原子失去电子被氧化的过程。
金属腐蚀
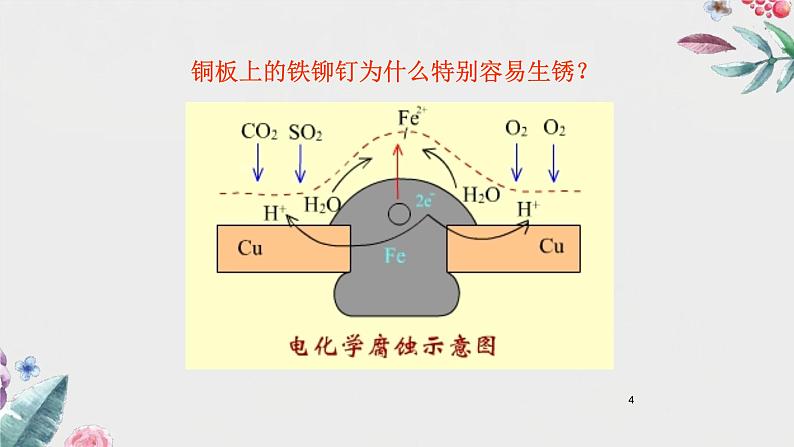
铜板上的铁铆钉为什么特别容易生锈?
1、吸氧腐蚀(弱酸性或中性或碱性水溶液)
负极:2Fe - 4e =2Fe2+
正极:O2 + 2H2O + 4e = 4OH-
总反应:2Fe+2H2O+O2= 2 Fe(OH)2
后续反应:4Fe(OH)2+2H2O+O2=4Fe(OH)3
2、析氢腐蚀(酸性水溶液)
负极:Fe - 2e - = Fe2+
总反应:Fe + 2H+ = Fe2+ + H2↑
正极:2H+ + 2e- = H2↑
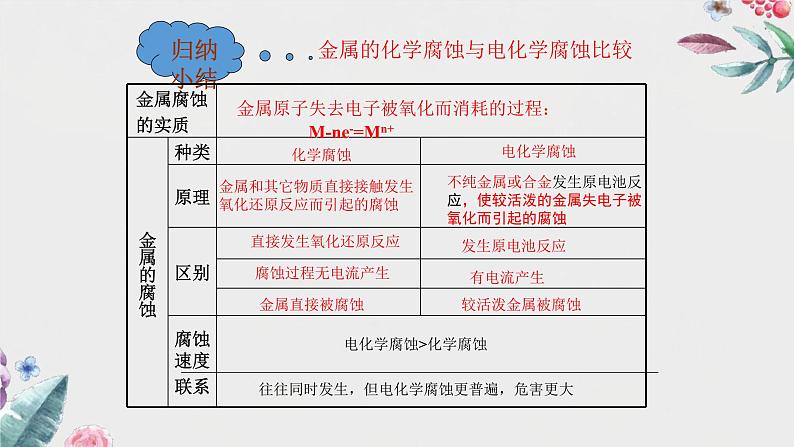
金属的化学腐蚀与电化学腐蚀比较
金属原子失去电子被氧化而消耗的过程: M-ne-=Mn+
金属和其它物质直接接触发生氧化还原反应而引起的腐蚀
不纯金属或合金发生原电池反应,使较活泼的金属失电子被氧化而引起的腐蚀
往往同时发生,但电化学腐蚀更普遍,危害更大
铁生锈除了必须有空气及水的参与外,还受其他一些因素的影响.请解释下列有关铁生锈现象的原因.
1.相对于在内河行驶的轮船来说,海轮更容易被腐蚀.
海轮更容易被腐蚀,是因为海水中含有较多的氯化钠等盐类,导电能力比内河的水更强,而在电解质溶液中,电化学腐蚀更易进行.
2.用于连接铜板的铁螺丝容易生锈.
由于铁与铜及空气中的水蒸气构成了原电池,铁作电池的负极,因此更容易腐蚀而生锈.
1.改变金属的内部组织结构例如制造各种耐腐蚀的合金,如在普通钢铁中加入铬、镍等制成不锈钢。
2.保护层法:在金属表面覆盖保护层,使金属制品与周围腐蚀介质隔离,从而防止腐蚀。
在钢铁制件表面涂上机油、凡士林、油漆或覆盖搪瓷、塑料等耐腐蚀的非金属材料。
3)、电化学 保护法
外加电流的阴极保护法——电解原理
牺牲阳极的阴极保护法——原电池原理
比被保护金属活泼的金属
金属腐蚀中产生的能量及物质可否科学地进行应用?
三、电化学腐蚀原理的利用
某品牌保暖贴的使用说明。请仔细研读说明书,思考并尝试回答下列问题。品名:一次性保暖贴主要成分:铁粉、水、食盐、活性炭、蛭石、吸水性树脂产品性能:平均温度为55℃,最高混度为63℃。发热时间在12小时以上 使用说明:使用时将外包装贷撕开,取出内袋,将保护衬纸揭下,贴在需要取 暖或热敷部位的内衣外侧;使用完后,从衣服上撕下即可【严禁直接接触皮肤】
任务一:探究保暖贴的发热原理
1.保暖贴在发热过程中,其主要成分分别起什么作用?2.为什么保暖贴能较持久而又稳定地提供热量?3.保暖贴使用的是双层白装。外层由不透气的明胶层制成,内层由微孔透气膜制成,为什么要这样设计?4.为什么保暖贴使用后会变得较硬?
主要成分:铁粉、水、食盐、活性炭、蛭石、吸水性树脂
任务二:金属腐蚀产生的热量可以被合理利用,其物质变化如何应用?
1.保暖贴在发热过程中,负极产物是什么?如何验证?有何性质?2.金属腐蚀正极反应如何?正极反应如何利用?
正极:O2 + 2H2O + 4e = 4OH-(碱性或中性条件)
2H+ + 2e- = H2↑(酸性条件)
思考:使用后的保暖贴如何加以应用?(查阅资料)
1.关于下图所示装置的判断,叙述正确的是( )
2.取一张用饱和NaCl溶液浸湿的pH试纸,两根铅笔芯作电极,接通直流电源,一段时间后,发现a电极与试纸接触处出现一个双色同心圆,内圆为白色,外圈呈浅红色。则下列说法错误的是( )A.b电极是阴极 B.a电极与电源的正极相连接C.电解过程中,水是氧化剂 D.b电极附近溶液的pH变小
A.左边的装置是电解池,右边的装置是原电池 B.该装置中铜为正极,锌为负极C.当铜片的质量变化为12.8 g时,a极上消耗 的O2在标准状况下的体积为2.24 LD.装置中电子的流向是:a→Cu→经过CuSO4溶液→Zn→b
3、下列现象与电化学腐蚀无关的是:( )A.黄铜(铜锌合金)制作的铜锣不易产生铜绿B.生铁比纯铁更易生锈C.铁质器件附有铜质配件,在接触处易生锈D银质奖牌久置表面变暗
4.铁钉和碳棒用导线连接后,浸入到食盐溶液中,可能发生的反应是: ( )A.碳棒上放出Cl2 B.碳棒附近产生OH-C.碳棒上放出H2 D.铁钉被氧化
5:如图, 水槽中试管内有一枚铁钉,放置数天观察:
(1)若液面上升,则溶液呈________性,发生_______腐蚀,电极反应式为:负极:_____________________,正极:______________________;
(2)若液面下降,则溶液呈______性,发生_________腐蚀,电极反应式为:负极:______________________ 正极:______________________。
2Fe – 4e-=2Fe2+
O2+2H2O+4e-=4OH-
Fe –2e-=Fe2+
2H++2e-=H2↑
6.下列各情况,在其中Fe片腐蚀由快到慢的顺序是
小结:在同一电解质溶液中,金属腐蚀的快慢规律如下:电解原理引起的腐蚀>原电池原理引起的腐蚀>化学腐蚀>有防腐措施的腐蚀 防腐措施由好到坏的顺序如下:外接电源的阴极保护法>牺牲负极保护法>有一般防腐条件保护>无防腐条件
相关课件
这是一份高中化学鲁科版 (2019)选择性必修1第1章 化学反应与能量转化第4节 金属的腐蚀与防护教学ppt课件,共26页。PPT课件主要包含了金属的腐蚀,M-ne-→Mn+,1化学腐蚀,2电化学腐蚀,正极反应物,总反应,FeOH3,金属的防护,在金属表面覆盖保护层,白铁皮镀锌铁等内容,欢迎下载使用。
这是一份化学第四章 化学反应与电能第三节 金属的腐蚀与防护试讲课课件ppt,文件包含新人教版化学选择性必修一43金属的腐蚀与防护课件pptx、新人教版化学选择性必修一43金属的腐蚀与防护针对练习含解析docx、新人教版化学选择性必修一43金属的腐蚀与防护教案doc等3份课件配套教学资源,其中PPT共25页, 欢迎下载使用。
这是一份高中化学苏教版 (2019)选择性必修1专题1 化学反应与能量第三单元 金属的腐蚀与防护说课课件ppt,共53页。PPT课件主要包含了学习目标,核心素养,新课导入,活动探究,思考交流,知识梳理,名师点拨,巩固练习,吸收水蒸气,3电化学防护法等内容,欢迎下载使用。










