



所属成套资源:2024-2025鲁科版化学选择性必修1PPT课件全册
化学选择性必修1第2节 化学反应的限度完美版ppt课件
展开
这是一份化学选择性必修1第2节 化学反应的限度完美版ppt课件,文件包含22化学反应的限度第4课时压强对化学平衡的影响2019鲁科版选修1化学反应原理pptx、压强对化学平衡的影响mp4等2份课件配套教学资源,其中PPT共19页, 欢迎下载使用。
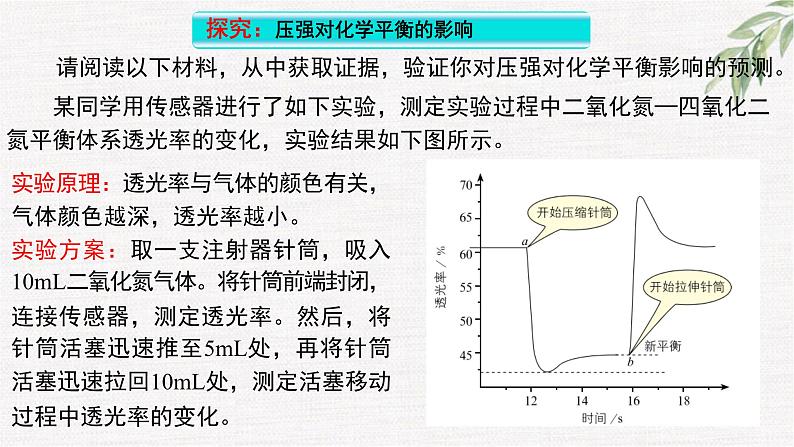
请阅读以下材料,从中获取证据,验证你对压强对化学平衡影响的预测。
某同学用传感器进行了如下实验,测定实验过程中二氧化氮—四氧化二氮平衡体系透光率的变化,实验结果如下图所示。
实验原理:透光率与气体的颜色有关,气体颜色越深,透光率越小。实验方案:取一支注射器针筒,吸入10mL二氧化氮气体。将针筒前端封闭,连接传感器,测定透光率。然后,将针筒活塞迅速推至5mL处,再将针筒活塞迅速拉回10mL处,测定活塞移动过程中透光率的变化。
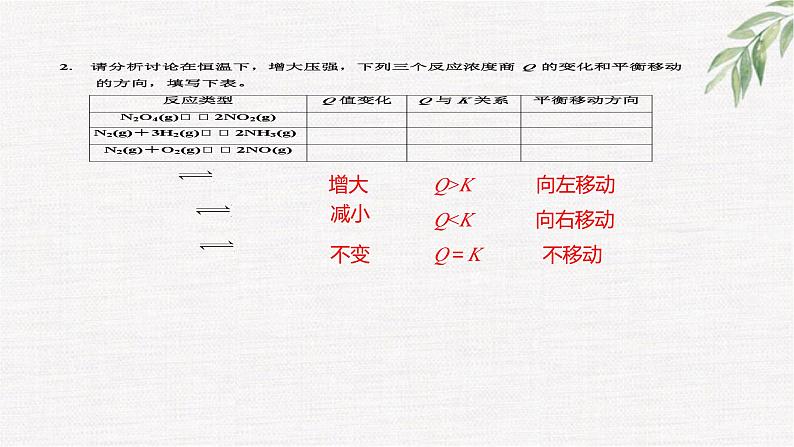
1 按表中实验要求完成实验,将有关实验现象及其结论填入表中。
气体颜色先变深,后变浅,最终比原来深
气体颜色先变浅,后变深,最终比原来浅
压强增大,体积减小时,c(NO2)变大后又减小,平衡向左移动
压强减小,体积增大时,c(NO2)减小后又增大,平衡向右移动
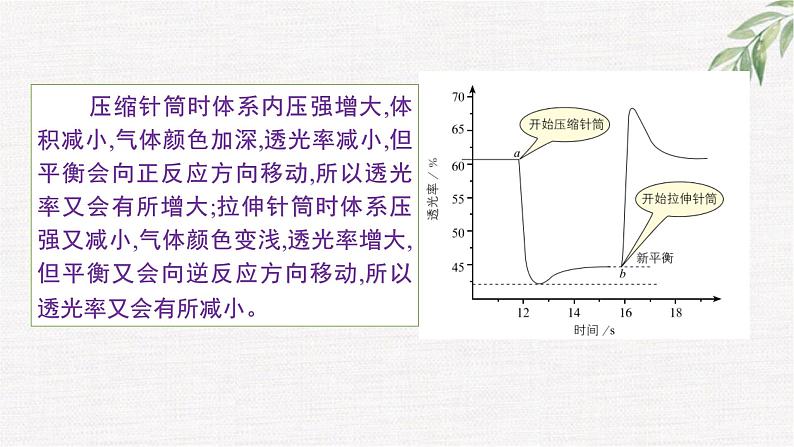
压缩针筒时体系内压强增大,体积减小,气体颜色加深,透光率减小,但平衡会向正反应方向移动,所以透光率又会有所增大;拉伸针筒时体系压强又减小,气体颜色变浅,透光率增大,但平衡又会向逆反应方向移动,所以透光率又会有所减小。
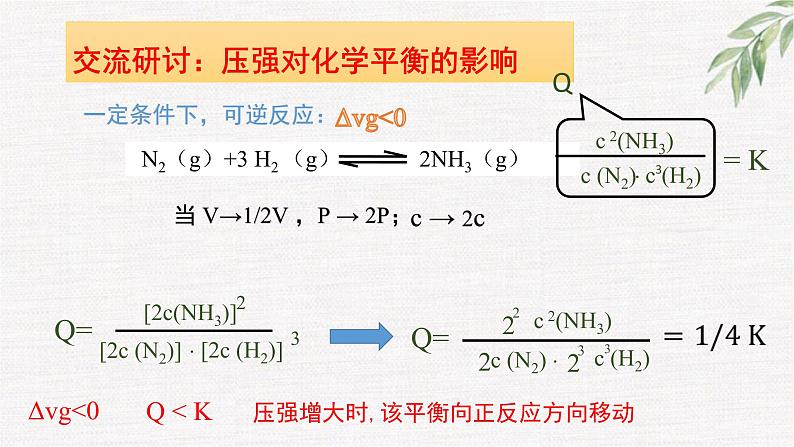
交流研讨:压强对化学平衡的影响
一定条件下,可逆反应:
N2(g)+3 H2 (g) 2NH3(g)
压强增大时,该平衡向正反应方向移动
H2 (g)+ I2(g) 2HI(g)
Q = K, 压强增大,平衡不移动
N2O(g) 2NO2(g)
压强增大时,此反应向逆反应方向移动
压强对化学平衡移动的影响
在其他条件不变的情况下,压强对化学平衡的影响:
注意:对于只涉及固体或液体的反应,压强对平衡体系的影响极其微弱,可以不予考虑。
如果改变影响平衡的条件之一,平衡将向着能够减弱这种改变的方向移动。
(2)定量角度:“减弱”不等于“消除”,更不是“扭转”。
1.勒·夏特列原理仅适用于已达到平衡的反应体系,对不可逆过程或未达 到平衡的可逆过程均不能使用。此外勒·夏特列原理对所有的动态平衡 (如溶解平衡、电离平衡、水解平衡等)都适用。
2.对“减弱这种改变”的正确理解
(1)定性角度:用于判断平衡移动的方向。
升高温度,平衡向吸热方向移动
催化剂不能使化学平衡发生移动
降低温度,平衡向放热方向移动
由于[H2O]、[CO]、[H2]的浓度都不变,所以平衡不移动
浓度为常数,改变它的量平衡不移动
压强增大,平衡左移;
配制FeSO4溶液时,加入铁粉是为了防止Fe2+被氧化。
5.对于反应: ,下列说法正确的是( )
A. 该反应在高温条件下才能自发进行 B. 增大M的浓度,反应速率加快,平移常数Ka也增大
C. 升高温度,在平衡移动过程中,v逆大于v正 D. 增大压强,平衡向正反应方向移动
Vx2/n(1-x)3
(3)该反应的逆反应速率与时间的关系如图所示。
①由图可知,反应在t1、t3、t7时都达到了平衡,而t2、t8时都改变了一种条件,试判断改变的条件:t2时 ;t8时________。②t2时平衡向________(填“正反应”或“逆反应”)方向移动。
相关课件
这是一份高中化学鲁科版 (2019)选择性必修1第2章 化学反应的方向、 限度与速率第2节 化学反应的限度评优课ppt课件,文件包含22化学反应的限度第3课时浓度温度对化学平衡的影响2019鲁科版选修1化学反应原理pptx、浓度对化学平衡的影响mp4、温度对化学平衡的影响mp4等3份课件配套教学资源,其中PPT共18页, 欢迎下载使用。
这是一份高中鲁科版 (2019)第2节 化学反应的限度优秀ppt课件,共16页。PPT课件主要包含了温故知新,方法导引,三段式法,归纳总结,课堂练习等内容,欢迎下载使用。
这是一份鲁科版 (2019)选择性必修1第2节 化学反应的限度完美版课件ppt,共17页。PPT课件主要包含了温故知新,v正=v逆≠0,联想•质疑,交流•研讨,相同是个常数,学习探究,化学平衡常数,交流•讨论,互为倒数单位不同,夯实基础等内容,欢迎下载使用。










