




化学选择性必修1第3节 化学反应的速率精品ppt课件
展开氢气和氧气反应的化学平衡常数的数量级高达1083,但常温、常压下几千年都不反应,点燃时却在瞬间完成
化学反应为何什么会有快有慢?化学反应如何进行的?怎样定量地表示化学反应的速率?反应条件怎样影响化学反应速率的?
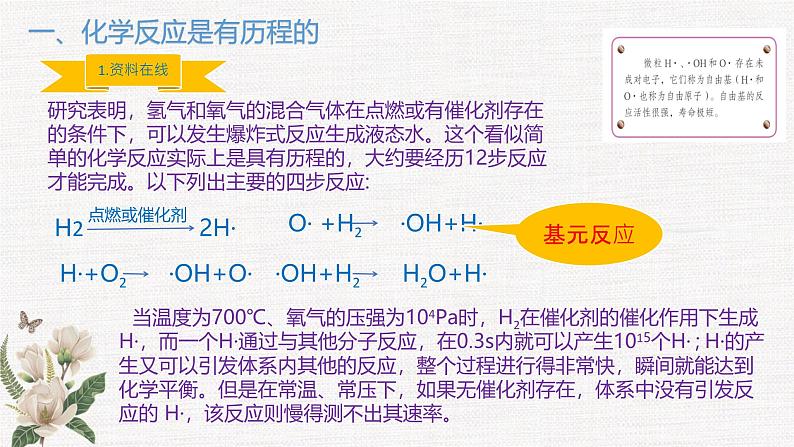
一、化学反应是有历程的
研究表明,氢气和氧气的混合气体在点燃或有催化剂存在的条件下,可以发生爆炸式反应生成液态水。这个看似简单的化学反应实际上是具有历程的,大约要经历12步反应才能完成。以下列出主要的四步反应:
当温度为700℃、氧气的压强为104Pa时,H2在催化剂的催化作用下生成H·,而一个H·通过与其他分子反应,在0.3s内就可以产生1015个H· ; H·的产生又可以引发体系内其他的反应,整个过程进行得非常快,瞬间就能达到化学平衡。但是在常温、常压下,如果无催化剂存在,体系中没有引发反应的 H·,该反应则慢得测不出其速率。
反应物的结构和反应条件
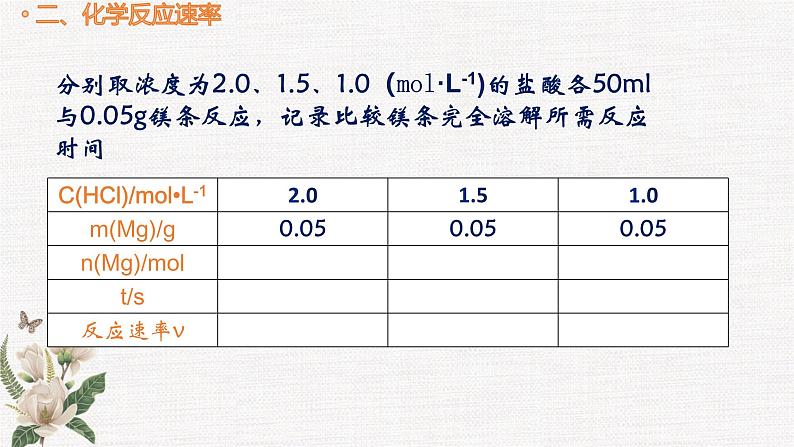
分别取浓度为2.0、1.5、1.0(ml·L-1)的盐酸各50ml与0.05g镁条反应,记录比较镁条完全溶解所需反应时间
思考二若用单位时间内盐酸浓度的减小或氯化镁浓度的增大来表示该化学反应的速率,需要哪些数据呢?二者在数值上相等吗?为什么?
思考一实验中化学反应速率可用哪些方法表示?
单位时间内盐酸溶液或氯化镁的浓度变化
单位时间内镁的质量变化
单位时间内镁的物质的量的变化
需要准确量取盐酸的体积,并利用关系式计算出反应中消耗的氯化氢或生成的氯化镁的物质的量
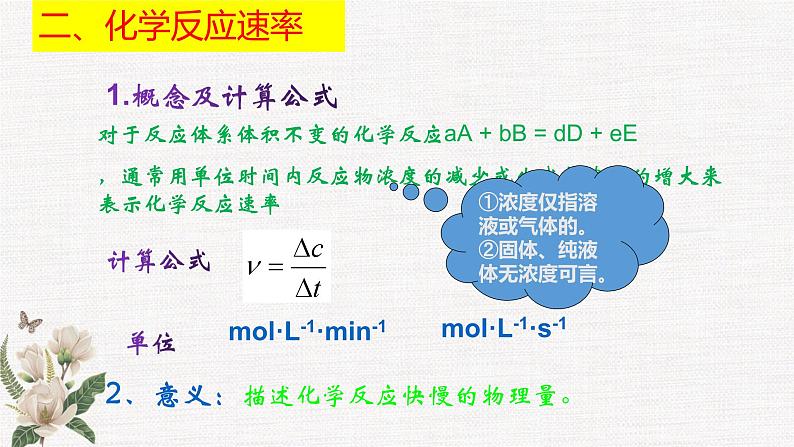
对于反应体系体积不变的化学反应aA + bB = dD + eE,通常用单位时间内反应物浓度的减少或生成物浓度的增大来表示化学反应速率
ml·L-1·min-1
2、意义:描述化学反应快慢的物理量。
①浓度仅指溶液或气体的。②固体、纯液体无浓度可言。
①反应速率实际上是某段时间间隔内的平均反应速率。时间间隔越短,在这段时间发生的浓度变化越接近瞬时反应速率(指在某一瞬间的反应速率);②对某一具体化学反应来说,在用不同物质表示化学反应速率时所得数值往往不同。用各物质表示的化学反应速率的数值之比等于化学方程式中各物质的系数之比。
为了统一起见,将化学反应速率定义为:
化学反应速率的物理测定法:量气法、比色法、电导法
解: N2 + 3H2
起始量(ml): 1 3 02s末量(ml): 1-0.2 3-0.6 0.4变化量(ml): 0.2 0.6 0.4
在应用化学方程式进行有关化学反应速率的计算时,一定弄清三个量:起始浓度(或起始量)、变化浓度(或变化量)、某时刻后的浓度(或某时刻后的量),其中:变化量之比等于化学计量数之比。
化学反应速率之比等于它们的计量数之比。
有:V(N2) :V(H2) :V(NH3) = 1:3:2
(2).某一反应2A+B=2C,开始时A的浓度为4 ml· L-1,2min后测得A的浓度为3 ml ·L-1,请分别用A、B、C的浓度变化来表示该反应的速率:V(A)= ,V(B)= ,V(C)= 。
0.5 ml.L-1.min-1
0.25 ml.L-1.min-1
1.某一反应物的浓度是 2.0 ml·L-1,经过4 min后,它的浓度变成1.68 ml·L-1,则在这4 min内它的平均反应速率为 ( )A. 0.2 ml·L-1·min-1 B. 0.1 ml·L-1·min-1C. 0.04 ml·L-1·min-1 D. 0.08 ml·L-1·min-1
2. 已知反应A+3B=2C+D在某段时间内以A的浓度变化表示的化学反应速率为 1 ml·L-1·min-1,则此段时间内以C的浓度变化表示的化学反应速率为 ( )A.0.5 ml·L-1·min-1 B.1 ml·L-1·min-1 C.2 ml·L-1·min-1 D.3 ml·L-1·min-1
3、如图所示,图中a曲线表示X(g) +Y(g) 2Z(g)+ W(s)+ Q的反应过程,若使a曲线变为b曲线,可采取的措施是( )
A. 加入催化剂B. 增大Y的浓度C. 降低温度D. 增大体系压强
4、某温度时,在2L容器中,X、Y、Z三种物质的变化曲线如图所示
(1)由图中数据分析该反应的化学方程式:
(2)反应开始至2min,Z的平均反应速率:
3X+Y 2Z
高中化学鲁科版 (2019)选择性必修1第3节 化学反应的速率优秀ppt课件: 这是一份高中化学鲁科版 (2019)选择性必修1<a href="/hx/tb_c4002582_t3/?tag_id=26" target="_blank">第3节 化学反应的速率优秀ppt课件</a>,共23页。PPT课件主要包含了影响反应速率的因素,2外因,化学反应的本质,温故知新,定性规律,交流研讨,定量关系,碰撞理论,活化能Ea,反应历程等内容,欢迎下载使用。
化学选择性必修1第3节 化学反应的速率课前预习课件ppt: 这是一份化学选择性必修1<a href="/hx/tb_c4002582_t3/?tag_id=26" target="_blank">第3节 化学反应的速率课前预习课件ppt</a>,共20页。PPT课件主要包含了点燃催化剂,总反应,反应历程反应机理,飞秒化学,镁条消失的快慢,产生气泡的快慢,H+浓度减小的快慢,消耗镁条的质量,产生气体的体积,a∶b∶c∶d等内容,欢迎下载使用。
鲁科版 (2019)选择性必修1第3节 化学反应的速率授课ppt课件: 这是一份鲁科版 (2019)选择性必修1第3节 化学反应的速率授课ppt课件,共38页。PPT课件主要包含了学业基础,核心素养,当堂评价,化学反应速率,单位时间,改变量,a∶b∶c∶d,答案D,答案C,答案AC等内容,欢迎下载使用。













