


人教版 (新课标)选修3 物质结构与性质第一节 共价键试讲课课件ppt
展开分子的空间结构与价层电子对互斥理论
第二节 分子的立体结构
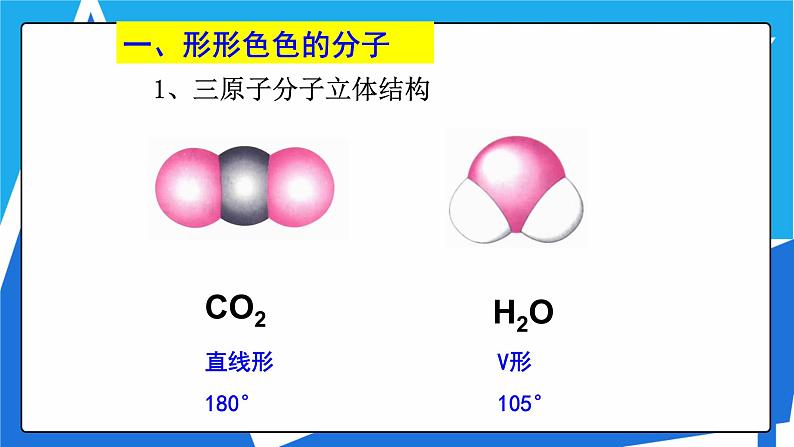
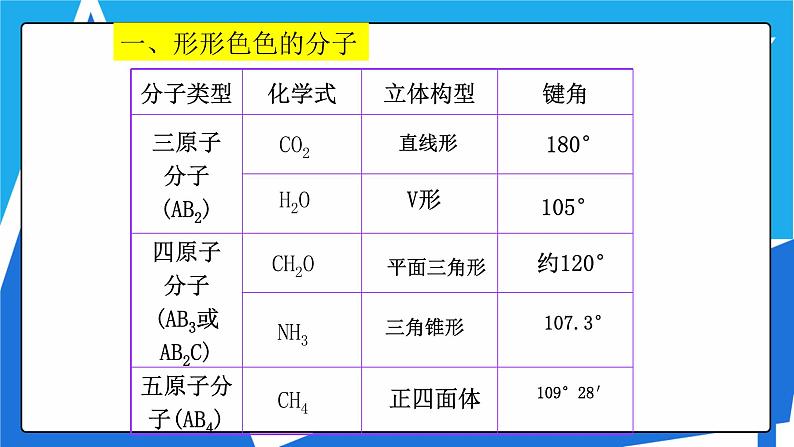
1、三原子分子立体结构
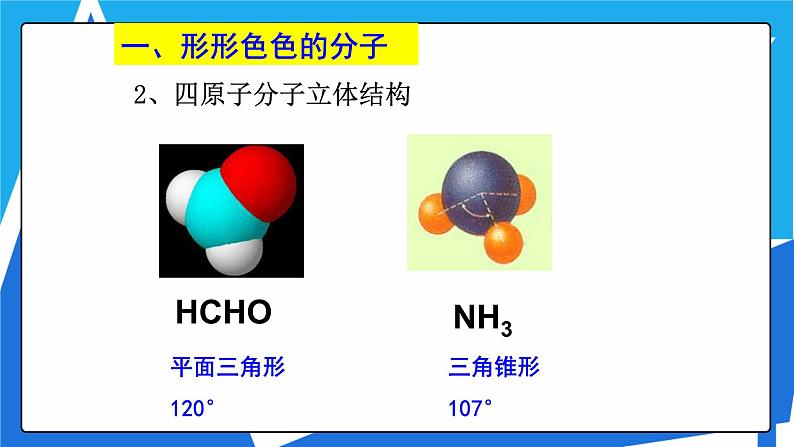
2、四原子分子立体结构
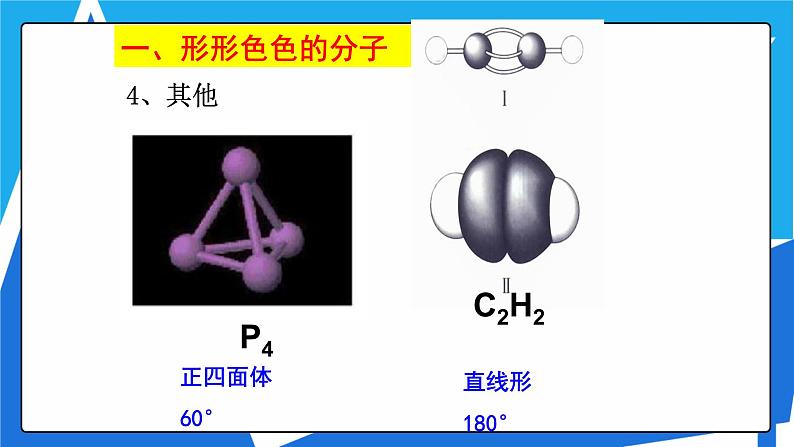
3、五原子分子立体结构
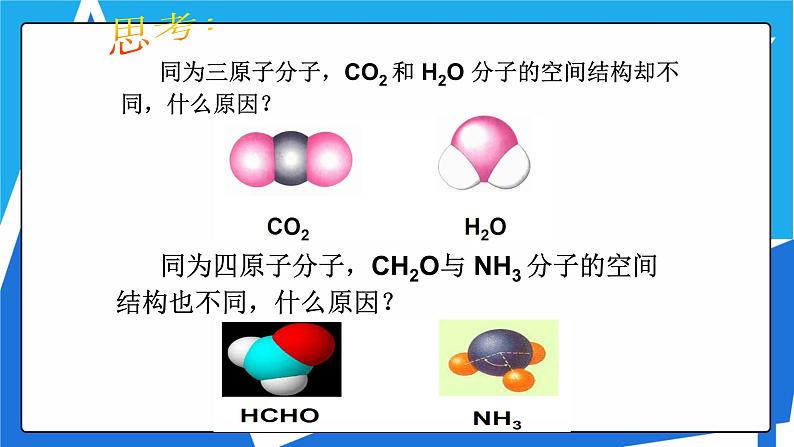
同为三原子分子,CO2 和 H2O 分子的空间结构却不同,什么原因?
同为四原子分子,CH2O与 NH3 分子的空间结构也不同,什么原因?
对ABn型的分子或离子,中心原子A价层电子对(包括成键σ键电子对和未成键的孤对电子对)之间由于存在排斥力,将使分子的几何构型总是采取电子对相互排斥最小的那种构型,以使彼此之间斥力最小,分子体系能量最低,最稳定。
σ键电子对和孤对电子对
2.价层电子对(σ键电子对和未成键的孤对电子对)
=δ键个数+中心原子上的孤对电子对个数
δ键电子对数 = 与中心原子结合的原子数
中心原子上的孤电子对数 =½(a-xb)
2.成键σ键电子对和未成键的孤对电子对
δ键电子对数 = 与中心原子结合的原子数
3.价电子对的空间构型即VSEPR模型
价电子对数目:2 3 4VSEPR模型:
4. VSEPR模型应用——预测分子立体构型
中心原子的孤对电子也要占据中心原子的空间,并与成键电子对互相排斥。推测分子的立体模型必须略去VSEPR模型中的孤电子对
4.价电子对的空间构型即VSEPR模型应用
ABn 型分子及离子的VSEPR模型和立体结构
平面三角形 BF3
4 0 AB4
3 1 AB3
2 2 AB2
1.若ABn型分子的中心原子A上没有未用于形成共价键的孤对电子,运用价层电子对互斥模型,下列说法正确的( )A.若n=2,则分子的立体构型为V形B.若n=3,则分子的立体构型为三角锥形C.若n=4,则分子的立体构型为正四面体形D.以上说法都不正确
2.用价层电子对互斥模型判断SO3的分子构型 __ A、正四面体形 B、V形 C、三角锥形 D、平面三角形
课堂练习:1、多原子分子的立体结构有多种,三原子分子的立体结构有___ 形和 形,大多数四原子分子采取 形和 ___ 形两种立体结构,五原子分子的立体结构中最常见的是 形。 2 、下列分子或离子中,不含有孤对电子的是 ___ A、H2O、B、H3O+、C、NH3、D、NH4+
3 、下列分子①BCl3、②CCl4、③H2S、④CS2中,其键角由小到大的顺序为_____ 4、以下分子或离子的结构为正四面体,且键角为109°28′ 的是____ ①CH4 ②NH4+ ③CH3Cl ④P4 ⑤SO42-A、①②③ B、①②④ C、①②⑤ D、①④⑤
高中化学人教版 (2019)选择性必修2第二章 分子结构与性质第二节 分子的空间结构优质ppt课件: 这是一份高中化学人教版 (2019)选择性必修2<a href="/hx/tb_c4002447_t3/?tag_id=26" target="_blank">第二章 分子结构与性质第二节 分子的空间结构优质ppt课件</a>,文件包含人教版2019高中化学必修二221《分子结构的测定多样的分子空间结构价层电子对互斥模型》课件pptx、多样的分子结构实验mp4、美丽的金刚石结构实验mp4等3份课件配套教学资源,其中PPT共47页, 欢迎下载使用。
高中化学人教版 (2019)选择性必修2第二节 分子的空间结构优质ppt课件: 这是一份高中化学人教版 (2019)选择性必修2<a href="/hx/tb_c4002447_t3/?tag_id=26" target="_blank">第二节 分子的空间结构优质ppt课件</a>,共17页。PPT课件主要包含了三原子分子,四原子分子,CO2,H2O,NH3,直线形,三角锥形,CH2O,平面三角形,价层电子对等内容,欢迎下载使用。
高中化学人教版 (2019)选择性必修2第二节 分子的空间结构教课内容ppt课件: 这是一份高中化学人教版 (2019)选择性必修2第二节 分子的空间结构教课内容ppt课件,共23页。PPT课件主要包含了课前导入,直线形,平面三角形,三角锥形,价层电子对,相互排斥,彼此远离,最稳定,σ键电子对,中心原子上的孤电子对等内容,欢迎下载使用。













