






高中化学化学反应焓变的计算评优课ppt课件
展开1.理解反应热测定的原理和方法,分析产生误差的原因,完善和改进测定方法。2.学会书写热化学方程式,并判断书写的正误。3.构建盖斯定律模型,理解盖斯定律的本质,形成运用盖斯定律进行相关判断或计算的思维模型。
如何获得火箭推进剂燃烧时的反应热呢?
火箭发动机一般选用化学推进剂,它是由燃料和氧化剂组成的,反应后产生高温气体用于火箭推进。
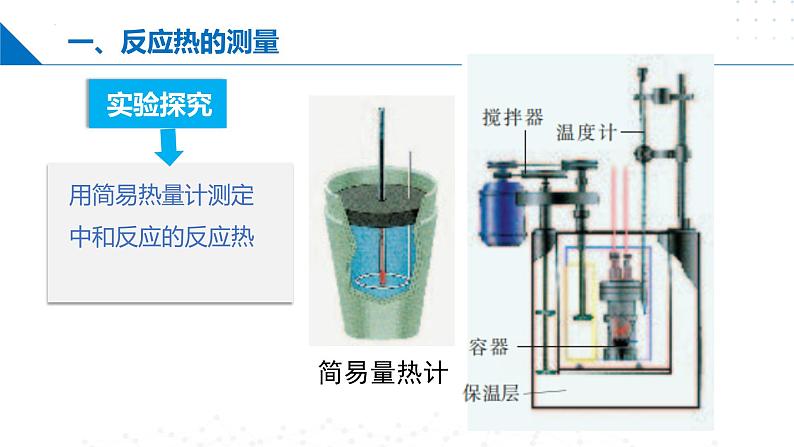
许多反应热可以通过量热计直接测定。
用简易热量计测定中和反应的反应热
测定中和反应反应热的实验装置
实验的关键及其注意事项
一次实验过程,温度计使用3次
例1:各稀溶液的密度均近似为1 g•mL-1,又知中和反应后溶液的比热容c=4.18 J•g-1•℃-1。为了计算中和热,某学生实验记录数据如下:依据该学生的实验数据计算,该实验测得ΔH=_________ kJ•ml-1(结果保留一位小数)。
1、用同体积、同浓度的KOH代替NaOH完成上述实验,用同体积、同浓度的硝酸代替盐酸完成上述实验,测得的反应热数值三者是否相同?
相同。参加反应的物质都是强酸、强碱,它们在水中完全电离,中和反应的离子方程式都是H++OH-===H2O,反应都在室温下进行,且参加反应的n(H+)和n(OH-)都相同,所以反应热也相同。
大量实验证明:25 ℃和101 kPa下,强酸与强碱稀溶液发生中和反应生成1 ml液态水时,放出57.3 kJ的热量。
H+(aq)+OH-(aq)==H2O(l) ΔH=-57.3 kJ/ml
1、用浓硫酸代替盐酸对结果会产生什么影响?用醋酸代替盐酸对结果会产生什么影响?
浓硫酸溶于水时放热,所测ΔH偏小;醋酸是弱酸,弱酸电离吸热,所测ΔH偏大。
中和热定义中的“稀溶液”一般是指酸、碱的物质的量浓度均小于或等于1 ml/L的溶液
中和热以生成1 ml H2O为基准,是一个定值
中和热不包括其他离子在水溶液中的生成热、物质的溶解热、电解质电离时所伴随的热效应。
例2:向1 L 0.5 ml•L-1的NaOH溶液中分别加入下列物质:①稀醋酸、②浓硫酸、③稀硝酸,恰好完全反应的热效应分别为ΔH1、ΔH2、ΔH3,三者的关系正确的是( )A.ΔH1>ΔH2>ΔH3B.ΔH1<ΔH3<ΔH2C.ΔH1=ΔH3>ΔH2D.ΔH1>ΔH3>ΔH2
C(s)+O2(g)===CO2(g) ΔH=-393.6 kJ·ml-1
(1)ΔH 与物质的聚集状态有关,因为物质的聚集状态变化时会发生焓变,故应标明物质的聚集状态。通常用英文字母 s、l、g 分别表示固态、液态和气态,用 aq 表示水溶液,通常指稀溶液。
2H2 (g)+ O2 (g) === 2H2O(g)
(2)ΔH 要注明反应的温度和压强,一般不注明时,表示的反应温度为 298 K、压强为 100 kPa。(3)ΔH 的单位一般是 kJ· ml-1。在相同条件下正向反应和逆向反应的ΔH 数值相同,符号相反。另外,ΔH的数值也与化学方程式的书写形式有关。
2H2 (g)+ O2 (g) === 2H2O(g)
∆H=−241.8 kJ/ml
∆H=−483.6 kJ/ml
反应进度是以反应方程式整体作为一个特定组合单元来表示反应进行的程度。ml -1 指反应进度为 1 ml,此时各种反应物消耗掉的物质的量,各种生成物的物质的量,在数值上均等于热化学方程式中各自的化学计量数。
ΔH 单位中的“ml-1”
例3 依据事实,写出下列反应的热化学方程式。(1)16 g CH4(g)与适量O2(g)发生反应,生成CO2(g)和H2O(l),放出890.3 kJ热量: ________________________________________________________。
CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH=-890.3 kJ•ml-1
(2)1 L 1 ml•L-1 KOH溶液中和1 L 1 ml•L-1 HNO3溶液,放出57.3 kJ热量: _________________________________________________________
KOH(aq)+HNO3(aq)===KNO3(aq)+H2O(l) ΔH=-57.3 kJ•ml-1
在上海搭乘地铁从汉中路到陕西南路
无论选择哪条路线,只要起点站(始点)和终点站(终点)相同,经过闸机时,所付的车费是一样的。
1840年,俄国化学家盖斯在分析了许多化学反应的热效应的基础上,总结出一条规律:“一个化学反应,不论是一步完成,还是分几步完成,其总的热效应是完全相等的。”这个规律被称为盖斯定律。
H2SO4 H2SO4·H2O H2SO4·2H2O H2SO4·3H2O
ΔH=ΔH1+ΔH2+ΔH3
在恒压条件下,化学反应的热效应等于焓变(ΔH),而ΔH仅与反应的起始状态和反应的最终状态有关,而与反应的途径无关。
ΔH= =
ΔH3+ΔH4+ΔH5
盖斯定律的提出,为反应热的研究提供了极大的方便,使一些不易测定或无法测定的化学反应的反应热可以通过推算间接求得。
热化学方程式的化学计量数加倍,ΔH也相应加倍。
热化学方程式相加减,同种物质之间可加减,反应热也相应加减。
将热化学方程式颠倒时,ΔH的正负必须随之改变。
运用盖斯定律计算反应热的关键
加合法就是运用所给热化学方程式通过加减乘除的方法得到所求的热化学方程式。
运用盖斯定律计算反应热的方法
ΔH3 = ΔH1 − ΔH2= −110.5 kJ/ml
若反应物A变为生成物D,可以有两个途径①由A直接变成D,反应热为ΔH;②由A经过B变成C,再由C变成D,每步的反应热分别为ΔH1、ΔH2、ΔH3。如图所示:
ΔH1+ΔH2+ΔH3。
C(s) + O2(g)
ΔH1 = ΔH2 + ΔH3ΔH3 = ΔH1 − ΔH2 = −393.5 kJ/ml − (−283.0 kJ/ml) = −110.5 kJ/ml
例4:已知:①S(g)+O2(g)===SO2(g) ΔH1;②S(s)+O2(g)===SO2(g) ΔH2;③2H2S(g)+O2(g)===2S(s)+2H2O(l) ΔH3;④2H2S(g)+3O2(g)===2SO2(g)+2H2O(l) ΔH4;⑤SO2(g)+2H2S(g)===3S(s)+2H2O(l) ΔH5。下列关于上述反应焓变的判断不正确的是( )A.ΔH1<ΔH2B.ΔH3<ΔH4C.ΔH5=ΔH3-ΔH2D.2ΔH5=3ΔH3-ΔH4
实验操作实验数据处理中和热及理解
概念运用盖斯定律计算反应热的方法加合法虚拟路径法
A.2ΔH1+2ΔH2-2ΔH3B.ΔH1+ΔH2-ΔH3C.3ΔH1+2ΔH2+2ΔH3D.3ΔH1+2ΔH2-2ΔH3
2.根据下列热化学方程式:①C(s)+O2(g)===CO2(g) ΔH1=-393.5 kJ·ml-1
③CH3COOH(l)+2O2(g)===2CO2(g)+2H2O(l) ΔH3=-870.3 kJ·ml-1可以计算出2C(s)+2H2(g)+O2(g)===CH3COOH(l)的反应热为____________________(写出计算过程)。
ΔH=-488.3 kJ·ml-1
高中化学人教版 (2019)选择性必修1第一章 化学反应的热效应第二节 反应热的计算优质ppt课件: 这是一份高中化学人教版 (2019)选择性必修1<a href="/hx/tb_c4002416_t3/?tag_id=26" target="_blank">第一章 化学反应的热效应第二节 反应热的计算优质ppt课件</a>,共19页。PPT课件主要包含了学习目标,素养目标,情境引入,教学过程,盖斯定律,能量守恒定律,能量守恒,图示表示,CO2g,△H1等内容,欢迎下载使用。
高中化学沪科技版(2020)选择性必修1反应热的测量一等奖课件ppt: 这是一份高中化学沪科技版(2020)选择性必修1<a href="/hx/tb_c4036418_t3/?tag_id=26" target="_blank">反应热的测量一等奖课件ppt</a>,文件包含12反应热的测量和计算同步课件-pptx、12反应热的测量和计算分层练习-原卷版docx、12反应热的测量和计算分层练习-解析版docx、测定酸碱中和反应的热效应wmv等4份课件配套教学资源,其中PPT共34页, 欢迎下载使用。
化学选择性必修1第二节 反应热的计算优秀ppt课件: 这是一份化学选择性必修1第二节 反应热的计算优秀ppt课件,文件包含新人教版化学选择性必修一12反应热的计算课件pptx、新人教版化学选择性必修一12反应热的计算针对练习含解析docx、新人教版化学选择性必修一12反应热的计算教案doc等3份课件配套教学资源,其中PPT共30页, 欢迎下载使用。













