



高中化学沪科技版(2020)选择性必修1化学平衡的移动优质课课件ppt
展开1.了解浓度、压强和温度对化学平衡的影响。2.从Qc与K关系及浓度、温度、压强对反应速率、平衡的影响,推断平衡移动的方向。3.通过实验论证浓度、压强、温度对化学平衡的影响。
如何改变化学平衡状态呢?
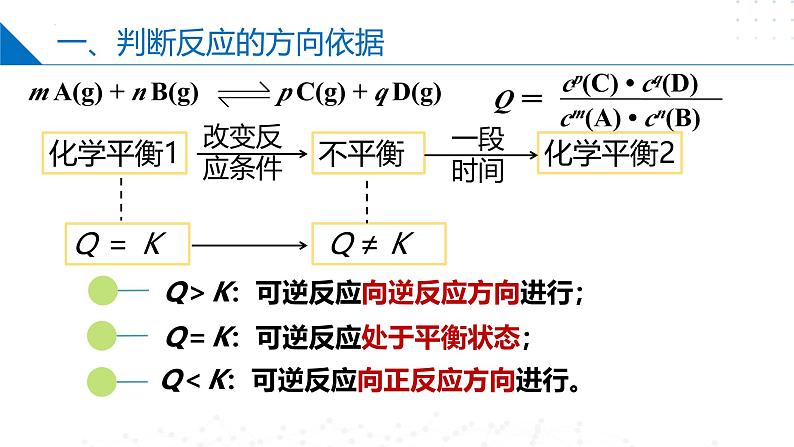
m A(g) + n B(g) p C(g) + q D(g)
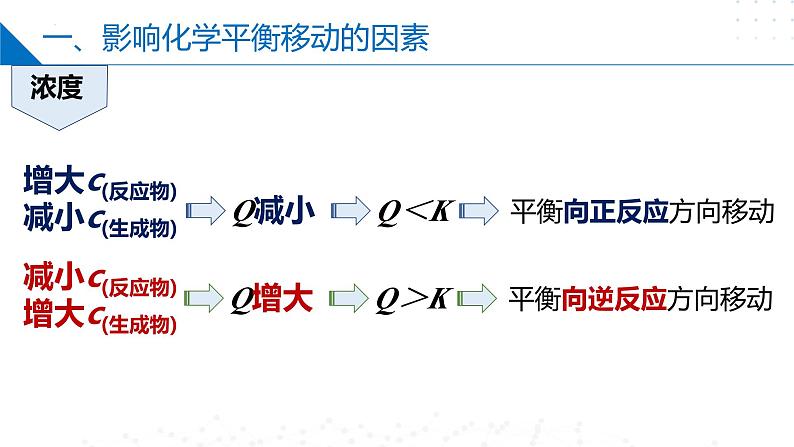
Q<K:可逆反应向正反应方向进行。
Q>K:可逆反应向逆反应方向进行;
Q=K:可逆反应处于平衡状态;
一、判断反应的方向依据
二、影响化学平衡移动的因素
在反应体系内再增加氮气,使其浓度达到平衡时的 2 倍,即 c1(N2) =2c(N2),其他物质的浓度保持不变:
Q1<K:可逆反应向正反应方向进行。
一、影响化学平衡移动的因素
增大c(反应物)减小c(生成物)
减小c(反应物)增大c(生成物)
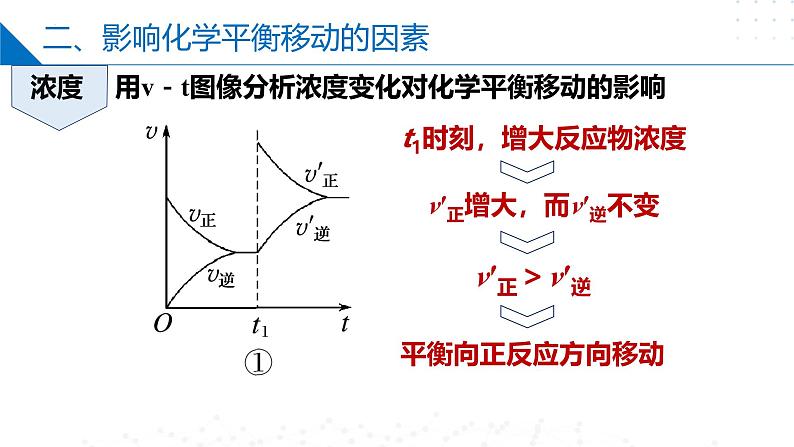
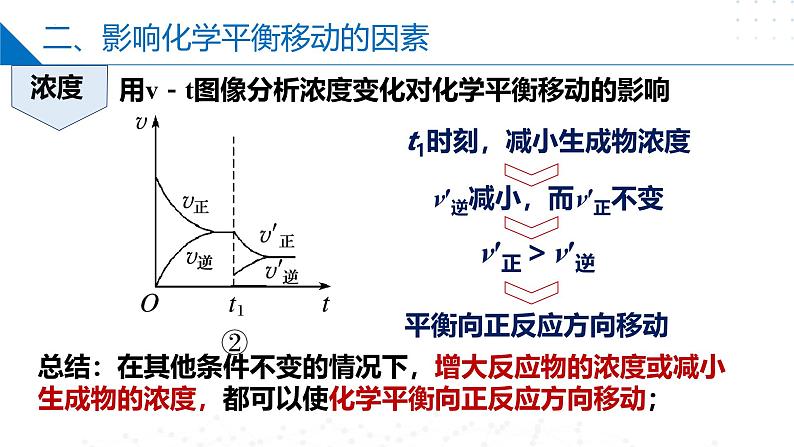
用v-t图像分析浓度变化对化学平衡移动的影响
t1时刻,增大反应物浓度
v′正增大,而v′逆不变
t1时刻,减小生成物浓度
v′逆减小,而v′正不变
总结:在其他条件不变的情况下,增大反应物的浓度或减小生成物的浓度,都可以使化学平衡向正反应方向移动;
t1时刻,增大生成物浓度
v′逆增大,而v′正不变
t1时刻,减小反应物浓度
v′正减小,而v′逆不变
总结:在其他条件不变的情况下,增大生成物的浓度或减小反应物的浓度,都可以使化学平衡向逆反应方向移动
固体或纯液体的浓度是常数,改变固体或纯液体的量并不影响v正、v逆的大小,平衡不移动。
“浓度对化学平衡移动的影响”中的“浓度”是指与反应有关的气体或溶液中参加反应的离子的浓度。
对于离子平衡体系,注意离子浓度的改变方式,排除不参与反应的离子的干扰。
在工业生产中,常通过适当增大廉价的反应物的浓度,使化学平衡向正反应方向移动,可提高价格较高原料的转化率,从而降低生产成本。
NO2浓度比②中的减小
向气体分子数减小方向移动
通过计算Q2 =K/2 ,
即Q2 < K 向正反应方移动
NO2浓度比②中的增大
向气体分子数增大方向移动
通过计算Q2 =2 K, 即Q2 > K 向逆反应方移动
②减小压强,化学平衡向气体体积增大的方向移动。
压强对化学平衡移动的影响规律
①增大压强,化学平衡向气体体积减小的方向移动。
③对于反应前后气体分子数目不变的反应,改变压强平衡不移动。
用v-t图像分析压强变化对化学平衡移动的影响
平衡向正反应(气体体积减小)方向移动
N2(g)+3H2(g) ⇌2NH3(g)为例
平衡向逆反应(气体体积增大)方向移动
aA(g)+bB(g)
cC(g)+dD(g)
若:a+b = c+d
充入“惰性”气体对化学平衡的影响
恒容时,通入“惰性”气体
恒压时,通入“惰性”气体
平衡向气体体积增大的方向移动
对于反应前后气体体积相等的反应[如H2(g)+I2(g)⇌2HI(g)],当向平衡体系中充入“惰性”气体时,则无论任何情况下平衡都不发生移动。
在恒容容器中,改变其中一种物质的浓度时,必然同时引起压强的改变,但判断平衡移动的方向时,应以浓度的影响进行分析,得出Qc与K的关系。
[C(H2O)6]2++4Cl- [CCl4]2-+6H2O
升高温度,平衡向正反应方向移动(即吸热方向)降低温度,平衡向逆反应方向移动(即放热方向)
②降低温度,平衡向放热反应方向移动。
温度对化学平衡移动的影响规律
①升高温度,平衡向吸热反应方向移动。
任何化学反应都伴随着能量的变化(放热或吸热),所以任意可逆反应的化学平衡状态都受温度的影响。
用v-t图像分析温度变化对化学平衡移动的影响
吸热反应方向的v′逆增大幅度大v′逆>v′正
已知反应:mA(g)+nB(g) pC(g) ΔH<0,当反应达平衡后,若温度改变:
v′正、v′逆均减小,而v′逆不变
吸热反应方向的v′逆减小幅度大v′正>v′逆
已知反应:mA(g)+nB(g) pC(g) ΔH>0,当反应达平衡后,若温度改变:
当其他条件不变时,催化剂能够同等程度地改变正逆反应速率,因此它对化学平衡移动无影响,即不能改变平衡混合物的组成,但可缩短达到化学平衡所需的时间。
催化剂能影响化学平衡的移动吗?
向减少反应物浓度的方向
向增大反应物浓度的方向
如果改变影响平衡的一个因素(如温度、压强及参加反应的物质的浓度),平衡就向能够减弱这种改变的方向移动。
(1850—1936)
平衡移动的结果只能是“减弱”外界条件的改变,但不能完全“消除”这种改变。可概括为“外变大于内变”。
所有的动态平衡,用于定性判断平衡移动的方向,解释平衡移动造成的结果或现象等。
如:原平衡(100℃)→升温到200℃→减弱(降温)→向吸热方向移动→新平衡(温度介于100-200℃之间)
如图为合成氨反应在不同温度、压强下平衡时氨的物质的量分数。应用勒夏特列原理解释对于工业合成氨采用相关措施及原因。
促进平衡正向移向,提高H2的转化率
有利于平衡向正反应方向移动
加快反应速率,同时提高催化剂的活性
影响化学平衡移动的因素
1、一定温度下,某密闭容器中加入足量碳酸钙,发生反应CaCO3(s) CaO(s)+CO2(g)达到平衡,下列说法正确的是( )A.保持容器体积不变,充入He,平衡向逆反应方向进行B.增加CaCO3(s)的量,平衡正向移动,CO2的浓度增大C.将体积增大为原来的2倍,再次达到平衡时,气体密度不变D.将体积缩小为原来的一半,当体系再次达到平衡时,CO2的浓度为原来的2倍
高中化学化学反应焓变的计算评优课ppt课件: 这是一份高中化学<a href="/hx/tb_c4036420_t3/?tag_id=26" target="_blank">化学反应焓变的计算评优课ppt课件</a>,文件包含12反应热的测量和计算同步课件pptx、测定酸碱中和反应的热效应wmv等2份课件配套教学资源,其中PPT共34页, 欢迎下载使用。
高中沪科技版(2020)1.1 化学反应与能量变化评优课ppt课件: 这是一份高中沪科技版(2020)<a href="/hx/tb_c4036414_t3/?tag_id=26" target="_blank">1.1 化学反应与能量变化评优课ppt课件</a>,共26页。PPT课件主要包含了学习目标,系统的内能,能量变化,化学反应的焓变,化学反应,反应热,产生反应热,体系内能改变,等压反应热,能力达成等内容,欢迎下载使用。
化学选择性必修1化学平衡的移动优秀课件ppt: 这是一份化学选择性必修1<a href="/hx/tb_c4036431_t3/?tag_id=26" target="_blank">化学平衡的移动优秀课件ppt</a>,文件包含222化学平衡的移动同步课件pptx、222化学平衡的移动分类练习原卷版docx、222化学平衡的移动分类练习解析版docx等3份课件配套教学资源,其中PPT共38页, 欢迎下载使用。













