






高中化学沪科技版(2020)选择性必修1化学反应速率试讲课ppt课件
展开1.知道化学反应速率的表示方法;2.了解测定化学反应速率的简单方法;3.知道化学反应是有历程的,认识基元反应和活化能;4.了解温度、浓度、压强和催化剂对化学反应速率的影响。
NO 和 CO 是汽车尾气中的两种有毒气体,可发生反应:
2NO(g) + 2CO(g)= N2(g) + 2CO2(g)
该反应在常温常压下可以自发进行,而且反应可以进行得很完全(K = 2.5×1060)。
但该条件下的反应速率极慢,以至于反应几乎不发生,如果能设法提高该反应的反应速率,就可减弱汽车尾气对环境的污染。
(1)概念:化学反应速率是用来衡量化学反应过程进行快慢程度的物理量。(2)表示方法:可用单位时间内 或者 (均取正值)来表示。
mA+nB===pY+qZ
v(A)=________,v(B)=______,v(Y)=_______,v(Z)=________。
1、在同一个化学反应中,用不同物质表示的化学反应速率,其数值大小不一定相同,但表示的速率相同,即一种物质的速率就代表了整个化学反应的速率。
2、用浓度变化表示化学反应速率适用于气体和溶液中的溶质,不适用于固体和纯液体。
3、求得的反应速率是时间间隔Δt内化学反应的平均速率。
υ(A)︰υ(B)︰υ(C)︰υ(D) = m︰n︰p︰q
同一化学反应 m A + n B p C + q D
一、化学反应速率的概念与表示方法
如果化学方程式中物质的反应系数不等,用不同物质的浓度变化表示的速率是不相等的。
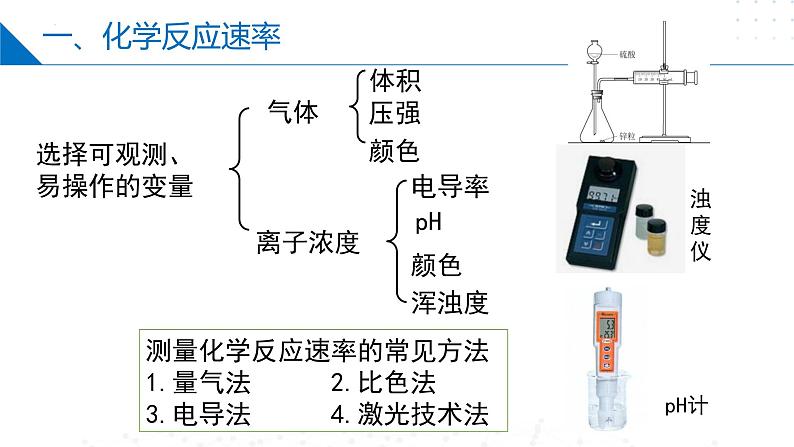
选择可观测、易操作的变量
测量化学反应速率的常见方法1.量气法 2.比色法3.电导法 4.激光技术法
二、影响化学反应速率的因素
基元反应:通过碰撞一步直接转化为产物的反应。例如:NO2 + CO NO + CO2
反应过程中没有任何中间产物生成
更多的化学反应过程分为多步进行 H2 + I2 2HI 第一步: I2 2I (快速平衡) 第二步:2I + H2 →2HI (慢)
一个化学反应的速率就取决于速率最慢的基元反应。
化学反应速率与反应历程有关,相同的反应,条件不同反应历程不同,化学反应速率也不同
化学反应所经过的步骤,称为反应历程或反应机理。
反应历程是用一系列的基元反应来描述的,而我们平时所写的化学方程式只能表示出反应物和生成物之间的化学计量关系。
碰撞理论碰撞理论认为化学反应中旧键的断裂和新键的形成都是通过反应物分子的相互碰撞来实现的。
能发生反应的碰撞称为有效碰撞。
反应物分子间的相互碰撞是反应发生的前提条件。
发生碰撞的分子具有足够高的能量
分子在一定的方向上发生碰撞
有效碰撞必须满足的条件:
化学反应中,能量较高、有可能发生有效碰撞的分子
活化分子的平均能量与所有分子的平均能量之差
在一定条件下,活化分子在反应物分子中所占的百分数是一定的。
单位体积内的活化分子的数目与单位体积内反应物分子的总数成正比。
当增加反应物的浓度时,单位体积内反应物的活化分子数目增多,反应物发生有效碰撞的次数增多,反应速率增大。
其他条件相同时,升高温度→单位体积内活化分子数目增多→单位体积内活化分子百分数增多→单位时间内有效碰撞次数增多→化学反应速率增大。
②对于可逆反应,升高温度,正、逆反应速率都增大,降低温度,正、逆反应速率都减小。
①温度对反应速率的影响适用于任何反应,无论是放热反应还是吸热反应,升高温度,反应速率都增大,降低温度,反应速率都减小。
过渡态理论:反应物分子并不只是通过简单的碰撞直接形成产物,而是必须经过一个形成活化络合物的过渡状态,并且达到这个过渡状态需要一定的活化能。
这与爬山类似,山的最高点便是过渡态。
有催化剂参与的反应,活化能(Ea1)较小,则反应速率较大;而没有催化剂参与的反应,活化能(Ea2)较大,则反应速率较小。
当其他条件相同时,使用催化剂,改变反应历程→活化能降低→活化分子百分数增多→单位体积、单位时间内有效碰撞次数增多→化学反应速率增大
2、催化剂有选择性,不同的化学反应的催化剂不相同,催化剂具有一定的活化温度。
1、催化剂对可逆反应的正、逆反应的速率影响相同。
催化剂用于汽车尾气的净化
3、催化剂是改变化学反应速率最有效的手段之一。据统计,90%以上的化学工业涉及的化学反应都使用催化剂,使用催化剂可以带来巨大的经济效益。
外界条件对活化分子、活化能的影响
例1.放热反应2SO2(g)+O2(g) 2SO3(g)是制备硫酸的重要反应。下列叙述正确的是( )A.催化剂V2O5不改变该反应的逆反应速率B.增大反应体系的压强,化学反应速率一定增大C.降低温度将缩短反应达到平衡的时间D.在t1、t2时刻,SO3(g)的浓度分别是c1、c2,则时间间隔t1~t2内,生成SO3(g)的平均反应速率v=
基元反应碰撞理论过渡态理论浓度、温度、催化剂对速率的影响
1、对于反应2N2O5(g) 4NO2(g)+O2(g),科学家提出如下反应历程:第一步 N2O5 NO2+NO3 快速平衡第二步 NO2+NO3―→NO+NO2+O2 慢反应第三步 NO+NO3―→2NO2 快反应其中可近似认为第二步反应不影响第一步的平衡。下列表述正确的是( )A.v(第一步的逆反应)
高中化学沪科技版(2020)选择性必修1化学平衡的移动优质课课件ppt: 这是一份高中化学沪科技版(2020)选择性必修1<a href="/hx/tb_c4036431_t3/?tag_id=26" target="_blank">化学平衡的移动优质课课件ppt</a>,共38页。PPT课件主要包含了学习目标,旧平衡v正=v逆,v正v逆,新平衡v‘正=v’逆,课程导入,Q1=,Q减小,Q<K,Q增大,Q>K等内容,欢迎下载使用。
高中化学沪科技版(2020)选择性必修1第2章 化学反应的方向、限度和速率2.2化学反应的限度化学平衡常数优秀ppt课件: 这是一份高中化学沪科技版(2020)选择性必修1<a href="/hx/tb_c4036430_t3/?tag_id=26" target="_blank">第2章 化学反应的方向、限度和速率2.2化学反应的限度化学平衡常数优秀ppt课件</a>,共32页。PPT课件主要包含了课堂小结等内容,欢迎下载使用。
化学选择性必修1化学反应的方向精品ppt课件: 这是一份化学选择性必修1<a href="/hx/tb_c4036427_t3/?tag_id=26" target="_blank">化学反应的方向精品ppt课件</a>,共25页。PPT课件主要包含了ΔGΔH-TΔS,课堂小结等内容,欢迎下载使用。














