





高中化学鲁科版 (2019)选择性必修2第3章 不同聚集状态的物质与性质第2节 几种简单的晶体结构模型评优课课件ppt
展开meiyangyang8602
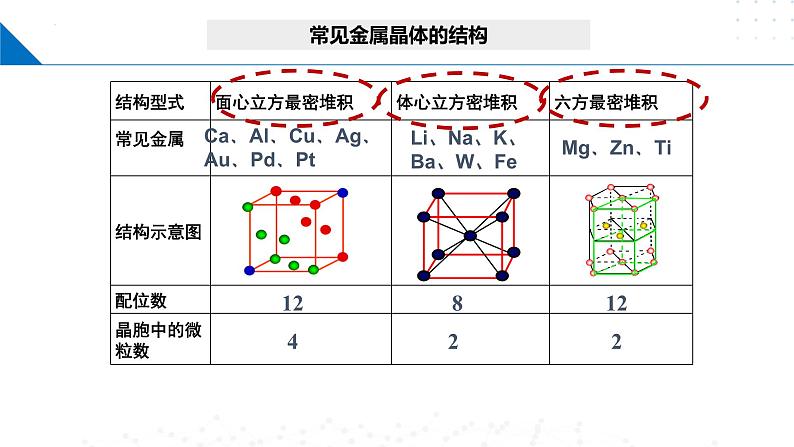
由于“自由电子”为整个金属所共有,所以金属键没有饱和性和方向性,从而导致金属晶体可以看做等径圆球的堆积。
请你回忆! 金属晶体的晶胞有什么特点呢?
把金属晶体看成由其构成微粒堆积而成的,是一种有效的思维模型。
Li、Na、K、Ba、W、Fe
Ca、Al、Cu、Ag、Au、Pd、Pt
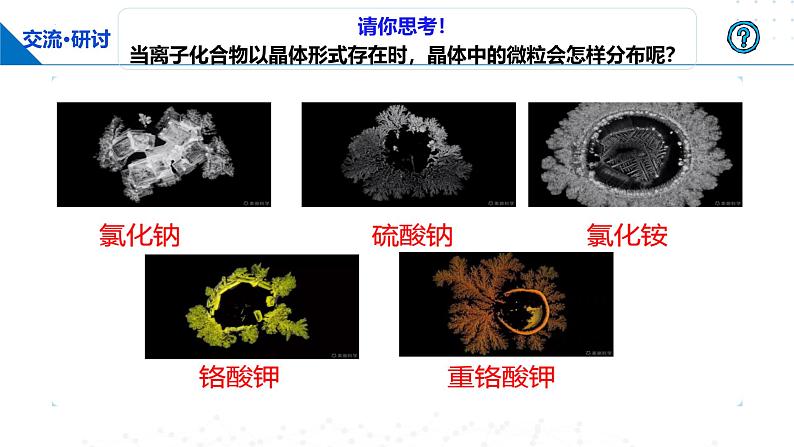
请你思考! 当离子化合物以晶体形式存在时,晶体中的微粒会怎样分布呢?
第三章 不同聚集状态的物质与性质
第 2 节 几种简单的晶体结构模型
节教材以构建几种典型的晶体结构模型为主线,以不同类型的晶体中微粒在空间如何排列,排列受哪些因素影响、各类晶体的晶胞有何特点等为核心问题分别介绍了金属晶体、离子晶体、共价晶体和分子晶体。 教材设计了多样化的探究活动栏目,帮助学生建立物质结构与性质之间的联系,构建晶体结构模型,落实"证据推理与模型认知"化学学科核心素养培养目标
请你预测! 猜想在所形成的晶体中离子的排布具有怎样的规律
离子晶体:由阳离子和阴离子通过离子键结合而成的晶体。
离子键无方向性、无饱和性
无方向性每个离子在空间任何方向会尽可能多地吸引带相反电荷的离子以降低体系能量无饱和性只要空间允许,每个离子尽可能多地吸引带相反电荷的离子,并不受离子本身所带电荷的限制
以离子键结合的化合物倾向于形成紧密堆积。
阴阳离子半径不同,故离子化合物的结构可以归结为不等径圆球密堆积的几何问题。
阴、阳离子在空间呈现周期性重复排列所形成的晶体
由于 Na+ 和 Cl- 之间的静电作用没有方向性,在带负电荷的 Cl- 周围吸引着一定数量的带正电荷的 Na+;同样,在带正电荷的 Na+ 周围吸引着一定数量的带负电荷的 Cl-。这种排列方式无限延伸,形成晶体。
请你思考! 离子晶体和金属晶体有哪些不同?
金属晶体可以看成由直径相等的圆球在三维空间堆积而成
离子晶体“大球”先进行密堆积,产生空隙,“小球”再填充空隙,最终形成晶胞。
3、面心立方晶胞的空隙
请你思考! 观察氯化钠晶体的微观结构示意图,你将如何截取氯化钠晶体的晶胞? 在你截取的晶胞中,实际填入的 Na+与 Cl—各是多少个?
1. Na+ 、 Cl- 在晶胞中的什么位置? 2. 在一个晶胞中, Cl- 的个数等于多少? Na+的个数等于多少? 3.在NaCl晶体中,是否存在单独“NaCl”分子?
Cl-按面心立方堆积方式排列,Na+离子填充在Cl-所成的空隙中。
Cl-按面心立方堆积方式排列
Na+离子填充在Cl-所成的空隙中
NaCl:Cl-作面心立方堆积,Na+填入八面体空隙,填隙率100%。
① 堆积方式:Cl-:面心立方堆积Na+填入八面体空隙,填隙率100%
Na+:4个 ; Cl- :4个
Cl-:8×1/8+6×1/2 = 4Na+:12× ¼ + 1 = 4
离子晶体没有分子式,其化学式表示的是离子的个数比。
Na+:6个 ; Cl- :6个
④每个Na+周围距离最近的Na+有______个, 每个Cl-周围距离最近的Cl-有______个,
⑤晶体中Na+ 与Cl-的空间坐标(以晶胞参数(棱长)a为单位长度):
注意:坐标原点的选择,坐标轴的方向,坐标轴单位(晶胞棱长)
(0.5,0.5,1)
(0.5,0.5,0.5)
每个Na+周围最近的Na+有几个:每个 Cl-周围最近的Cl-有几个:
Cl-按简单立方堆积方式排列,Cs+离子填在Cl-所成的空隙中。
每个晶胞中: Cl-个数为8×1/8=1 Cs+个数为 1
③化学式的确定:CsCl
②每个晶胞含离子的个数:
简单立方堆积有一个立方体空隙
Cl-按简单立方堆积方式排列,Cs+离子填在Cl-所成的空隙中
①堆积方式:Cl-:简单立方堆积,Cs+填入立方体空隙,填隙率100%
Cs+:1个 ; Cl- :1个
Cs+:8个 ; Cl- :8个
④每个Cs+周围距离最近的Cs+有______个, 每个Cl-周围距离最近的Cl-有______个,
⑤晶体中Cs+与Cl-的空间坐标(以晶胞参数(棱长)a为单位长度)
(0.5,0.5,0.5)
搭建模型认识结构
S2-按 面心立方堆积方式排列,Zn2+ 离子填在S2-所成的空隙中。
③化学式的确定:ZnS
S2-个数为8×1/8+6×1/2=4 Zn2+个数为 4
堆积方式:S2-:面心立方堆积,Zn2+:填入一半的四面体空隙,填隙率50%。
①堆积方式:S2-:面心立方堆积,Zn2+:填入一半的四面体空隙,填隙率50%。
Zn2+ :4个 ; S2- :4个
④每个Zn2+周围距离最近的Zn2+有______个,每个S2-周围距离最近的S2-有______个,
⑤晶体中Zn2+ 与 S2- 的空间坐标(以晶胞参数(棱长)a为单位长度)
(0.5,0.5,0)
(0.25,0.25,0.75)
(0.75,0.75,0.75)
(0.75,0.25,0.25)
Ca2+按 面心立方堆积方式排列,F▬填在Ca2+所成的空隙中。
③化学式的确定:CaF2
Ca2+个数为8×1/8+6×1/2=4 F▬个数为 8
Ca2+:面心立方堆积,F-填入四面体空隙,填隙率100%。
Ca2+ :8个 ; F- :4个
④每个Ca2+周围距离最近的Ca2+有______个,每个F-周围距离最近的F-有______个,
化学式组成比等于配位数反比
⑤晶体中Ca2+ 与 F▬ 的空间坐标(以晶胞参数(棱长)a为单位长度)
(0.25,0.25,0.25)
(0.25,0.75,0.75)
(0.75,0.75,0.25)
(0.75,0.25,0.75)
1,高温下,超氧化钾晶体(KO2)呈立方体结构。如下图为超氧化钾晶体的一个晶胞(晶体中最小的重复单元)。则下列有关说法正确的是 ( ) A.KO2中只存在离子键 B.超氧化钾的化学式为KO2, 每个晶胞含有1个K+和1个O2- C.晶体中与每个K+距离最近的O2-有6个 D.晶体中,所有原子之间都以离子键相结合
请你思考! 结构相似的离子晶体,为什么熔沸点仍存在差异?
离子晶体中阴、阳离子间作用力的强弱在一定程度上可以用离子晶体的晶格能来衡量。
(2)意义:吸收的能量越多,晶格能越大,表示离子间作用力越强,离子晶体越稳定。
(1)概念:将1ml离子晶体完全气化为气态阴、阳离子所吸收的能量。
NaCl (s) = Na+ (g) + Cl- (g)
U = 787kJ/ml
请你思考! 依据表3-2-3 中的数据分析晶格能的大小与离子晶体的熔点的关系,并与同学们交流研讨结构相似的离子晶体其晶格能的大小与哪些因素有关。
②离子半径越小,所带电荷数越多,晶格能越大
①离子电荷一定时,离子半径越大,晶格能越小
③晶格能越大,离子晶体的熔点越高,硬度越大
例:NaCl的熔点为801 ℃,沸点为1413 ℃ ;CsCl的熔点为645 ℃
2,Li2O是离子晶体,其晶格能可通过图(a)的Brn-Haber循环计算得到
Li2O晶格能为________________kJ•ml-1。
3、如图所示是从NaCl或CsCl晶体结构中分割出来的部分结构图,其中属于从NaCl晶体中分割出来的结构图是( ) A.(1)和(3) B.(2)和(3) C.(1)和(4) D.只有(4)
鲁科版 (2019)选择性必修2第3节 离子键、配位键与金属键评优课ppt课件: 这是一份鲁科版 (2019)选择性必修2<a href="/hx/tb_c4002603_t3/?tag_id=26" target="_blank">第3节 离子键、配位键与金属键评优课ppt课件</a>,共41页。PPT课件主要包含了教材分析,配位键的形成,配位化合物,配合物的制备与应用等内容,欢迎下载使用。
高中化学鲁科版 (2019)选择性必修2第2节 共价键与分子的空间结构精品课件ppt: 这是一份高中化学鲁科版 (2019)选择性必修2<a href="/hx/tb_c4002602_t3/?tag_id=26" target="_blank">第2节 共价键与分子的空间结构精品课件ppt</a>,共60页。PPT课件主要包含了教材分析,杂化轨道理论,谢谢观看,键参数,量子力学的诞生,纺锤形,本章小结,第一部分,课堂导入等内容,欢迎下载使用。
高中化学鲁科版 (2019)选择性必修2第1节 共价键模型优秀ppt课件: 这是一份高中化学鲁科版 (2019)选择性必修2<a href="/hx/tb_c4002601_t3/?tag_id=26" target="_blank">第1节 共价键模型优秀ppt课件</a>,共56页。PPT课件主要包含了教材分析,共价键,共价键的形成与特征,共价键的类型,键参数等内容,欢迎下载使用。













