

高中化学苏教版 (2019)选择性必修1第二单元 化学能与电能的转化精品同步达标检测题
展开1.电解和电解池的工作原理
(1)电解:在直流电的作用下,在两极上分别发生氧化反应和还原反应的过程。
(2)电解池:将电能转化为化学能的装置(也称电解槽)。
(3)电解池的构成条件
①直流电源;②两个电极;③电解质溶液或熔融电解质;④形成闭合回路。
(4)电解原理
①电解时必须使用直流电源,不能使用交流电源。
②电解质的水溶液或熔融电解质均可被电解,因为它们均可电离出自由移动的阴、阳离子。
③电解过程中,电能转化为化学能而储存在电解产物中,转化过程中遵循能量守恒定律。
④电解质溶液(或熔融电解质)的导电过程,就是电解质溶液(或熔融电解质)的电解过程,是化学变化,而金属的导电是利用其物理性质。
⑤电解法是一种强氧化还原手段,可以完成非自发的氧化还原反应。
2.电解熔融态氯化钠
电解熔融态氯化钠原理图
(1)实验现象。
通电后,在阳极周围有气泡产生,在阴极上生成银白色金属。
(2)实验分析。
①熔融氯化钠中存在的微粒:Na+、Cl-。
②通电后离子和电子的移动方向
离子:阳离子Na+(填离子符号)移向阴极;阴离子Cl-(填离子符号)移向阳极。
电子:从电源负极流向阴极,从阳极流向电源的正极。
③电极上发生的变化
阴极:2Na++2e-===2Na(还原反应)。
阳极:2Cl--2e-===Cl2↑(氧化反应)。
(3)实验结论。
熔融的氯化钠在电流作用下发生了化学变化,分解生成了钠和氯气。
应用:工业上活泼金属的制备通常用电解法。如NaCl(熔融) eq \(――→,\s\up9(通电))Na,MgCl2(熔融) eq \(――→,\s\up9(通电))Mg,Al2O3(熔融) eq \(――→,\s\up9(通电))Al。
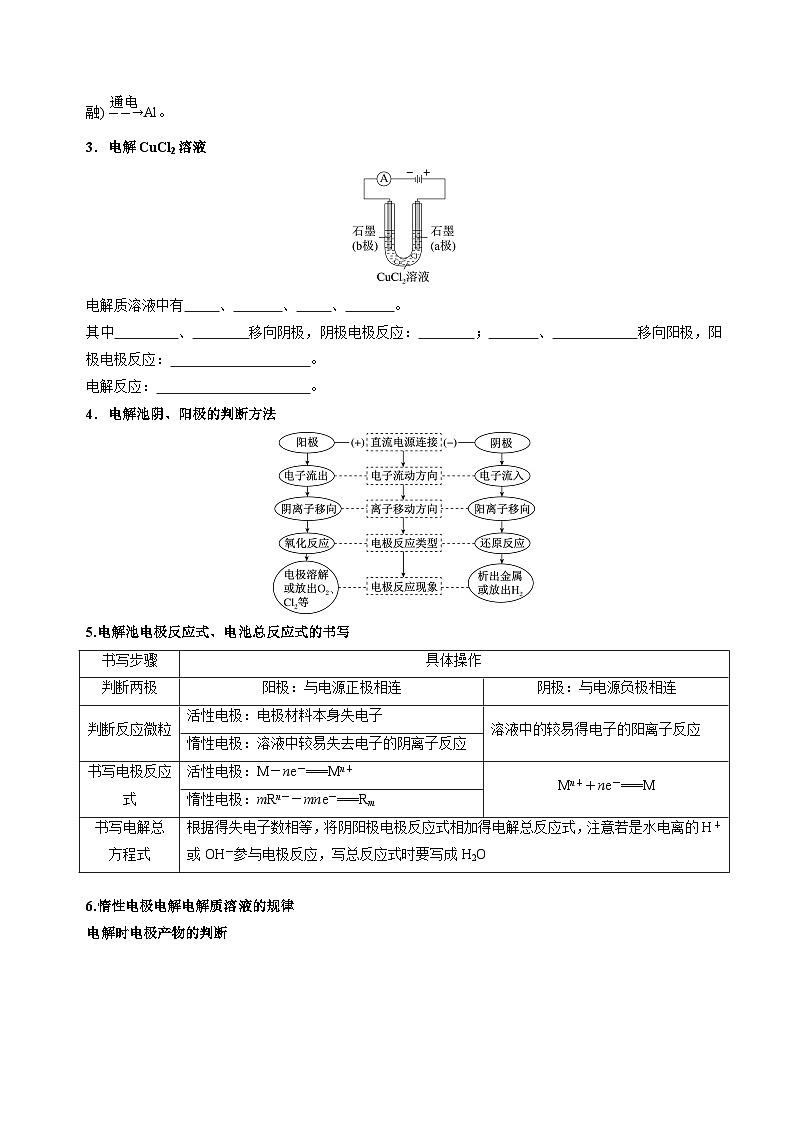
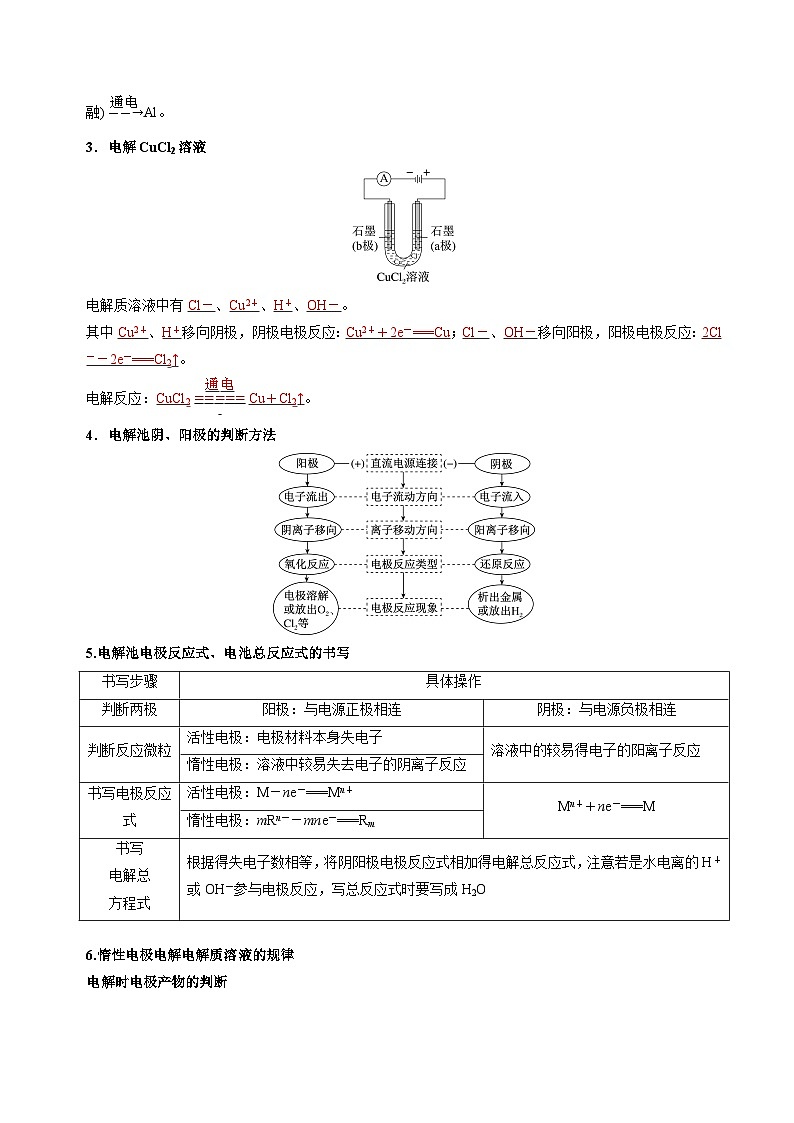
3.电解CuCl2溶液
电解质溶液中有Cl-、Cu2+、H+、OH-。
其中Cu2+、H+移向阴极,阴极电极反应:Cu2++2e-===Cu;Cl-、OH-移向阳极,阳极电极反应:2Cl--2e-===Cl2↑。
电解反应:CuCl2eq \(=====,\s\up17(通电))Cu+Cl2↑。
4.电解池阴、阳极的判断方法
5.电解池电极反应式、电池总反应式的书写
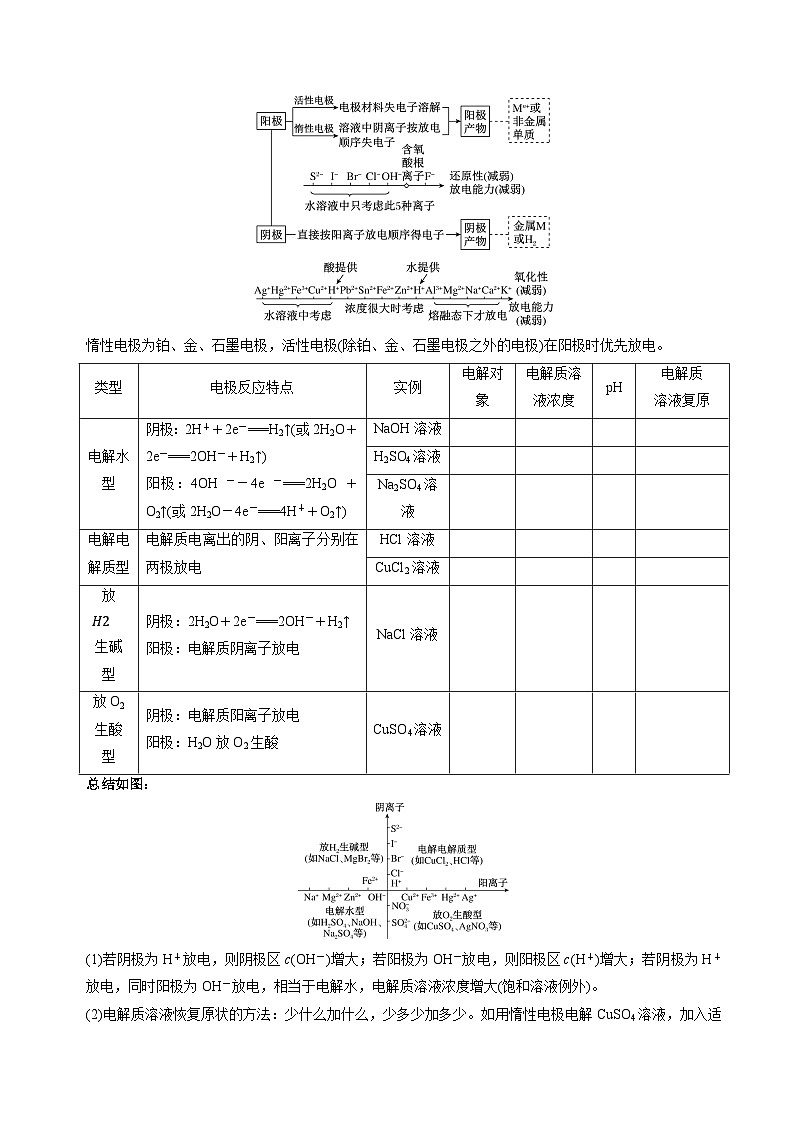
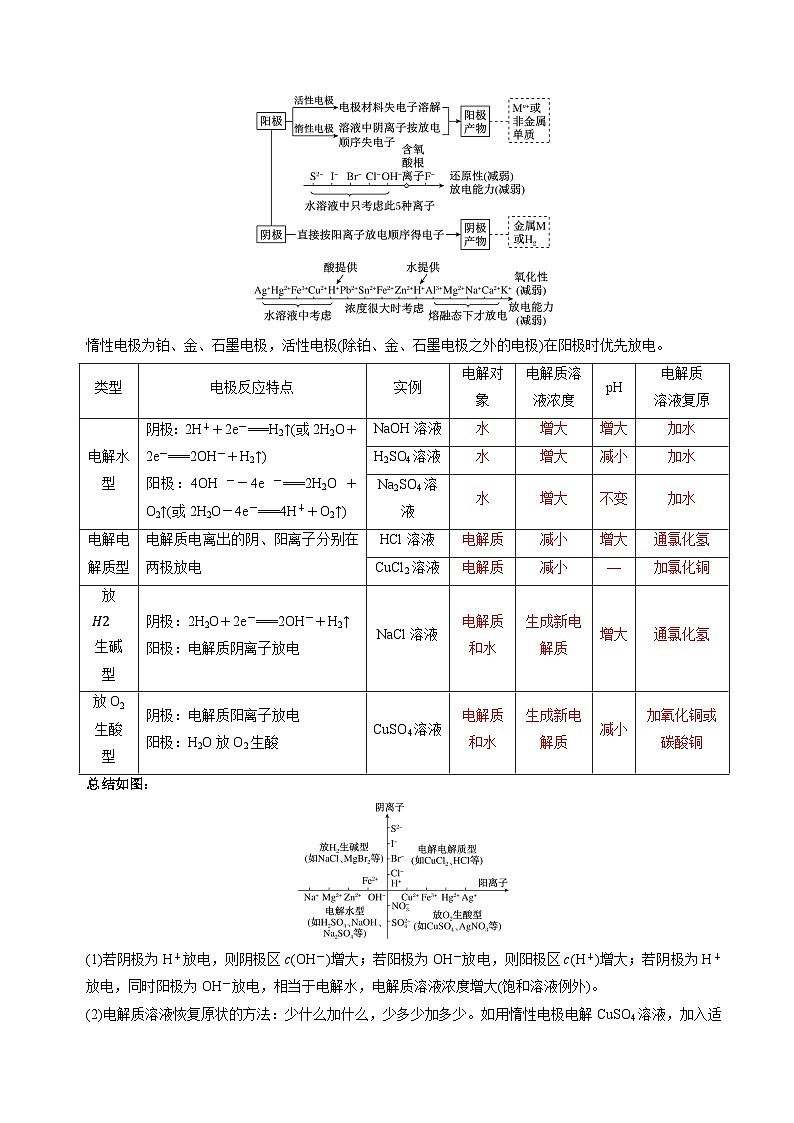
6.惰性电极电解电解质溶液的规律
电解时电极产物的判断
惰性电极为铂、金、石墨电极,活性电极(除铂、金、石墨电极之外的电极)在阳极时优先放电。
总结如图:
(1)若阴极为H+放电,则阴极区c(OH-)增大;若阳极为OH-放电,则阳极区c(H+)增大;若阴极为H+放电,同时阳极为OH-放电,相当于电解水,电解质溶液浓度增大(饱和溶液例外)。
(2)电解质溶液恢复原状的方法:少什么加什么,少多少加多少。如用惰性电极电解CuSO4溶液,加入适量CuO可恢复到电解前的状况而不能加入Cu(OH)2。
课后分层练
1.用石墨电极电解CuCl2溶液(如图)。下列分析正确的是( )
A.a端是直流电源的负极
B.通电使CuCl2发生电离
C.阴极上发生的反应:2Cl--2e-===Cl2↑
D.通电一段时间后,在阴极附近观察到黄绿色气体
[答案] A
[解析]电解过程中,阳离子向阴极移动,阴离子向阳极移动,阴极与直流电源的负极相连,阳极与直流电源的正极相连,A项正确;电解质在溶液中的电离是水分子的作用,与是否通电无关,B项错误;电解过程中阳极上发生的反应为氧化反应,阳极反应为2Cl--2e-===Cl2↑,在阳极附近可观察到黄绿色气体,C、D项错误。
2.用惰性电极进行下列电解,有关说法正确的是( )
①电解稀硫酸 ②电解Cu(NO3)2溶液
③电解KOH溶液 ④电解NaCl溶液
A.电解进行一段时间后四份溶液的pH均增大
B.反应②中电解一段时间后,向溶液中加入适量的CuO固体可使溶液恢复到电解前的情况
C.反应③中阳极消耗OH-,故溶液浓度变小
D.反应④中阴、阳两极上产物的物质的量之比为2∶1
[答案] B
[解析]A项,①②电解后溶液酸性增强,pH减小;B项,反应②为2Cu2++2H2O eq \(=====,\s\up9(通电))2Cu+O2↑+4H+,故加入适量CuO固体可使溶液恢复到电解前的情况;C项,反应③为2H2O eq \(=====,\s\up9(通电))2H2↑+O2↑,故KOH浓度增大;D项,反应④为2Cl-+2H2O eq \(=====,\s\up9(通电))H2↑+Cl2↑+2OH-,阴极产生H2,阳极产生Cl2,二者物质的量之比为1∶1。
3.下列有关用惰性电极电解AgNO3溶液一段时间后的说法,正确的是( )
A.电解过程中阳极的质量不断增加
B.电解过程中溶液的pH不断升高
C.此时向溶液中加入适量的Ag2O固体可使溶液恢复到电解前的状况
D.电解后两极产生的气体体积比为2∶1
[答案] C
[解析]用惰性电极电解AgNO3溶液,总的电解反应式为4AgNO3+2H2O eq \(=====,\s\up9(通电))4Ag+O2↑+4HNO3,阴极上析出Ag,阳极上放出O2,A、D错误;由于生成HNO3,溶液的pH降低,B错误;要使溶液恢复到电解前的状况要加入的物质应是Ag2O,C正确。
4.如图中X、Y分别是直流电源的两极,通电后发现a极板质量增加,b极板处有无色无味气体放出。符合这一情况的是表中的( )
[答案] A
[解析]由a极板质量增加知,溶液中阳离子在a极板处析出,则a为阴极,X为负极,因B中a极板处不析出金属、C中X为正极可知B、C均错误;又由b极板处有无色无味气体放出可知D错误。
5.用惰性电极电解下列溶液,一段时间后,再加入一定质量的另一种物质(中括号内),溶液能与原来溶液完全一样的是( )
A.NaCl[盐酸] B.NaOH[H2O]
C.CuCl2[HCl] D.CuSO4[Cu(OH)2]
[答案] B
[解析]电解NaCl溶液时,阳极氯离子放电生成氯气,阴极氢离子得到电子生成氢气,所以应加HCl让电解质溶液复原,A错误;电解NaOH溶液时,阳极产生氧气,阴极产生氢气,所以应加水让电解质溶液复原,B正确;电解CuCl2溶液时,阳极氯离子放电生成氯气,阴极析出铜,所以应加氯化铜让电解质溶液复原,C错误;电解硫酸铜时,阳极产生氧气,阴极产生金属铜,所以应加CuO或CuCO3让电解质溶液复原,加入氢氧化铜会多生成水,D错误。
6.下列关于如图所示①②两个装置的叙述正确的是( )
A.①是原电池,②是电解池
B.电解质溶液c(H+)的变化:①增大,②减小
C.①中阳极的电极反应式为4OH--4e-===2H2O+O2↑,②中正极的电极反应式为Zn-2e-===Zn2+
D.①中H+向阴极移动,②中H+向负极移动
[答案] B
[解析]①中有外加电源,为电解池,②为原电池,A错误;①中电解的是水,硫酸浓度增大,c(H+)增大,②中电池总反应为Zn+H2SO4===ZnSO4+H2↑,硫酸浓度减小,c(H+)减小,B正确;①中阳极的电极反应式为4OH--4e-===2H2O+O2↑,②中正极的电极反应式为2H++2e-===H2↑,C错误;②中H+向正极移动,D错误。
7.用惰性电极电解稀H2SO4、Cu(NO3)2、NaCl的混合液,最初一段时间阴极和阳极上析出的物质分别是( )
A.H2和Cl2B.H2和O2
C.Cu和Cl2D.Cu和O2
[答案] C
[解析]稀H2SO4、Cu(NO3)2、NaCl的混合液,阳离子的放电顺序:Cu2+>H+>Na+,阴离子的放电顺序:Cl->OH->酸根离子,因此用惰性电极电解稀H2SO4、Cu(NO3)2、NaCl的混合液,阳极Cl-先失电子生成Cl2,阴极Cu2+先得电子生成Cu,即最初一段时间阴极和阳极上析出的物质分别是Cu和Cl2,C符合题意。
8.化学研究人员开发出一种生产石灰乳的绿色工艺,其装置如下图所示。装置工作时,下列说法错误的是( )
A.电能转变为化学能
B.X膜为阴离子交换膜
C.电解一段时间后,b极附近c(OH-)增大
D.a极上的电极反应式为2H2O-4e-===4H++O2↑
[答案] B
[解析]该装置是电解池,将电能转变为化学能,A项正确;根据图中信息,左侧加入碳酸钙,中间生成氢氧化钙,左侧生成钙离子向中间移动,则X膜为阳离子交换膜,B项错误;阴极的电极反应式为2H2O+2e-===H2↑+2OH-,生成OH-,故b极附近c(OH-)变大,C项正确;a极上水中氢氧根失去电子生成氧气,电极反应式为2H2O-4e-===4H++O2↑,产生的氢离子溶解碳酸钙,D项正确。故选B。
9.用石墨棒作电极,在Na+、Cu2+、Cl-、SOeq \\al(2-,4)等离子中选出适当离子组成电解质,电解其溶液,写出符合条件的一种电解质的化学式。
(1)当阴极放出H2,阳极放出O2时,电解质是 。
(2)当阴极析出金属,阳极放出O2时,电解质是 。
(3)当阴极放出H2,阳极放出Cl2时,电解质是 。
(4)通过电子的物质的量与阴极析出的金属的物质的量、阳极放出的气体的物质的量之比为4:2:1时,电解质是 。
[答案] (1) Na2SO4 (2)CuSO4 (3)NaCl (4)CuSO4
[解析](1)阴极有H2生成,阳极有O2生成,实质为电解水,故电解质是活泼金属的含氧酸盐,即Na2SO4。(2)实质为放氧气生酸型,即电解质为不活泼金属的含氧酸盐,即CuSO4。(3)实质为放氢气生碱型,即电解质为活泼金属的无氧酸盐,即NaCl。(4)由阳极生成气体与转移电子的物质的量之比为1:4,知阳极产生气体为O2,1 ml O2转移4 ml e-;析出金属与转移电子的物质的量之比为1:2,故金属阳离子为+2价,即Cu2+,故为CuSO4。
10.用如图所示的装置进行电解。通电后发现湿润的淀粉KI试纸的C端变为蓝色。
(1)E为电源的________极,F为电源的________极。
(2)A中发生反应的化学方程式为__________________________。
(3)在B中观察到的现象是___________________________________。
(4)D端的电极反应式为____________________________________________。
[答案] (1)负 正
(2)4AgNO3+2H2O eq \(=====,\s\up9(通电))4Ag+4HNO3+O2↑
(3)铜片溶解,石墨电极上有气体生成,溶液中有蓝色沉淀生成
(4)2H++2e-===H2↑
[解析] 本题实质上是三个电解装置串联,由题中信息可知C为阳极、D为阴极,则E为负极,F为正极。A中是以Pt为阳极、Fe为阴极电解AgNO3溶液。B中Cu为阳极,发生的反应为Cu-2e-===Cu2+,石墨为阴极,发生的反应为2H++2e-===H2↑,由于水电离出的H+放电,所以溶液中的c(OH-)增大,故溶液中有氢氧化铜蓝色沉淀生成。D端为阴极,发生的电极反应为2H++2e-===H2↑。
11.为了加深对电解规律的理解,某同学做了以下探究,要求从H+、Cu2+、Na+、SO eq \\al(\s\up11(2-),\s\d4(4))、Cl- 5种离子中两两恰当的组成电解质,按下列要求进行电解:
(1)以碳棒为电极,电解过程中电解质质量减少,水量不变,则采用的电解质是________________。若要恢复到电解前的状态,应加入的物质是________________。
(2)以碳棒为电极,电解过程中电解质质量不变,水量减少,则采用的电解质是________________。若要恢复到电解前的状态,应加入的物质是________。
(3)以碳棒为阳极,铁棒为阴极,电解过程中电解质和水量都减少,则电解质是________________。若要恢复到电解前的状态,应加入的物质是________________。
[答案] (1)HCl、CuCl2 HCl、CuCl2
(2)Na2SO4、H2SO4 H2O
(3)CuSO4、NaCl CuO或CuCO3、HCl
[解析] (1)以碳棒为电极,电解过程中电解质质量减少,水量不变,则阳离子只能为H+、Cu2+,阴离子只能是Cl-,其电解质是HCl、CuCl2。
(2)实质上是电解水,H+、OH-分别在两极上放电,因此,其电解质是Na2SO4、H2SO4。
(3)电解质是CuSO4,2CuSO4+2H2O eq \(=====,\s\up9(通电))2H2SO4+2Cu+O2↑,若恢复到原状态,可加入CuO,也可加入CuCO3。电解质是NaCl,2NaCl+2H2O eq \(=====,\s\up9(通电))2NaOH+H2↑+Cl2↑,要恢复到原状态可通入HCl。
1.如图为用惰性电极电解CuCl2溶液的实验装置,则下列说法正确的是( )
A.a极为负极
B.溶液中的Cu2+向a极移动
C.电解一段时间后溶液的颜色会变浅
D.b极上发生的电极反应式为2Cl--2e-===Cl2↑
[答案]C
[解析]a极与电源的正极相连,是电解池的阳极,A错误;电解过程中阳离子向阴极移动,b为阴极,则Cu2+向b极移动,B错误;溶液中的Cu2+显蓝色,Cu2+在阴极放电生成Cu,浓度不断减小,所以溶液的颜色会变浅,C正确;b极为阴极,发生还原反应,电极反应式为Cu2++2e-===Cu,D错误。
2.为探究电解的放电规律,进行如下实验:
下列说法错误的是( )
A.对比①②可知,阴极放电顺序是Cu2+>H+>Na+
B.对比①③可知,阳极放电顺序是Cl->OH->SOeq \\al(2-,4)
C.对比③④可知,阳极是铜时,会先于溶液中的离子放电
D.对比①⑤可知,电解得到金属只能用熔融态,不能用水溶液
[答案]D
[解析]①中阳离子是Cu2+和H+,阴极产物是Cu,放电顺序:Cu2+>H+,②中阳离子是Na+和H+,阴极产物是H2,放电顺序:H+>Na+,综上所述,放电顺序:Cu2+>H+>Na+,A正确;根据①知道离子放电顺序:Cl->OH-,根据③知道离子放电顺序:OH->SOeq \\al(2-,4),B正确;电解池的阳极若是活性电极,则金属电极本身失电子,发生氧化反应,对比③④可知,阳极是铜时,会先于溶液中的离子放电,C正确;电解得到金属不一定只能用熔融态,①中电解氯化铜溶液得到金属铜,D错误。
3.用惰性电极电解下列溶液,一段时间后,再加入一定质量的另一种物质(括号内),能使溶液与原来溶液完全一样的是( )
A.CuCl2(CuSO4)B.NaOH(NaOH)
C.KCl(盐酸)D.CuSO4(CuO)
[答案]D
[解析]电解氯化铜生成铜和氯气,应补充CuCl2,A错误;电解氢氧化钠溶液实际是电解水,应补充水,B错误;电解氯化钾生成氢气、氯气和氢氧化钾,应补充HCl,C错误;电解硫酸铜溶液得到铜、氧气和硫酸,应补充氧化铜,D正确。
4.在水中加等物质的量的Ag+、Ba2+、Na+、SOeq \\al(2-,4)、NOeq \\al(-,3)、Cl-,将该溶液放入用惰性材料作电极的电解槽中,通电片刻,则氧化产物与还原产物的质量比为( )
A.35.5:108B.16:1
C.108:35.5D.8:1
[答案]D
[解析]在水中加等物质的量的Ag+、Cl-反应生成氯化银沉淀,Ba2+、SOeq \\al(2-,4)反应生成硫酸钡沉淀,故所得溶液中含Na+、NOeq \\al(-,3) ,通电片刻,Na+、NOeq \\al(-,3)均不放电,水提供的H+、OH-分别在阴极和阳极上放电,则氧化产物为氧气,还原产物为氢气,电极上得失电子数相等,该反应相当于电解水,故氧化产物与还原产物的质量比为8:1。
5.利用如图所示装置(电极均为惰性电极)可吸收SO2,并用阴极排出的溶液吸收NO2。下列说法正确的是( )
A.b为直流电源的正极
B.将装置中的阳离子交换膜换成阴离子交换膜,电极反应式不变
C.阳极的电极反应式为SO2+2H2O-2e-===SOeq \\al(2-,4)+4H+
D.电解时,H+由阴极室通过阳离子交换膜到阳极室
[答案]C
[解析]二氧化硫被氧化为硫酸根离子,所以二氧化硫所在的区为阳极区,阳极与电源正极相连,则b为电源负极,故A错误;将装置中的阳离子交换膜换成阴离子交换膜,电极反应式发生改变,故B错误;阳极的电极反应式为SO2+2H2O-2e-===SOeq \\al(2-,4)+4H+,故C正确;电解时,阳离子移向阴极,所以H+由阳极室通过阳离子交换膜到阴极室,故D错误。
6.一种电解法制备高纯铬和硫酸的简单装置如图所示。下列说法不正确的是( )
A.a为直流电源的负极
B.阳极反应式为2H2O-4e-===O2↑+4H+
C.若有1 ml离子通过A膜,理论上阳极生成5.6 L气体
D.甲池中硫酸根离子通过交换膜进入乙池
[答案]C
[解析]分析可知,Cr棒为阴极,a连接电解池阴极,a为负极,A正确;石墨电极为阳极,阳极反应式为2H2O-4e-===O2↑+4H+,B正确;丙池中氢离子通过A膜进入乙池,若有1 ml离子通过A膜,则转移电子1 ml,由于不确定是否为标况不能确定生成气体的体积,C错误;电解池中阴离子向阳极移动,甲池中硫酸根离子通过阴离子交换膜进入乙池,D正确。故选C。
7.光电池在光照条件下可产生电压,如下装置可以实现光能源的充分利用,双极性膜可将水解离为H+和OH-,并实现其定向通过。下列说法不正确的是( )
A.该装置将光能转化为化学能并分解水
B.再生池中的反应:2V2++2H2Oeq \(=====,\s\up17(催化剂))2V3++2OH-+H2↑
C.光照过程中阳极区溶液中的n(OH-)基本不变
D.双极性膜可控制其两侧溶液分别为酸性和碱性
[答案]B
[解析]该装置将光能转化为化学能并分解水,A正确;再生池中的反应:2V2++2H+eq \(=====,\s\up17(催化剂))2V3++H2↑,B错误;光照过程中阳极区反应式为4OH--4e-===2H2O+O2↑,双极性膜可将水解离为H+和OH-,其中OH-进入阳极,所以溶液中的n(OH-)基本不变,C正确;双极性膜可将水解离为H+和OH-,由图可知,H+进入阴极,OH-进入阳极,则双极性膜可控制其两侧溶液分别为酸性和碱性,D正确。故选B。
8.病毒对消毒剂敏感,75%酒精、双氧水等均可灭活病毒。现有一种直接通过电化学合成H2O2的方法,装置如图。下列叙述错误的是( )
A.该装置的工作原理是将化学能转化成电能
B.b极发生的电极反应为O2+H2O+2e-===HOeq \\al(-,2)+OH-
C.电池工作时,内部发生反应:HOeq \\al(-,2)+OH-+2H+===H2O2+H2O
D.电路中通过2 ml电子,消耗氧气22.4 L(标准状况)
[答案]A
[解析]该装置是电解池,将电能转化为化学能,A错误;b电极为阴极,O2得电子生成HOeq \\al(-,2),电极反应式为O2+H2O+2e-===HOeq \\al(-,2)+OH-,B正确;装置中阴极生成HOeq \\al(-,2)、OH-,阳极生成H+,所以电池工作时,内部生成的HOeq \\al(-,2)、OH-与H+反应生成H2O2和H2O,C正确;b电极为阴极,电极反应式为O2+H2O+2e-===HOeq \\al(-,2)+OH-,电路中通过2 ml电子,消耗1 ml O2,标准状况下的体积为22.4 L,D正确。
9.三室式电渗析法处理含NH4NO3废水的原理如图所示,在直流电源的作用下,两膜中间的NHeq \\al(+,4)和NOeq \\al(-,3)可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室。工作一段时间后,在两极区均得到副产品NH4NO3,下列叙述正确的是( )
A.a极为电源负极,b极为电源正极
B.c膜是阴离子交换膜,d膜是阳离子交换膜
C.阴极电极反应式为2NOeq \\al(-,3)+12H++10e-===N2↑+6H2O
D.当电路中通过2 ml电子的电量时,阴极产生标准状况下11.2 L的H2
[答案]A
[解析]根据题意,两极区均得到副产品NH4NO3,则Ⅱ室中的NHeq \\al(+,4)通过c膜进入Ⅰ室与稀硝酸混合形成NH4NO3,NOeq \\al(-,3)通过d膜进入Ⅲ室与氨水混合形成NH4NO3,所以c膜为阳离子交换膜,d膜是阴离子交换膜;根据电解液中阳离子向阴极移动,阴离子向阳极移动,可知左侧石墨为阴极,右侧石墨为阳极,a极为电源负极,b极为电源正极,故A正确,B错误;左侧石墨为阴极,阴极电极反应式为 2H++2e-===H2↑,故C错误;阴极电极反应式为 2H++2e-===H2↑,电路中通过2 ml电子的电量时,阴极产生H2为1 ml,即标准状况下22.4 L,故D错误。故选A。
10.将等物质的量浓度的CuSO4和NaCl等体积混合后,用石墨电极进行电解,电解过程可分为三个阶段,则下列说法正确的是( )
①阴极先析出Cl2,后析出O2,阳极先产生Cu,后析出H2
②第一阶段阳极只产生Cl2,阴极只产生Cu
③第二阶段在阴极上H+放电产生H2
④第三阶段相当于电解水
A.①②B.③④
C.①③D.②④
[答案]D
[解析]三个阶段分别电解CuCl2、CuSO4、H2SO4。①阴极发生还原反应,阳极发生氧化反应,根据离子放电顺序知,阳极先析出Cl2,后析出O2,阴极先产生Cu,后析出H2,错误;②阳极上Cl-先放电、阴极上Cu2+先放电,所以第一阶段阳极只产生Cl2,阴极只产生Cu,正确;③第二阶段阴极上Cu2+放电生成铜,错误;④第三阶段,阳极上OH-放电、阴极上H+放电,所以相当于电解水,正确。
11.利用所学电化学反应原理,解决以下问题:
(1)如图是电解未知浓度的硝酸银溶液的示意图,请根据要求答题。
①Fe电极叫做 极,C电极的反应式为 。
②电解一段时间后,某电极的固体质量增重21.6 g,整个装置共产生气体(标准状况下)体积2.24 L,推断该气体的组成: 。
(2)图中甲池的总反应式为 。
①甲池中负极上的电极反应式为 。
②乙池中石墨电极上发生的反应为 。
③要使乙池恢复到电解前的状态,应向溶液中加入适量的 。
A.CuOB.Cu(OH)2
C.CuCO3D.CuSO4
(3)某科研小组用SO2为原料制取硫酸。
①利用原电池原理,用SO2、O2和H2O来制备硫酸,该电池用多孔材料作电极,它能吸附气体,同时也能使气体与电解质溶液充分接触。请写出该电池负极的电极反应式: 。
②用Na2SO3溶液充分吸收SO2得NaHSO3溶液,然后电解该溶液可制得硫酸。电解原理示意图如图。请写出开始时阳极反应的电极反应式: 。
[答案](1) 阴 4OH--4e-===2H2O+O2↑ H2和O2
(2)N2H4+O2===N2+2H2O。
N2H4+4OH--4e-===N2↑+4H2O。
2H2O-4e-===O2↑+4H+ AC
(3)SO2+2H2O-2e-===SOeq \\al(2-,4)+4H+
HSOeq \\al(-,3)+H2O-2e-===SOeq \\al(2-,4)+3H+。
[解析](1)①Fe电极连接的是电源的负极,因此为电解池的阴极,C电极为阳极,是水中氢氧根失去电子,其电极反应式为4OH--4e-===2H2O+O2↑。②当某电极的固体质量增重21.6 g时,则为铁电极上生成银单质的物质的量为0.2 ml,阳极生成氧气,则根据得失电子守恒和4Ag~O2,则生成银时得到的氧气物质的量为eq \f(0.2 ml,4)=0.05 ml,体积为22.4 L•ml-1×0.02 ml=1.12 L,而整个装置共产生气体(标准状况下)体积2.24 L即0.1 ml,则说明阴极银离子反应完后,氢离子开始反应,因此该气体的组成H2和O2。(2)甲池中的总反应式为N2H4+O2===N2+2H2O。①根据甲池总反应得到甲池为原电池,N2H4中氮化合价升高,作原电池负极,因此甲池中负极上的电极反应式为N2H4+4OH--4e-===N2↑+4H2O。②乙池中石墨连接电源的正极,石墨为阳极,其电极上发生的反应为2H2O-4e-===O2↑+4H+。③乙池电解得到铜和氧气,只需将生成的两种物质反应即得到氧化铜,再加入反应后的溶液中就能使乙池恢复到电解前的状态,应向溶液中加入适量的氧化铜,而碳酸铜加入后释放出二氧化碳,相当于加入的是氧化铜。(3)①利用原电池原理,用SO2、O2和H2O来制备硫酸,SO2中S化合价升高,为原电池负极,因此电池负极的电极反应式:SO2+2H2O-2e-===SOeq \\al(2-,4)+4H+。②用Na2SO3溶液充分吸收SO2得NaHSO3溶液,然后电解该溶液可制得硫酸,HSOeq \\al(-,3)失去电子得到硫酸,为电解池的阳极,因此开始时阳极反应的电极反应式:HSOeq \\al(-,3)+H2O-2e-===SOeq \\al(2-,4)+3H+。
书写步骤
具体操作
判断两极
阳极:与电源正极相连
阴极:与电源负极相连
判断反应微粒
活性电极:电极材料本身失电子
溶液中的较易得电子的阳离子反应
惰性电极:溶液中较易失去电子的阴离子反应
书写电极反应式
活性电极:M-ne-===Mn+
Mn++ne-===M
惰性电极:mRn--mne-===Rm
书写
电解总
方程式
根据得失电子数相等,将阴阳极电极反应式相加得电解总反应式,注意若是水电离的H+或OH-参与电极反应,写总反应式时要写成H2O
类型
电极反应特点
实例
电解对象
电解质溶液浓度
pH
电解质
溶液复原
电解水型
阴极:2H++2e-===H2↑(或2H2O+2e-===2OH-+H2↑)
阳极:4OH--4e-===2H2O+O2↑(或2H2O-4e-===4H++O2↑)
NaOH溶液
水
增大
增大
加水
H2SO4溶液
水
增大
减小
加水
Na2SO4溶液
水
增大
不变
加水
电解电解质型
电解质电离出的阴、阳离子分别在两极放电
HCl溶液
电解质
减小
增大
通氯化氢
CuCl2溶液
电解质
减小
—
加氯化铜
放 eq \a\vs4\al(H2)
生碱
型
阴极:2H2O+2e-===2OH-+H2↑
阳极:电解质阴离子放电
NaCl溶液
电解质和水
生成新电解质
增大
通氯化氢
放O2
生酸
型
阴极:电解质阳离子放电
阳极:H2O放O2生酸
CuSO4溶液
电解质和水
生成新电解质
减小
加氧化铜或碳酸铜
选项
a极板
b极板
X电极
Z溶液
A
锌
石墨
负极
CuSO4
B
石墨
石墨
负极
NaOH
C
银
铁
正极
AgNO3
D
铜
石墨
负极
CuCl2
序号
阳极材料
阴极材料
电解质
阳极产物
阴极产物
①
石墨
石墨
0.1 ml•L-1 CuCl2溶液
Cl2
Cu
②
石墨
石墨
0.1 ml•L-1 NaCl溶液
Cl2
H2
③
石墨
石墨
0.2 ml•L-1 CuSO4溶液
O2
Cu
④
铜
石墨
0.2 ml•L-1 CuSO4溶液
Cu2+
Cu
⑤
石墨
石墨
熔融NaCl
Cl2
Na
苏教版 (2019)选择性必修1第二单元 化学能与电能的转化精品课后练习题: 这是一份苏教版 (2019)选择性必修1<a href="/hx/tb_c4009311_t7/?tag_id=28" target="_blank">第二单元 化学能与电能的转化精品课后练习题</a>,文件包含121化学能与电能的转化原电池的工作原理原卷版docx、121化学能与电能的转化原电池的工作原理解析版docx等2份试卷配套教学资源,其中试卷共25页, 欢迎下载使用。
沪科技版(2020)选择性必修1电解池的工作原理精品练习: 这是一份沪科技版(2020)选择性必修1<a href="/hx/tb_c4036464_t7/?tag_id=28" target="_blank">电解池的工作原理精品练习</a>,文件包含431电解池电解池的工作原理分层练习原卷版docx、431电解池电解池的工作原理分层练习解析版docx等2份试卷配套教学资源,其中试卷共25页, 欢迎下载使用。
化学选择性必修1第二单元 化学能与电能的转化课后复习题: 这是一份化学选择性必修1第二单元 化学能与电能的转化课后复习题,共28页。试卷主要包含了单选题,填空题,实验探究题等内容,欢迎下载使用。













