






高中化学苏教版 (2019)选择性必修1第二单元 化学反应的方向与限度试讲课ppt课件
展开1.通过了解判断化学反应进行方向的三个判据,构建判断化学反应自发性的思维方法模型。2.通过三个判据的发展过程,理解科学知识的曲折发展历程,增强对化学反应自发性研究重要意义的认识。
为什么冰置于室温下会慢慢融化?
自然界的一些过程是自发进行的,而且是有方向性的。
瀑布为何总是从高处落向低处?
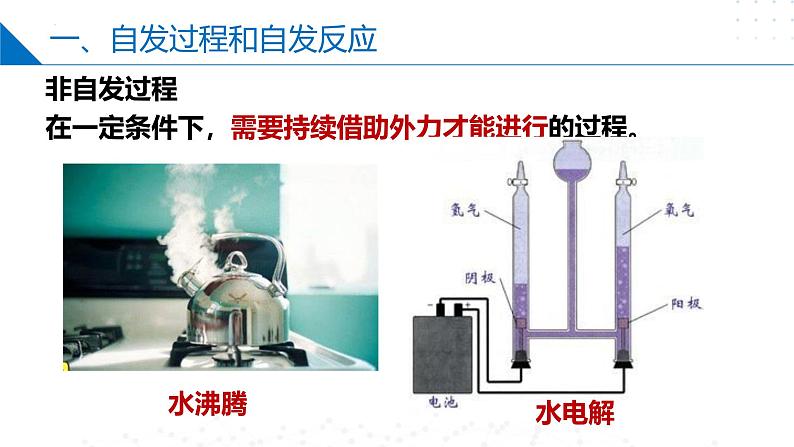
一、自发过程和自发反应
在一定条件下,需要持续借助外力才能进行的过程。
根据条件判断:不是看是否需要条件,而是看是否需要持续施加外力(如加热等)。
根据其逆向过程是否自发判断:若逆向过程自发,则正向过程一定不自发;若逆向过程不自发,则正向过程一定自发。
与自然界中的许多变化一样,化学反应具有方向性。
有些自发反应需要一定的条件才能发生
有些自发反应的化学反应速率很小
自发过程或反应具有方向性,即过程或反应的某个方向在一定条件下自发进行,而该过程或反应的逆方向在该条件下肯定不能自发进行。
能够自发进行的过程或反应在常温下不一定能够发生,自发性只能用于判断过程或反应的方向,不能确定过程或反应是否一定会发生和发生的速率。
二、化学反应进行方向的判据
1. C3H8(g)+5O2(g)=3CO2(g)+4H2O(l) ΔH =-2217.5 kJ·ml-12. 2Na(s)+Cl2(g)=2NaCl(s) ΔH =-822 kJ·ml-13. 4Fe(s)+3O2(g)=2Fe2O3(s) ΔH =-1648.4 kJ·ml-14. H2(g)+F2(g)=2HF(g) ΔH =-546.6 kJ·ml-1
下列反应在一定条件下都能自发进行,你知道这些反应能自发进行的可能原因吗?
在恒压下,有些自发进行的化学反应是放热的(ΔH<0)。放热反应过程中体系能量降低。
该反应能自发进行的可能原因是什么?
考察化学反应能否自发进行,不能直接用放热(ΔH<0)或吸热(ΔH>0)作为判断依据。
氯化铵晶体与氢氧化钡晶体的反应是一个吸热反应,该反应在常温下就能自发进行。
焓变是判断反应能否自发进行的一个因素,但不是唯一因素。
分析下列过程能自发进行的可能原因:
1. 硝酸铵的溶解 NH4NO3(s)=NH4+(aq)+NO3-(aq)
溶于水后形成水合离子,无序地分散在溶液中,即体系的混乱度增大
硝酸铵溶解前,晶体中硝酸根离子与铵根离子规则排列
2. 碳酸钙的分解 CaCO3(s)=CaO(s)+CO2(g)3. 氯化铵晶体与氢氧化钡晶体的反应2NH4Cl(s)+Ba(OH)2·8H2O(s)=2NH3(g)+BaCl2(s)+10H2O(l)
碳酸钙分解成二氧化碳气体,氯化铵晶体与氢氧化钡晶体反应生成氨气,气体的产生会导致体系的混乱度增大。
研究表明,一些自发进行的化学反应有趋于体系混乱度增大的倾向。
影响因素:构成物质的微粒之间无规则排列的程度越大,体系的混乱度越大,熵越大。
定义:衡量一个体系混乱度的物理量,符号:S。
a.同一物质:S(高温) S(低温);S(g) S(l) S(s)b.相同条件下的不同物质:分子结构越复杂,熵值 。c.S(混合物) S(纯净物)。
熵变:反应前后体系熵的变化,符号:ΔS。如果发生变化后体系的混乱度增大,那么该过程的ΔS>0;反之,ΔS<0。
(1)H2O(s) →H2O(l) →H2O(g)(2)2NaHCO3(s) Na2CO3(s)+CO2(g)+H2O(g)(3)NaOH(s)=Na+(aq)+OH-(aq)(4)N2(g)+3H2(g) 2NH3(g)
ΔS=S(生成物)-S(反应物)
ΔS<0体系的混乱度减小,不利于反应自发进行,但有些ΔS<0的化学反应也能自发进行。
ΔS>0体系的混乱度增大,有利于反应自发进行,但自发反应不一定ΔS>0。
熵变是判断反应能否自发进行的一个因素,但不是唯一因素。
H2在O2中点燃生成水、NH3与HCl反应生成NH4Cl固体等
体系能量减小和混乱度增加都能促使反应自发进行,焓变和熵变共同制约着化学反应进行的方向。
1876年,吉布斯提出自由能变化ΔG,并认为化学反应总是向着自由能减小(ΔG<0)的方向进行,直至达到平衡。
在等温、等压条件的封闭体系中,
T为热力学温度,为正值
例2 煤炭燃烧过程中会释放出大量的SO2,严重破坏生态环境。采用一定的脱硫技术可以将硫元素以CaSO4的形式固定,从而减少SO2的排放,但是煤炭燃烧过程中产生的CO又会与CaSO4发生化学反应,降低脱硫效率,相关反应的热化学方程式如下:CaSO4(s)+CO(g) CaO(s)+SO2(g)+CO2(g) ΔH1=218.4 kJ•ml-1 (反应Ⅰ)CaSO4(s)+4CO(g) CaS(s)+4CO2(g) ΔH2=-175.6 kJ•ml-1(反应Ⅱ)
下列有关说法正确的是( )A.反应Ⅰ在较低的温度下才可自发进行B.反应Ⅱ在较低的温度下也可自发进行C.用生石灰固硫的反应为4CaO(s)+4SO2(g) 3CaSO4(s)+CaS(s) ΔH3,则ΔH3>ΔH2D.由反应Ⅰ和反应Ⅱ可计算出反应CaSO4(s) CaO(s)+SO3(g)的焓变
化学反应进行方向的判据
焓变熵变ΔG=ΔH-TΔS
1、对于化学反应能否自发进行,下列说法错误的是( )A.若ΔH<0,ΔS>0,则任何温度下反应都能自发进行B.若ΔH>0,ΔS<0,则任何温度下反应都不能自发进行C.若ΔH>0,ΔS>0,则低温时反应可自发进行D.若ΔH<0,ΔS<0,则低温时反应可自发进行
2.下列对化学反应预测正确的是( )
苏教版 (2019)选择性必修1第二单元 化学能与电能的转化试讲课课件ppt: 这是一份苏教版 (2019)选择性必修1<a href="/hx/tb_c4009311_t3/?tag_id=26" target="_blank">第二单元 化学能与电能的转化试讲课课件ppt</a>,文件包含122化学能与电能的转化化学电源同步课件-2023-2024学年高二化学同步精品课堂苏教版2019选择性必修第一册pptx、1-化学铅蓄电池-480P清晰-AVC1mp4、1-两分钟带你看完200年的电池发展史-480P清晰-AVCmp4、1-新能源汽车锂离子电池原理揭秘-480P清晰-AVCmp4、1-氢燃料电池到底如何工作的-480P清晰mp4、两分钟带你看完200年的电池发展史1mp4、干电池原理mp4等7份课件配套教学资源,其中PPT共34页, 欢迎下载使用。
苏教版 (2019)选择性必修1第二单元 化学反应的方向与限度背景图ppt课件: 这是一份苏教版 (2019)选择性必修1<a href="/hx/tb_c4009316_t3/?tag_id=26" target="_blank">第二单元 化学反应的方向与限度背景图ppt课件</a>,文件包含221化学反应的方向同步课件-2023-2024学年高二化学同步精品课堂苏教版2019选择性必修第一册pptx、氢氧化钡晶体与氯化铵晶体的反应mp4等2份课件配套教学资源,其中PPT共0页, 欢迎下载使用。
苏教版 (2019)选择性必修1第二单元 化学反应的方向与限度授课ppt课件: 这是一份苏教版 (2019)选择性必修1<a href="/hx/tb_c4009316_t3/?tag_id=26" target="_blank">第二单元 化学反应的方向与限度授课ppt课件</a>,共1页。













