





苏教版 (2019)选择性必修1第三单元 化学平衡的移动评优课课件ppt
展开1.通过浓度、温度、压强、催化剂等对速率、平衡的影响,建立图像、分析量的变化。2.由外界条件对平衡的影响,建立等效平衡思维,解决问题。
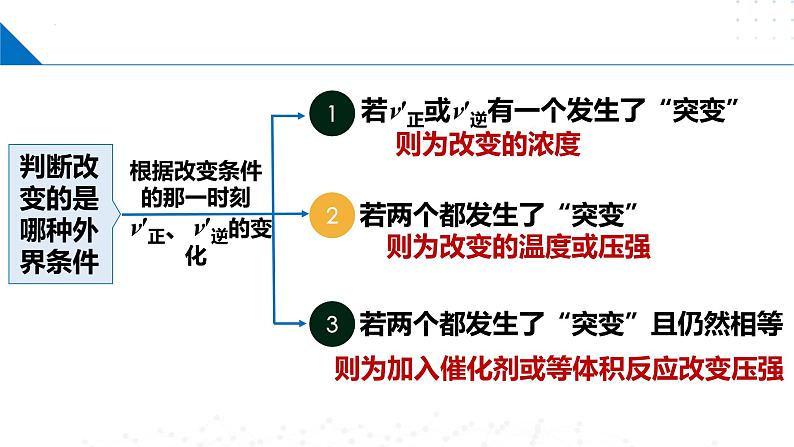
根据v′正、v′逆的相对大小
判断改变的是哪种外界条件
根据改变条件的那一时刻v′正、v′逆的变化
若v′正或v′逆有一个发生了“突变”
若两个都发生了“突变”且仍然相等
若两个都发生了“突变”
则为加入催化剂或等体积反应改变压强
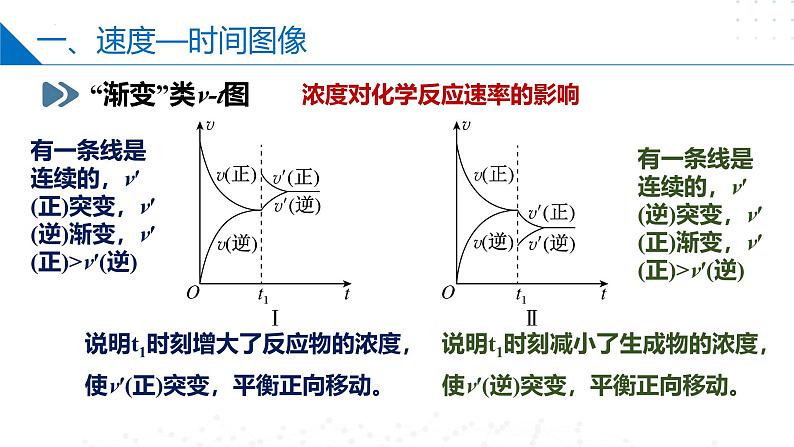
浓度对化学反应速率的影响
有一条线是连续的,v′(正)突变,v′(逆)渐变,v′(正)>v′(逆)
说明t1时刻增大了反应物的浓度,使v′(正)突变,平衡正向移动。
有一条线是连续的,v′(逆)突变,v′(正)渐变,v′(正)>v′(逆)
说明t1时刻减小了生成物的浓度,使v′(逆)突变,平衡正向移动。
温度(或压强)对化学反应速率的影响
v′(正)、v′(逆)都是突然增大的,t1时刻,图像中出现了“断点”,且v′(正)>v′(逆),平衡正向移动。
说明该反应的正反应是吸热反应(或气体分子数减小的反应),改变的外界条件是升高温度(或增大压强)。
v′(正)、v′(逆)都是突然变小的,t1时刻,图像中出现了“断点”,且v′(正)>v′(逆),平衡正向移动。
说明该反应的正反应是放热反应(或气体分子数增大的反应),改变的条件是降低温度(或减小压强)。
催化剂(或压强)对化学反应速率的影响
图像中v′(正)、v′(逆)都是突然增大,且增大的程度相同,t1时刻,图像中出现了“平台”,化学平衡不发生移动,
改变的条件是使用了催化剂或反应前后气体分子数目不发生变化的反应增大了压强。
溶液中c(H+)逐渐减小,v减小。
AB段(v增大),反应放热,
溶液温度逐渐升高,v增大。
Ⅰ.T2 T1,温度升高,平衡 移动,正反应是 反应。
二、百分含量(或转化率)—时间—温度(或压强)图像
Ⅱ.p2 p1,压强增大,A(反应物)的转化率 ,说明正反应是气体总体积 的反应。
Ⅲ.生成物C的百分含量 ,说明平衡 移动,但反应速率a b,故a可能使用了 ;若该反应是反应前后气体总体积不变的可逆反应,a也可能是增大了压强(压缩体积)。
确定横坐标所表示的量,讨论纵坐标与曲线的关系,或者确定纵坐标所表示的量,讨论横坐标与曲线的关系。
105Pa时,A→C温度 ,C%减小,平衡 移动,则正反应是 反应。
T1温度下,A→B压强 ,C%增大,平衡 移动,则正反应是气体分子数 的反应;
①对于反应aA(g)+bB(g) ⇌ cC(g)+dD(g) ΔH<0,M点前,表示化学反应从反应开始到建立平衡的过程,则v正 v逆,M点为 ,M点后为平衡受温度的影响情况。
由于某一条件对平衡的影响只能向一个方向移动,所以最高点(最低点)及以后为平衡状态受条件的影响情况,前面为未达到平衡的情况。
②如图所示曲线是其他条件不变时,某反应物的平衡转化率与温度的关系曲线。图中标出的1、2、3、4四个点,表示v正>v逆的是点 ,表示v正<v逆的是点 ,而点2、4表示v正 v逆。
曲线上的点全为对应条件下的平衡点。
例1 可逆反应mA(g)+nB(s) pC(g)+qD(g),在反应过程中,当其他条件不变时,D的百分含量与温度(T)和压强(p)的关系如图所示,下列叙述中错误的是( )A.达到平衡后,升高温度,平衡向逆反应方向移动B.达到平衡后,若使用催化剂,D的物质的量分数不变C.化学方程式中一定有m
如无论反应从正反应方向开始,还是从逆反应方向开始;投料是一次还是分成几次;反应容器是经过扩大—缩小,还是缩小—扩大的过程,都可运用“一边倒”的方法回到起始的状态进行比较。
只要是等效平衡,达到平衡状态时同一物质的百分含量(体积分数、物质的量分数等)一定相同。
外界条件相同:通常是恒温恒容或恒温恒压。
平衡状态只与始态有关,而与途径无关。
虚拟“中间态”法构建等效平衡(1)构建恒温恒容平衡思维模式新平衡状态可认为是两个原平衡状态简单的叠加并压缩而成,相当于增大压强。
(1)恒温恒容条件下反应前后体积改变的反应判断方法:极值等量即等效。例如:2SO2(g)+O2(g) 2SO3(g)① 2 ml 1 ml 0② 0 0 2 ml③ 0.5 ml 0.25 ml 1.5 ml④ a ml b ml c ml
④中a、b、c关系满足:c+a=2, +b=1,即与上述平衡等效。
①②③三种配比,按化学方程式的化学计量数关系均转化为反应物,则SO2均为2 ml,O2均为1 ml,三者建立的平衡状态完全相同。
虚拟“中间态”法构建等效平衡
(2)构建恒温恒压平衡思维模式(以气体物质的量增加的反应为例,见图示)新平衡状态可以认为是两个原平衡状态简单的叠加,压强不变,平衡不移动。
(2)恒温恒压条件下反应前后体积改变的反应判断方法:极值等比即等效。例如:2SO2(g)+O2(g) 2SO3(g)① 2 ml 3 ml 0② 1 ml 3.5 ml 2 ml③ a ml b ml c ml
按化学方程式的化学计量数关系均转化为反应物,则①②中 ,故互为等效平衡。
③中a、b、c三者关系满足: ,即与①②平衡等效。
(3)恒温条件下反应前后体积不变的反应判断方法:无论是恒温恒容,还是恒温恒压,只要极值等比即等效,因为压强改变对该类反应的化学平衡无影响。例如:H2(g)+I2(g) 2HI(g)① 1 ml 1 ml 0② 2 ml 2 ml 1 ml③ a ml b ml c ml
③中a、b、c三者关系满足 =1∶1或a∶b=1∶1,c≥0,即与①②平衡等效。
①②两种情况下,n(H2)∶n(I2)=1∶1,故互为等效平衡。
投料换算成相同物质表示时量相同
投料换算成相同物质表示时等比例
两次平衡时各组分百分量、n、c均相同
两次平衡时各组分百分量相同,n、c同比例变化
两次平衡时各组分百分量、c相同n同比例变化
例2.已知2SO2 (g)+O2 (g) 2SO3 (g)ΔH=-197 kJ•ml-1。向同温、同体积的三个密闭容器中分别充入气体:(甲)2 ml SO2和1 ml O2;(乙) 1 ml SO2和0.5 ml O2 ;(丙) 2 ml SO3 。恒温、恒容下反应达平衡时,下列关系一定正确的是( )A.容器内压强p:p甲=p丙>2p乙B.SO3的质量m:m甲=m丙>2m乙C.c(SO2)与c(O2)之比为k:k甲=k丙>k乙D.反应放出或吸收热量的数值Q:Q甲=Q丙>2Q乙
速度—时间图像百分含量(或转化率)—时间—温度(或压强)图像特殊图像
1、工业上可通过甲醇羰基化法制取甲酸甲酯(HCOOCH3):CH3OH(g)+CO(g) HCOOCH3(g),在容积固定的密闭容器中,投入等物质的量CH3OH和CO,测得相同时间内CO的转化率随温度变化曲线如图所示。下列说法不正确的是( )A.增大甲醇蒸气的浓度,CO的转化率增大B.平衡常数K(75 ℃)>K(85 ℃)C.b点反应速率v正=v逆D.生产时反应温度控制在80~85 ℃为宜
2.把晶体N2O4放入一固定容积的密闭容器中气化并建立N2O4(g) 2NO2(g)平衡后,保持温度不变,再通入与起始时等量的N2O4气体,反应再次达平衡,则新平衡时c(NO2)/c(N2O4)与原平衡比,其比值( )A.变大B.变小C.不变D.无法确定
高中化学苏教版 (2019)选择性必修1第二单元 化学反应的方向与限度优秀ppt课件: 这是一份高中化学苏教版 (2019)选择性必修1<a href="/hx/tb_c4009316_t3/?tag_id=26" target="_blank">第二单元 化学反应的方向与限度优秀ppt课件</a>,共27页。PPT课件主要包含了学习目标,课程导入,可逆反应及其特征,可逆反应,典例解析,化学平衡状态,课堂小结等内容,欢迎下载使用。
化学选择性必修1第二节 化学平衡精品ppt课件: 这是一份化学选择性必修1<a href="/hx/tb_c4002420_t3/?tag_id=26" target="_blank">第二节 化学平衡精品ppt课件</a>,共25页。PPT课件主要包含了学习目标,模块一速率图像,新课讲解,m+np+q,模块二平衡图像,正反应吸热,两个变量影响平衡等内容,欢迎下载使用。
高中化学苏教版 (2019)选择性必修1专题2 化学反应速率与化学平衡第三单元 化学平衡的移动课文配套课件ppt: 这是一份高中化学苏教版 (2019)选择性必修1<a href="/hx/tb_c4009317_t3/?tag_id=26" target="_blank">专题2 化学反应速率与化学平衡第三单元 化学平衡的移动课文配套课件ppt</a>,共1页。













