





化学选择性必修1第三单元 化学平衡的移动试讲课课件ppt
展开1.通过化学平衡状态时的浓度数据分析,认识化学平衡常数的概念,并能分析推测其相关应用。2.构建化学平衡常数相关计算的思维模型(三段式法),理清计算的思路,灵活解答各类问题。
回顾:化学平衡状态及判断
当一个可逆反应达到化学平衡状态时,有多少反应物转化成了生成物?反应物和生成物的浓度之间又有怎样的定量关系?
化学平衡状态是在一定条件下可逆反应进行的最大限度。
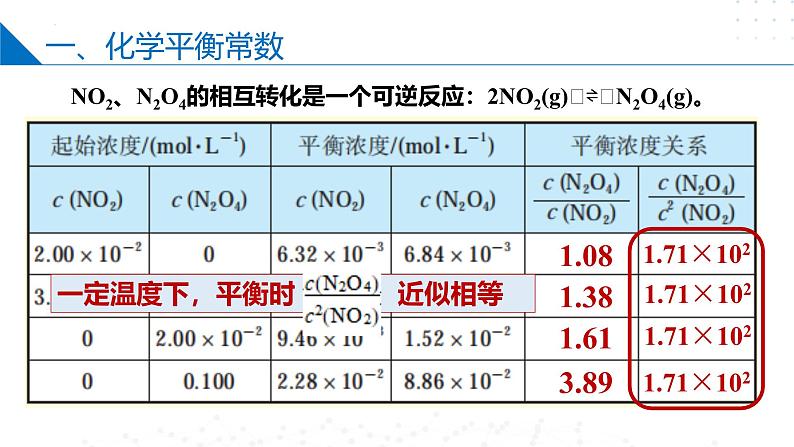
NO2、N2O4的相互转化是一个可逆反应:2NO2(g)⇌N2O4(g)。
一定温度下,平衡时 近似相等
定义:在一定温度下,当一个可逆反应达到化学平衡时,生成物浓度幂之积与反应物浓度幂之积的比值是一个常数(简称平衡常数),用符号K表示。
对于一般的可逆反应 m A(g) + n B(g) p C(g) + q D(g) 在一定温度下达到化学平衡时,各物质平衡时的浓度满足的数学关系式为:
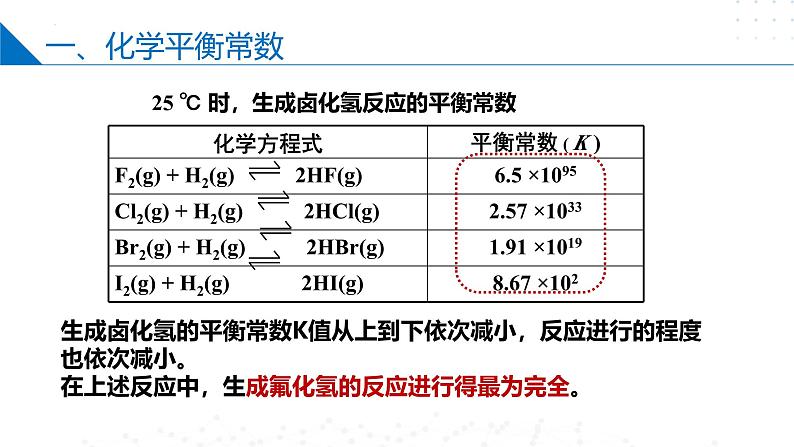
25 ℃ 时,生成卤化氢反应的平衡常数
生成卤化氢的平衡常数K值从上到下依次减小,反应进行的程度也依次减小。在上述反应中,生成氟化氢的反应进行得最为完全。
平衡常数的大小定量反映了化学反应进行的程度。
Lrem ipsum dlr sit amet, cnsectetur adipiscing elit.
K值越大,表示反应进行得越完全,反应物转化率越大;K值越小,表示反应进行得越不完全。
一般地,K>10-5时,认为该反应进行得就基本完全了。当K<10-5时,该正反应很难发生。
1、化学平衡常数的大小反映的是反应进行的程度大小,并不涉及反应时间和化学反应速率。即:某个化学反应的平衡常数很大,可能化学反应速率却很小。
2、化学平衡常数表达式中各物质的浓度必须是平衡时的浓度,且不出现固体、纯液体或水溶液中水的浓度。
25 ℃ 时,生成卤化氢反应的平衡常数
写出下列可逆反应的平衡常数表达式。
K1 和K2、K3是什么关系呢?
若反应方向改变、化学计量数等倍扩大或缩小,化学平衡常数都会相应改变。
已知两反应的平衡常数分别为K1、K2
化学平衡常数表达式与化学方程式的书写有关。
2、若两反应相减,则总反应的平衡常数K=K1/K2。
1、若两反应相加,则总反应的平衡常数K=K1·K2。
4、若两反应的反应物和生成物相同,反应1的系数是反应2 的n倍,则K1=K2n。
3、若两反应互为逆反应,则K1•K2=1。
浓度商:用任意状态的浓度幂之积的比值,用Q 表示
m A(g) + n B(g) p C(g) + q D(g)
Q<K:可逆反应向正反应方向进行。
Q>K:可逆反应向逆反应方向进行;
Q=K:可逆反应处于平衡状态;
判断反应的热效应
利用平衡常数可计算物质的平衡浓度、物质的量分数和转化率等。
若升高温度,K 增大,则正反应为吸热反应;若升高温度,K 减小,则正反应为放热反应。
例1 将固体NH4I置于密闭容器中,在一定温度下发生下列反应:①NH4I(s) NH3(g)+HI(g);②2HI(g) H2(g)+I2(g)。达到平衡时,c(H2)=0.5 ml/L,c(HI)=4 ml/L,下列说法错误的是( )A.①的平衡常数为20B.②的平衡常数为C.同温时H2(g)+I2(g) 2HI(g)和②的平衡常数互为倒数D.温度升高,反应①②的平衡常数可以保持不变
达到化学平衡时,反应达到该条件下物质转化的最大“限度”,即反应物的转化率最大。
平衡转化率与平衡常数均能表示化学反应进行的程度,但平衡常数不直观,转化率能更直观地表示化学反应进行的程度。
某温度下,在容积不变的密闭容器中N2与H2反应达到化学平衡,请根据以下数据计算达到化学平衡时H2的转化率。
起始量/ml 变化量/ml 平衡量/ml
5 15 0
2 6 4
3 9 4
N2 + 3H2 2NH3
aA(g) + bB(g)⇌ cC(g)+dD(g) n1 n2 0 0
c(初)/(ml·L-1)
Δc/(ml·L-1)
c(平)/(ml·L-1)
x x x x
n1-x n2- x x x
根据反应物、生成物及变化量的三者关系代入未知数确定平衡体系中各物质的起始量、变化量、平衡量列表。
明确“始”、“转”、“平”三个量的具体数值,再根据相应关系求平衡时某成分的浓度、反应物转化率等,得出题目答案。
具体题目要具体分析,灵活设立,一般设某物质的转化量为x。
2、多种反应物参加反应时,可通过增加一种反应物的浓度来提高另一种反应物的平衡转化率,而其本身的平衡转化率会降低。
1、在一定温度下,一个具体的化学反应,只有一个平衡常数,但不同反应物的平衡转化率可能不同。
例2 在容积不变的密闭容器中,将2 ml CO(g)与3 ml H2O(g)混合加热到一定温度,发生反应CO(g)+H2O(g) CO2(g)+H2(g),反应达到平衡时,该反应的平衡常数K为1.0。下列说法正确的是( )A.该反应的平衡常数表达式为K=B.反应达到平衡时,c(CO2)+c(H2O)+c(H2)=4.2 ml•L-1C.CO的平衡转化率为40%D.不管反应进行到何种程度,容器中原子个数之比N(H):N(C):N(O)=6:2:5保持不变
三、压强平衡常数及其应用
相同温度下,当某组分气体B单独存在且具有与混合气体总体积相同体积时,该气体B所具有的压强,称为气体B的分压强。
混合气体中某组分的分压=总压×该组分的物质的量分数,pB=p总× 。
混合气体的总压等于相同温度下各组分气体的分压之和,即p总=pA+pB+pC+…
一定温度下,气相反应达平衡时,气态生成物分压幂之积与气态反应物分压幂之积的比值为一个常数,称为该反应的压强平衡常数,用符号Kp表示
一定温度下,向密闭容器中加入焦炭(C)和一定量的CO2气体,保持a kPa条件下发生反应:C(s)+CO2(g)⇌2CO(g),平衡时测得CO2的体积分数为60%。(1)CO2的转化率为______________。(2)CO2的分压为______ kPa,CO的分压为________ kPa。(3)该温度下,该反应的平衡常数Kp=________ kPa(用a表示,保留两位小数)。
1、在某温度下,将H2和I2各0.1 ml的气态混合物充入10 L的密闭容器中,发生反应H2(g)+I2(g) 2HI(g),连续测定c(I2)的变化,5 s时测定c(I2)=0.008 0 ml•L-1并保持不变。则:(1)反应的平衡常数的表达式是K=___________。(2)此温度下,平衡常数的值为______。(3)若在此温度下,在10 L的密闭容器中充入0.2 ml HI气体,达到平衡时,HI的转化率为______。
高中化学苏教版 (2019)选择性必修1第二单元 化学反应的方向与限度优秀ppt课件: 这是一份高中化学苏教版 (2019)选择性必修1<a href="/hx/tb_c4009316_t3/?tag_id=26" target="_blank">第二单元 化学反应的方向与限度优秀ppt课件</a>,共27页。PPT课件主要包含了学习目标,课程导入,可逆反应及其特征,可逆反应,典例解析,化学平衡状态,课堂小结等内容,欢迎下载使用。
苏教版 (2019)选择性必修1第二单元 化学能与电能的转化试讲课课件ppt: 这是一份苏教版 (2019)选择性必修1<a href="/hx/tb_c4009311_t3/?tag_id=26" target="_blank">第二单元 化学能与电能的转化试讲课课件ppt</a>,文件包含122化学能与电能的转化化学电源同步课件-2023-2024学年高二化学同步精品课堂苏教版2019选择性必修第一册pptx、1-化学铅蓄电池-480P清晰-AVC1mp4、1-两分钟带你看完200年的电池发展史-480P清晰-AVCmp4、1-新能源汽车锂离子电池原理揭秘-480P清晰-AVCmp4、1-氢燃料电池到底如何工作的-480P清晰mp4、两分钟带你看完200年的电池发展史1mp4、干电池原理mp4等7份课件配套教学资源,其中PPT共34页, 欢迎下载使用。
高中化学苏教版 (2019)选择性必修1第三单元 化学平衡的移动教课课件ppt: 这是一份高中化学苏教版 (2019)选择性必修1<a href="/hx/tb_c4009317_t3/?tag_id=26" target="_blank">第三单元 化学平衡的移动教课课件ppt</a>,文件包含233化学平衡常数同步课件-2023-2024学年高二化学同步精品课堂苏教版2019选择性必修第一册pptx、化学平衡状态的判断mp4等2份课件配套教学资源,其中PPT共0页, 欢迎下载使用。













