





苏教版 (2019)选择性必修1专题3 水溶液中的离子反应第一单元 弱电解质的电离平衡精品课件ppt
展开1.通过分析、推理等方法认识强弱电解质的本质特征及电离平衡常数的意义,建立判断强弱电解质和“强酸制弱酸”的思维模型。2.知道弱电解质在水溶液中存在电离平衡,能正确书写弱电解质的电离方程式,会分析电离平衡的移动。
为什么不同的酸其酸性有强弱之分呢?
常温时,测定0.1 ml/L 盐酸、0.1 ml/L 醋酸的pH。
0.1 ml/L 盐酸 pH=1
0.1 ml/L 醋酸 pH=3
一、强电解质和弱电解质
等浓度的盐酸比醋酸溶液电离出的c(H+)大
盐酸的电离程度大于醋酸。
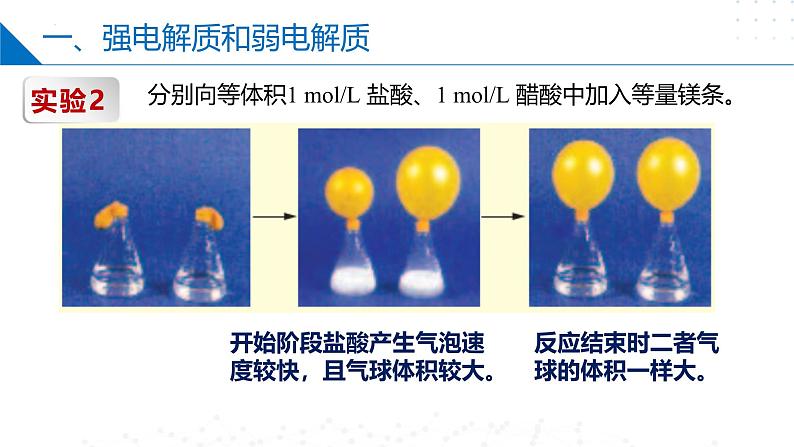
分别向等体积1 ml/L 盐酸、1 ml/L 醋酸中加入等量镁条。
开始阶段盐酸产生气泡速度较快,且气球体积较大。
反应结束时二者气球的体积一样大。
2、随反应的进行,醋酸还能继续电离H+,最终提供的n(H+)与盐酸相同。
1、金属与酸溶液反应生成盐和氢气,其本质是金属与酸电离出的氢离子发生反应,反应速率主要取决于溶液中的c(H+)。等浓度的盐酸比醋酸溶液电离出的c(H+)大,前者的反应速率明显更大。
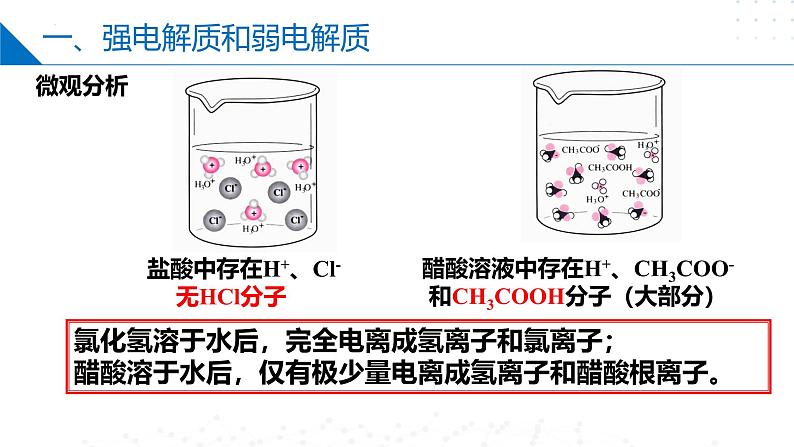
氯化氢溶于水后,完全电离成氢离子和氯离子;醋酸溶于水后,仅有极少量电离成氢离子和醋酸根离子。
盐酸中存在H+、Cl- 无HCl分子
醋酸溶液中存在H+、CH3COO-和CH3COOH分子(大部分)
在水溶液里或熔融状态下全部电离成离子的电解质。
在水溶液里只有部分分子电离成离子的电解质。
如HCl溶于水完全电离成H+和Cl-。
如氨水中只有少部分一水合氨分子电离成OH-和NH4+,大部分仍以分子的形式存在。
①强酸:HCl、HBr、HI、H2SO4、HNO3、HClO4等②强碱:NaOH、KOH、Ba(OH)2、Ca(OH)2等③绝大多数盐:如NaCl、(NH4)2SO4、BaSO4等 ④活泼金属氧化物:Na2O、CaO等
①弱酸:HF、HClO、CH3COOH、H2CO3、H2S、H2SO3、H3PO4 等。②弱碱:NH3·H2O、Fe(OH)3、Al(OH)3、Cu(OH)2等 ③水是极弱的电解质。④少数盐:(CH3COO)2Pb
强电解质、弱电解质与其溶解性无关
不正确。BaSO4是难溶性盐,其溶液中自由移动的离子浓度很小,但溶于水的BaSO4完全电离成Ba2+和SO42-,故BaSO4是强电解质。醋酸部分电离,0.1 ml·L-1醋酸溶液中离子浓度较小,因而醋酸是弱电解质。
BaSO4饱和溶液和0.1 ml·L-1醋酸溶液导电能力都很弱,因而它们都是弱电解质,是否正确?
溶液的导电能力取决于溶液的离子浓度和离子所带的电荷,与电解质的强弱无关。
H2SO4 2H+ + SO
2− 4
CH3COOH CH3COO− + H+
多元弱酸是分步电离的(其中以第一步电离为主),电离程度逐步减弱,要分步书写电离方程式,不能一步完成。如H2CO3的电离方程式是
H2CO3 H++HCO3-(主要)
HCO3- H++CO32- (次要)
多元弱碱的电离也是分步进行的,但是一般按一步电离的形式写。如Fe(OH)3的电离方程式: Fe(OH)3 Fe3++3OH-
HCO3- H++CO32-
= Na++HCO3-
【规律】 强等号,弱可逆;多元弱酸分步写;多元弱碱一步完。
= Na++H+ +SO42-
第一步完全电离;酸根阴离子部分电离
二、弱电解质的电离平衡
CH3COOH+H2O H3O++CH3COO−
H3O+中的H2O可省略不写
CH3COOH H++CH3COO−
在一定的条件下,往一杯水中加进一定量的冰醋酸会发生如何的变化?
V(电离) = V(结合) 电离平衡状态
弱电解质电离平衡状态建立示意图
醋酸电离过程中CH3COOH分子电离成离子的速率与离子结合成CH3COOH分子的速率的变化图像:
电离平衡也是一种化学平衡
在一定温度下,当弱电解质在水溶液中的电离达到最大限度时,电离过程并未停止。此时弱电解质分子电离成离子的速率与离子结合成弱电解质分子的速率相等,溶液中电解质分子和离子的浓度都不再发生变化,弱电解质的电离达到了电离平衡状态。
如0.1 ml·L-1的CH3COOH溶液中,c(H+)在1×10-3 ml·L-1左右。
弱电解质的电离属于可逆过程,分子、离子共存。
弱电解质在溶液中的电离都是微弱的。
电离方向是微粒数增多的过程。
弱电解质的电离是可逆过程
v(电离) = v(结合) ≠0
电离平衡是一种动态平衡
溶液中各分子、离子的浓度不变。
条件改变时,电离平衡发生移动
平衡移动规律—勒夏特列原理
当外界条件改变时符合“勒夏特列原理”
内因:电解质本身的性质。通常电解质越弱电离程度越小。
弱电解质的电离一般是吸热过程,升高温度使电离平衡向电离的方向移动,电离程度增大。
在一定温度下,同一弱电解质溶液,浓度越小,离子相互碰撞结合为分子的几率越小,电离程度越大。
加水稀释能促进弱电解质的电离,弱电解质的电离程度增大,但离子浓度却是减小的。
如0.1 ml/L CH3COOH溶液加水稀释,溶液中c(H+)、c(CH3COOH)、c(CH3COO-)都是降低的。
加入能与弱电解质电离出的离子发生反应的离子时,电离平衡向电离的方向移动,电离程度增大。
加入与弱电解质具有相同离子的电解质时,可使电离平衡向结合成弱电解质分子的方向移动,电离程度减小。
注意:加入同浓度的弱电解质溶液→平衡不移动→各微粒浓度不变、电离程度不变
c(H+)决定反应速率的大小,n(H+)决定消耗n(NaOH)及产生n(H2)。
同体积、同物质的量浓度的一元强酸与一元弱酸的比较
同体积、同c(H+)(等pH)的一元强酸与一元弱酸的比较
酸溶液中c(H+)的大小。0.1 ml·L-1HA溶液中c(H+)<0.1 ml·L-1;将c(H+)=1×10-2ml·L-1的HA溶液稀释100倍,稀释后溶液中1×10-4 ml·L-1<c(H+)<1×10-2 ml·L-1。
溶液导电能力的强弱。0.1 ml·L-1 HCl溶液和0.1 ml·L-1 HA溶液,前者的导电能力明显强。
与活泼金属反应速率的大小。相同物质的量浓度的HCl溶液和HA溶液,与(形状、颗粒大小)相同的活泼金属反应,前者的反应速率大。
典型化学反应-强酸制弱酸。将二氧化碳通入NaA溶液中有HA生成,或HA溶液与NaHCO3溶液不反应。
存在电离平衡。向某酸溶液中滴加石蕊,之后缓缓加热,发现红色变深。
例 在0.1 ml•L-1的HCN溶液中存在如下电离平衡:HCN H++CN-,下列叙述正确的是( )A.加入少量NaOH固体,平衡逆向移动B.加水,平衡正向移动C.滴加少量0.1 ml•L-1的HCl溶液,溶液中c(H+)减小D.加入少量NaCN固体,平衡正向移动
强弱电解质的分类强弱电解质的电离
电离平衡的定义、特点电离平衡的影响因素弱电解质的判断
1、稀氨水中存在平衡NH3•H2O NH +OH-,若要使平衡逆向移动,同时使c(OH-)增大,应加入的物质或采取的措施正确的是( )A.加入少量的NH4Cl固体B.加入少量MgSO4固体C.升温D.加入NaOH固体
2.0.1 ml•L-1氨水10 mL,加蒸馏水稀释到1 L后,下列变化中正确的是( )①电离程度增大 ②c(NH3•H2O)增大③NH 数目增多 ④c(OH-)增大⑤导电性增强 ⑥ 增大A.①③⑥B.①②④C.①③⑤D.②③⑥
苏教版 (2019)选择性必修3专题3 石油化工的基础物质一烃第一单元 脂肪烃的性质及应用评优课课件ppt: 这是一份苏教版 (2019)选择性必修3<a href="/hx/tb_c4009355_t3/?tag_id=26" target="_blank">专题3 石油化工的基础物质一烃第一单元 脂肪烃的性质及应用评优课课件ppt</a>,文件包含311脂肪烃的类别烷烃的性质同步课件pptx、烷烃的性质导入视频mp4等2份课件配套教学资源,其中PPT共32页, 欢迎下载使用。
高中化学苏教版 (2019)选择性必修1专题3 水溶液中的离子反应第一单元 弱电解质的电离平衡公开课课件ppt: 这是一份高中化学苏教版 (2019)选择性必修1<a href="/hx/tb_c4009320_t3/?tag_id=26" target="_blank">专题3 水溶液中的离子反应第一单元 弱电解质的电离平衡公开课课件ppt</a>,共24页。PPT课件主要包含了学习目标,水的电离平衡,=1×10-14,Kw的应用,典例解析,课堂小结等内容,欢迎下载使用。
高中化学苏教版 (2019)选择性必修1第二单元 化学反应的方向与限度优秀ppt课件: 这是一份高中化学苏教版 (2019)选择性必修1<a href="/hx/tb_c4009316_t3/?tag_id=26" target="_blank">第二单元 化学反应的方向与限度优秀ppt课件</a>,共27页。PPT课件主要包含了学习目标,课程导入,可逆反应及其特征,可逆反应,典例解析,化学平衡状态,课堂小结等内容,欢迎下载使用。













