


苏教版 (2019)选择性必修2第二单元 元素性质的递变规优质ppt课件
展开1.能从原子核外电子排布的规则理解核外电子排布的周期性,能从外围电子排布的角度理解元素周期表中元素的分区及周期、族的划分,培养宏观辨识与微观探析的化学学科核心素养。2.通过原子结构与元素在周期表中的位置关系的相互推导,形成“结构—位置”的推导模型,强化证据推理与模型认知的化学学科核心素养。
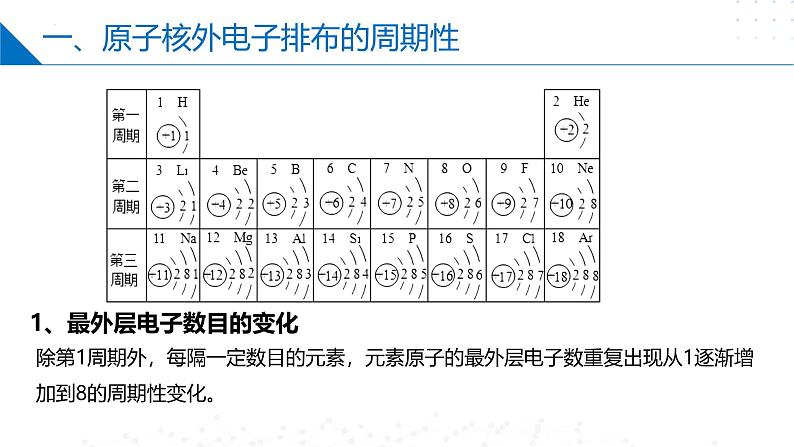
一、原子核外电子排布的周期性
除第1周期外,每隔一定数目的元素,元素原子的最外层电子数重复出现从1逐渐增加到8的周期性变化。
1、最外层电子数目的变化
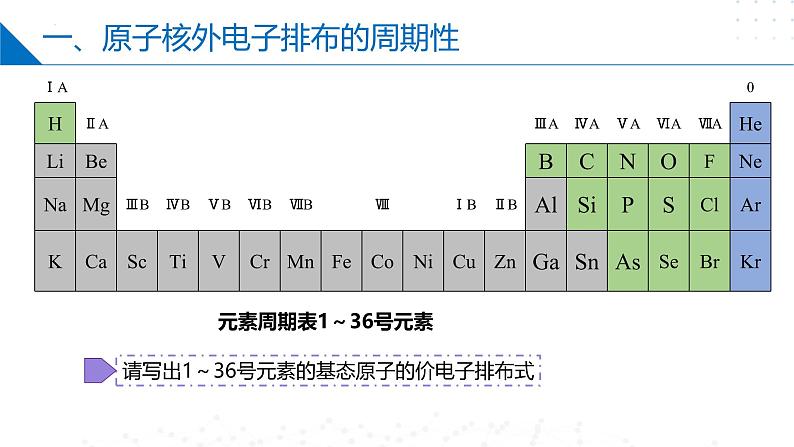
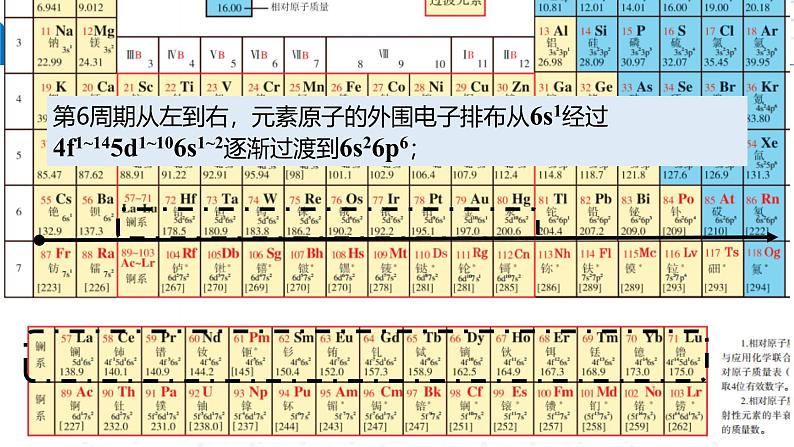
元素周期表1~36号元素
请写出1~36号元素的基态原子的价电子排布式
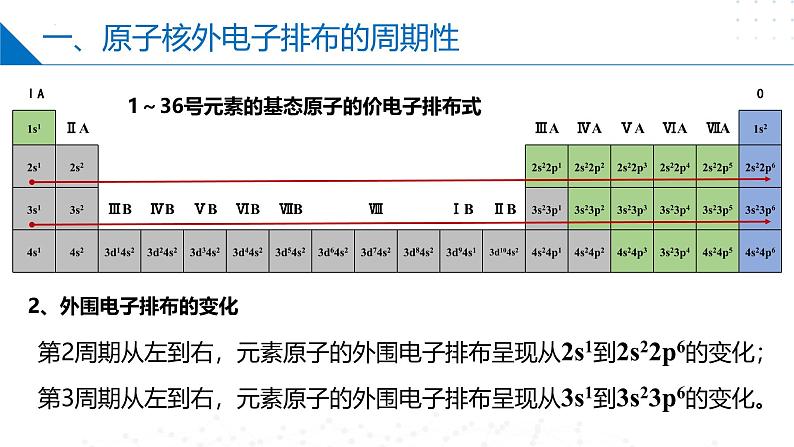
1~36号元素的基态原子的价电子排布式
第2周期从左到右,元素原子的外围电子排布呈现从2s1到2s22p6的变化;
2、外围电子排布的变化
第3周期从左到右,元素原子的外围电子排布呈现从3s1到3s23p6的变化。
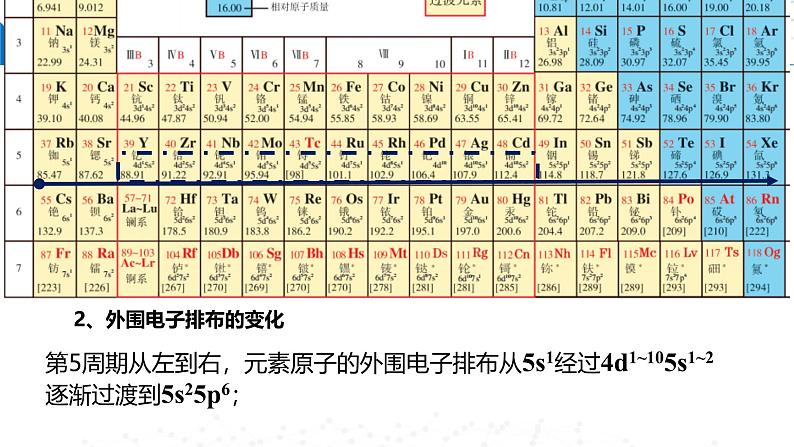
第4周期从左到右,元素原子的外围电子排布从4s1经过3d1~104s1~2逐渐过渡到4s24p6;
第5周期从左到右,元素原子的外围电子排布从5s1经过4d1~105s1~2逐渐过渡到5s25p6;
第6周期从左到右,元素原子的外围电子排布从6s1经过4f1~145d1~106s1~2逐渐过渡到6s26p6;
核外电子排布的周期性变化规律可以表示为
每隔一定数目的元素,元素原子的外围电子排布呈现从ns1到ns2np6的变化。
例1 X、Y、Z三种主族元素的原子,其最外层电子排布分别为ns1、3s23p1和2s22p4,由这三种元素组成的化合物的化学式可能是( )A.XYZ2 B.X2YZ3C.X2YZ2 D.XYZ3
元素周期表中每一周期的第一个元素(除第一周期外)都是碱金属,最外层电子排布式为ns1;每一周期的最后一种元素都是稀有气体元素,这些元素的最外层电子排布式都是ns2np6(He除外,为1s2)。每一周期(除第一周期外)都是由碱金属到稀有气体,如此循环往复,这就是元素周期表中的一个个周期。
核外电子排布与周期的关系
(1)元素周期表共有18列,16个族,其中第8、9、10三列为Ⅷ族。(2)第1列的电子排布通式为ns1,第17列的电子排布通式为ns2np5。同列元素的外围电子数不一定相等,如He的外围电子数为2,其他同族元素的为8。(3)ⅠA、ⅡA族的外围电子排布通式是ns1~2,第ⅢA~ⅦA族的外围电子排布通式是ns2np1~5,主族元素的外围电子数=族序数。(4)除镧系、锕系外,过渡元素外围电子排布通式为(n-1)d1~10ns1~2(钯为4d10);其中第ⅢB~ⅦB族的外围电子数=族序数;第ⅠB、ⅡB的族序数=最外层ns能级上的电子数。
原子核外电子排布与族的关系
二、元素周期表中区的划分
原子的电子层数=能级中最高电子层序数=周期序数
外围电子排布与周期表的关系
主族元素原子的外围电子数=该元素在周期表中的主族序数
根据元素原子的外围电子排布的特征,可将元素周期表分成五个区域:s区、p区、d区、ds区和f区
电子填充的最后一个能级是s能级
电子填充的最后一个能级是p能级
电子填充的最后一个能级是d能级
①s区:包括ⅠA、ⅡA族元素,价电子排布式为ns1~2, 最后一个电子填在ns能级上,除氢元素外均属于活泼金属元素,为碱金属和碱土金属。
②p区:包括ⅢA~ⅦA族以及0族元素,价电子排布式为ns2np1~6(除He外),最后一个电子填在np能级上,为非金属元素和少数金属元素。
③d区:包括ⅢB~Ⅷ族元素(除镧系、锕系外),价电子排布式为(n-1)d1~9ns1~2(钯除外),最后一个电子填在(n-1)d能级上,为过渡金属元素。
因为副族元素是从典型的金属元素过渡到非金属元素的中间元素,故又被称为过渡元素
d轨道可以不同程度地参与化学键的形成
④ds区:包括ⅠB、ⅡB族元素,价电子排布式为(n-1)d10ns1~2。先填满了(n-1)d能级而后再填充ns能级,为过渡金属元素(d区和ds区金属元素均为过渡金属元素)。
由于d轨道已填满电子,因此d轨道一般不参与化学键的形成。
⑤f区:包括镧系和锕系元素,价电子排布式为(n-2)f0~14(n-1)d0~2ns2。
镧系元素化学性质相近;锕系元素化学性质相近
沿着周期表中硼、硅、砷、碲、砹、与铝、锗、锑、钋之间画一条线。
线的左边是金属元素(氢除外),线的右边是非金属元素。非金属元素要集中在元素周期表右上角的三角区内。
按金属元素与非金属元素分区
金属与非金属交界处元素的性质特点
在元素周期表中位于金属和非金属分界线上的元素兼有金属和非金属的性质,位于此处的元素(如硼、硅、锗、砷、锑等)常被称为半金属或类金属(一般可用作半导体材料) 。
例2 已知某些元素在周期表中的位置如图所示,下列说法错误的是( )
A.元素②和⑤位于同一区B.元素③的基态原子中,未成对电子数为5C.与元素④具有相同最外层电子数的元素只可能处于ds区D.s区(除元素①外)、d区和ds区的元素都是金属元素
原子核外电子排布的周期性
最外层电子数目的变化外围电子排布的变化外围电子排布与周期表的关系
s区p区d区ds区f区
1、已知某元素的原子序数为31。下列说法错误的是( )A.该元素位于周期表的p区B.该元素在周期表中的位置是第4周期第ⅢA族C.该元素的外围电子排布式为3d104s24p1D.与该元素同族的第3周期元素的最高价氧化物对应水化物具有两性
2、长式周期表共有18个列,从左到右排为1~18列,即碱金属元素为第1列,稀有气体元素为第18列。按这种规定,下列说法正确的是( )A.第14列元素中未成对电子数是同周期元素中最多的B.只有第2列元素原子的最外层电子排布为ns2C.第4周期第8列元素是锰元素D.第15列元素原子的外围电子排布为ns2np3
苏教版 (2019)选择性必修2第二单元 元素性质的递变规精品ppt课件: 这是一份苏教版 (2019)选择性必修2<a href="/hx/tb_c4009333_t3/?tag_id=26" target="_blank">第二单元 元素性质的递变规精品ppt课件</a>,文件包含212原子核外电子的排布同步课件pptx、30-06-电子的跃迁-480P清晰-AVC00_00_04-00_01_58mp4、31-04-构造原理-480P清晰-AVC00_00_04-00_01_50mp4等3份课件配套教学资源,其中PPT共37页, 欢迎下载使用。
高中化学苏教版 (2019)选择性必修2第一单元 原子核外电子的运动精品课件ppt: 这是一份高中化学苏教版 (2019)选择性必修2<a href="/hx/tb_c4009332_t3/?tag_id=26" target="_blank">第一单元 原子核外电子的运动精品课件ppt</a>,文件包含211人类对原子结构的认识原子核外电子的远动规律同步课件pptx、1-原子轨道到底是什么样子-360P流畅-AVCmp4、1-电子是如何运动的神秘的量子-480P清晰-AVC00_00_26-00_01_58mp4、5-视觉盛宴电子轨道只用看的就可以了-480P清晰-AVC00_00_00-00_02_32mp4、原子结构的发展史mp4等5份课件配套教学资源,其中PPT共32页, 欢迎下载使用。
化学选择性必修2第2节 原子结构与元素周期表优秀课件ppt: 这是一份化学选择性必修2<a href="/hx/tb_c4002596_t3/?tag_id=26" target="_blank">第2节 原子结构与元素周期表优秀课件ppt</a>,共60页。PPT课件主要包含了教材分析,Ne3s1,Ne3s23p5,d54s1,d104s1等内容,欢迎下载使用。













