



选择性必修2第一单元 分子的空间结构优秀课件ppt
展开1.能依据分子的空间结构和键的极性判断分子的极性。了解极性分子、非极性分子、手性分子的概念,能从微观角度理解分子具有极性(或非极性)、手性的原因。2.会判断分子的极性,了解分子的极性对分子性质的影响。3.能描述手性分子的结构特征和性质特点。4.认识手性分子在药物研究中的重要作用。
微波炉加热的原理是什么?
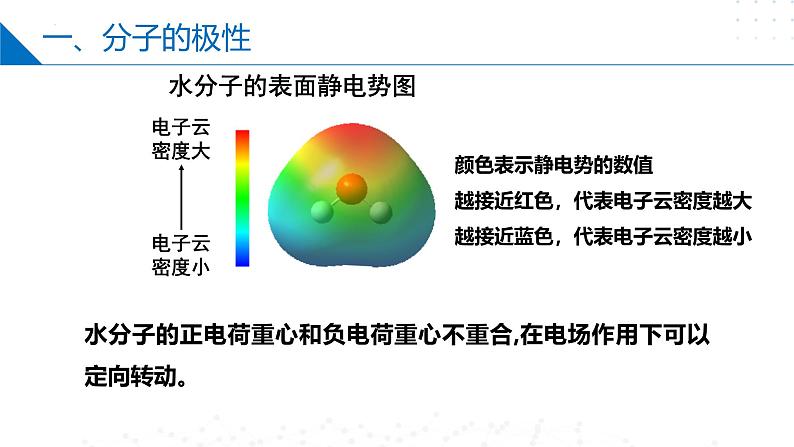
颜色表示静电势的数值越接近红色,代表电子云密度越大越接近蓝色,代表电子云密度越小
水分子的正电荷重心和负电荷重心不重合,在电场作用下可以定向转动。
分子是电中性的,但任何分子都有一个正电荷重心和一个负电荷重心。
正电荷重心和负电荷重心不相重合的分子
正电荷重心和负电荷重心相重合的分子
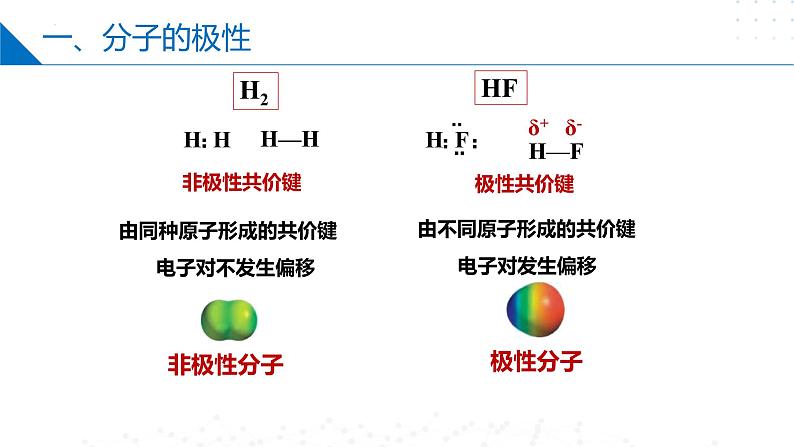
由同种原子形成的共价键
由不同原子形成的共价键
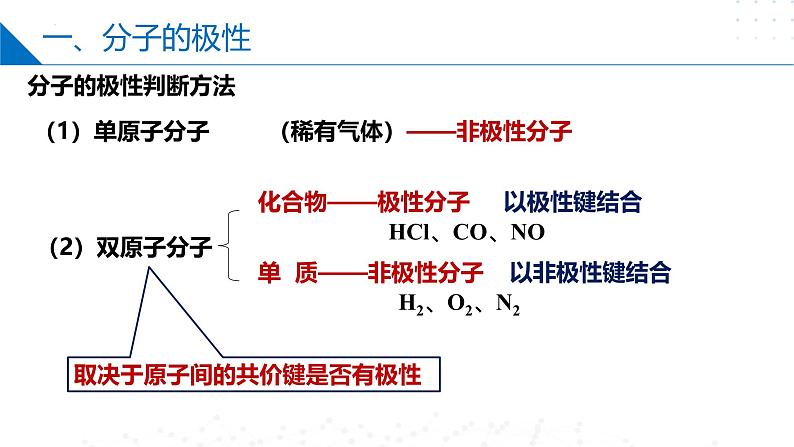
(稀有气体)——非极性分子
单 质——非极性分子
取决于原子间的共价键是否有极性
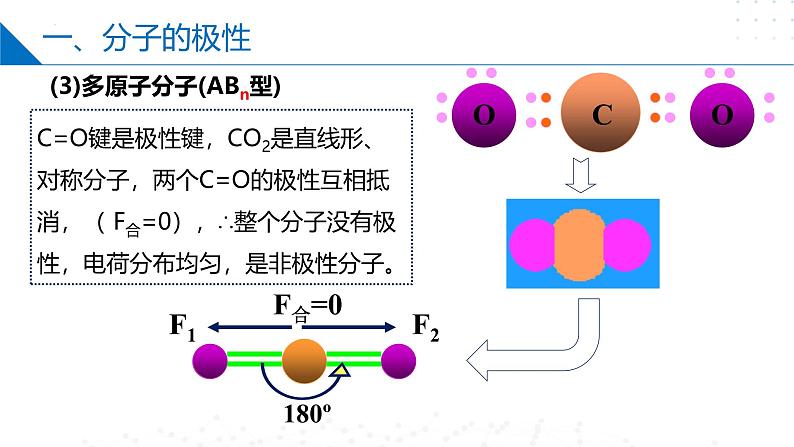
(3)多原子分子(ABn型)
C=O键是极性键,CO2是直线形、对称分子,两个C=O的极性互相抵消,( F合=0),∴整个分子没有极性,电荷分布均匀,是非极性分子。
根据元素化合价判断ABm型分子中,中心原子的化合价的绝对值等于该元素的价电子数时,该分子为非极性分子,此时分子的空间结构对称;若中心原子的化合价的绝对值不等于其价电子数,则分子的空间结构不对称,其分子为极性分子。
中心原子即其他原子围绕它成键的原子。分子中的中心原子最外层电子若全部成键不存在孤电子对,此分子一般为非极性分子;CH4、BF3、CO2等分子中的中心原子的最外层电子均全部成键,它们都是非极性分子。分子中的中心原子最外层电子若未全部成键,存在孤电子对,此分子一般为极性分子。H2O、NH3、NF3等分子中的中心原子的最外层电子均未全部成键,它们都是极性分子。
根据中心原子最外层电子是否全部成键判断
ABn分子极性的判断方法
①物理模型法(从力的角度分析)
在ABn分子中,A-B键看作相互作用力,根据中心原子A所受合力是否为零来判断,F合=0,为非极性分子(极性抵消),F合≠0,为极性分子(极性不抵消)
共价键和简单分子极性的力学分析示意图
O-H键是极性键,分子是V形不对称分子,两个O-H键的极性不能抵消( F合≠0),∴整个分子电荷分布不均匀,是极性分子
正四面体形 ,对称分子,C-H键的极性互相抵消( F合=0) ,是非极性分子
三角锥形, 不对称分子,键的极性不能抵消,是极性分子
平面三角形,对称分子,键的极性互相抵消( F合=0) ,是非极性分子
②根据所含共价键的类型及分子的空间结构判断
双原子分子:HCl、NO、COV型分子:H2O、H2S、SO2三角锥形分子:NH3、PH3非正四面体:CHCl3 特别地:H2O2、O3
单质分子:Cl2、N2、P4、O2直线形分子:CO2、CS2、C2H2正三角形:SO3、BF3平面形:苯、乙烯正四面体:CH4、CCl4、SiF4
分子的极性对物质的熔点、沸点、溶解性等物理性质有显著的影响。
蔗糖和硼酸易溶于H2O,难溶于CCl4;萘和碘却易溶于CCl4,难溶于H2O。
非极性溶质一般能溶于非极性溶剂,而极性溶质一般能溶于极性溶剂。
分子结构的相似性“相似相溶”还适用于分子结构的相似性。如乙醇分子中的—OH与水分子中的—OH相近,因而乙醇能与水互溶。当然,乙醇分子由于—OH的极性较强,易与H2O形成氢键也是其互溶的原因。而戊醇(CH3CH2CH2CH2CH2OH)中的烃基较大,烃基是非极性基团,是疏水亲油基团。戊醇在水中的溶解度明显小。烃基越大的醇在水中的溶解度就越小,羧酸也是如此。
氢键的影响溶剂与溶质之间存在氢键,溶解性好,溶质分子不能与水分子形成氢键,在水中溶解度就比较小。如NH3极易溶于水,甲醇、乙醇、甘油、乙酸等能与水混溶,就是因为它们与水形成了分子间氢键的原因。发生化学反应如果溶质与水能发生化学反应,也会增大溶质的溶解度。如SO2与水发生反应生成H2SO3,而H2SO3可溶于水,因此,SO2的溶解度较大。
例1 在HF、H2O、NH3、CS2、CH4、N2分子中:(1)以非极性键结合的非极性分子是_____。(2)以极性键相结合,具有直线形结构的非极性分子是_______。(3)以极性键相结合,具有正四面体结构的非极性分子是_______。(4)以极性键相结合,具有三角锥形结构的极性分子是_______。(5)以极性键相结合,具有折线形结构的极性分子是_______。(6)以极性键相结合,而且分子极性最大的是______。
左手和右手互为镜像,但不能相互叠合。
如果一对分子,它们的组成和原子的排列方式完全相同,但如同左手和右手一样互为镜像(对映异构),在三维空间里不能重叠,这对分子互称手性异构体。有手性异构体的分子称为手性分子。
同一个碳原子上连有四个不同的原子(基团)
互为镜像的分子在三维空间里不能叠合
当四个不同的原子或基团连接在碳原子上时,形成的化合物存在手性异构体。其中,连接四个不同的原子或基团的碳原子称为手性碳原子。每个手性碳原子所连接的原子或基团在空间的排布就像左右手关系(或实物与其镜像关系)那样,相似但不能重叠。
一对手性异构体的物理性质(如沸点、熔点、密度等)基本相同,但它们的旋光性和生理作用往往不同。
苧烯分子手性异构体的结构与存在
例如,苧烯的一对手性异构体的气味就完全不同,其中一种异构体存在于云杉的球果中,具有松节油的气味;而另一种存在于橙子中,具有橙子的气味。
20世纪60年代,欧洲发生的“反应停”药物事件引起了科学家的高度重视,这也引发了手性药物研究和开发的课题。
人们把含有手性分子的药物称为手性药物。一种药物分子必须包含适宜的官能团,这些官能团还必须以具有生物活性的构型排列。因此,在药物的合成过程中,“左”旋和“右”旋的药物手性异构体往往会被同时制造出来。
目前所用的很多药物都具有手性,它们主要通过与体内的酶、核苷酸等大分子作用,抑制(或激发)该大分子的生理活性,达到治疗疾病的目的。常用的手性药物有维生素E制剂、止痛药布洛芬等。药品布洛芬是D-异构体和L-异构体的外消旋混合物。L-布洛芬是止痛药,而D-布洛芬不是。但在人体内D-布洛芬可被转化为L-布洛芬。因此,人们直接服用外消旋混合物即可达到同样的治疗效果,而不需要服用更昂贵的L-布洛芬。
2001年,诺贝尔化学奖授予三位用手性催化剂生产手性药物的化学家。用他们的合成方法,可以只得到一种或者主要只得到一种手性分子,不得到或者基本上不得到它的手性异构分子,这种独特的合成方法称为手性合成。手性合成的药物生产造福人类并带来巨大的经济效益。
用他们的合成方法,可以只得到一种或者主要只得到一种手性分子,不得到或者基本上不得到它的手性异构分子,这种独特的合成方法称为手性合成。手性合成为药物生产造福人类并带来巨大的经济效益。
例2.下列对分子性质的解释中,不正确的是( )A.碘易溶于四氯化碳,甲烷难溶于水都可用“相似相溶规则”解释B.过氧化氢是含有极性键和非极性键的极性分子C.水很稳定(1 000 ℃以上才会部分分解)是因为水中含有大量的氢键D.青蒿素的分子式为C15H22O5,结构如图所示,该分子中包含7个手性碳原子
分子的极性分子的极性判断方法分子的极性对分子性质的影响
手性分子手性碳原子手性分子应用
1、下列现象中,不能用“相似相溶规则”解释的是( )A.乙醇与水以任意比例互溶B.用纯碱洗涤油脂C.氨易溶于水D.用苯将溴水中的溴萃取出来
2.下列分子中含有手性碳原子的是( )A.CBr2FClB.CH3CH2CH2OHC.CH3CH2CH3D.CH3CH(NO2)COOH
人教版 (2019)选择性必修2第三节 分子结构与物质的性质备课ppt课件: 这是一份人教版 (2019)选择性必修2<a href="/hx/tb_c4002448_t3/?tag_id=26" target="_blank">第三节 分子结构与物质的性质备课ppt课件</a>,共60页。PPT课件主要包含了极性键,共价键的极性,学习目标,分子的极性,负电荷两中心重合,ClCl,HCl,非极性键,非极性分子,极性分子等内容,欢迎下载使用。
选择性必修2专题4 分子空间结构与物质性质第一单元 分子的空间结构授课课件ppt: 这是一份选择性必修2专题4 分子空间结构与物质性质第一单元 分子的空间结构授课课件ppt,共39页。PPT课件主要包含了内容索引,素养阐释,自主预习新知导学,合作探究释疑解惑,问题引领,归纳提升,典型例题,课堂小结等内容,欢迎下载使用。
高中化学苏教版 (2019)选择性必修2专题4 分子空间结构与物质性质第一单元 分子的空间结构教课内容ppt课件: 这是一份高中化学苏教版 (2019)选择性必修2专题4 分子空间结构与物质性质第一单元 分子的空间结构教课内容ppt课件,共21页。PPT课件主要包含了手性分子,要点一分子的极性,要点二手性分子等内容,欢迎下载使用。













